【6.1.1】开发用于治疗疾病的治疗性抗体(抗体开发几大平台)
自从首个单克隆抗体于1986年获得美国食品和药物管理局(US FDA)批准以来,已经过去了三十多年,在此期间,抗体工程技术得到了巨大发展。当前的抗体药物由于其高特异性而具有越来越少的副作用。结果,治疗性抗体已成为近年来开发的新药的主要类别。在过去的五年中,抗体已成为制药市场上最畅销的药物,2018年,全球十大最畅销药物中有八种是生物制剂。 2018年,全球治疗性单克隆抗体市场价值约为1152亿美元,预计到2019年底将产生1500亿美元的收入,到2025年将产生3000亿美元的收入。因此,治疗性抗体药物市场作为新药经历了爆炸性的增长。已被批准用于治疗各种人类疾病,包括许多癌症,自身免疫,代谢和传染性疾病。截至2019年12月,美国FDA批准了79种治疗性单抗,但仍有巨大的增长潜力。这篇综述总结了最新的市场趋势,并概述了用于治疗性抗体药物开发的杰出抗体工程技术,例如单克隆抗体的人源化,噬菌体展示,人抗体小鼠,单B细胞抗体技术和亲和力成熟。最后,还将讨论未来的应用程序和前景。
一、背景
单克隆抗体(mAb)由B细胞产生,并特异性靶向抗原。 1975年Köhler和Milstein引入的杂交瘤技术[1]使得获得大量纯mAb成为可能,极大地增强了基础研究及其临床应用的潜力。 其他科学和技术进步也使单克隆抗体成功地应用于临床。 在全球范围内,商业公司已在临床试验中研究了至少570种治疗性mAb [2],并且79种治疗性mAb已获得美国食品和药物管理局(US FDA)的批准,目前已投放市场[3]。 ,包括用于治疗癌症的30 mAb(表1)。
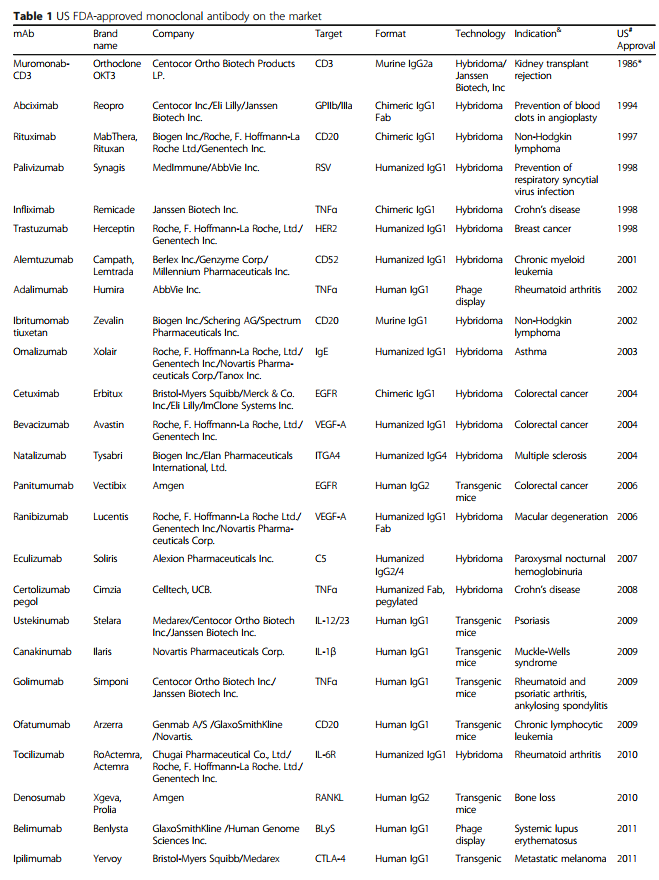
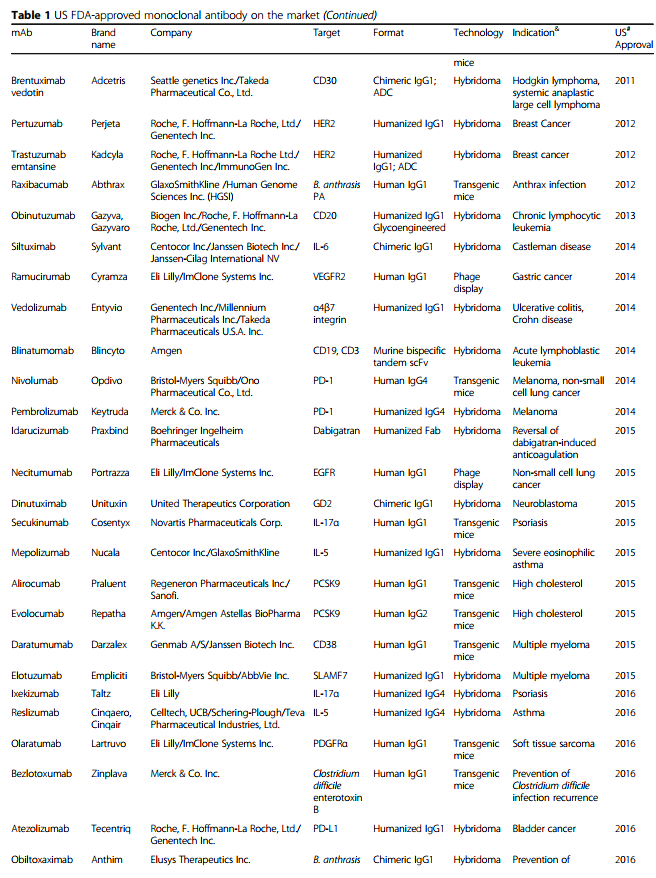
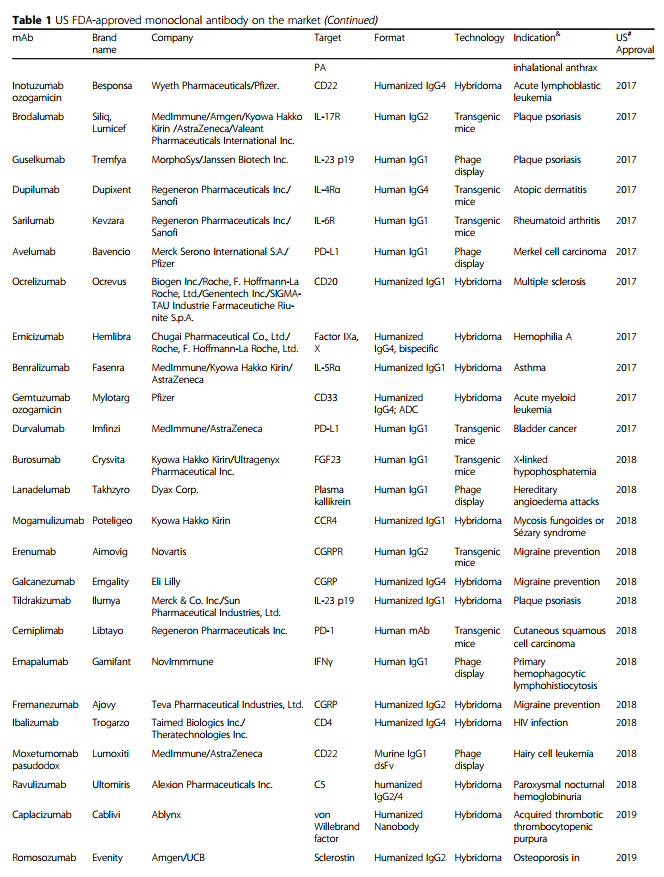

随着单克隆抗体在过去25年中已成为各种疾病的主要治疗方式,治疗性单克隆抗体的重要性日益提高(图1)。 在这段时间里,重大技术进步已使mAb疗法的发现和开发变得更快,更有效。 根据美国FDA的数据,自2008年以来,已批准了48种新的单克隆抗体,到2017年底在全球临床使用的单克隆抗体市场达到61个。 令人惊讶的是,从2018年到2019年,总共有18种新抗体被美国FDA批准-这个数字是通过各种网站(包括抗体协会[3],治疗性抗体数据库[4]和公司管道和新闻稿)中包含的信息统计得出的 。 表1列出了美国FDA批准的基于抗体的药物清单。
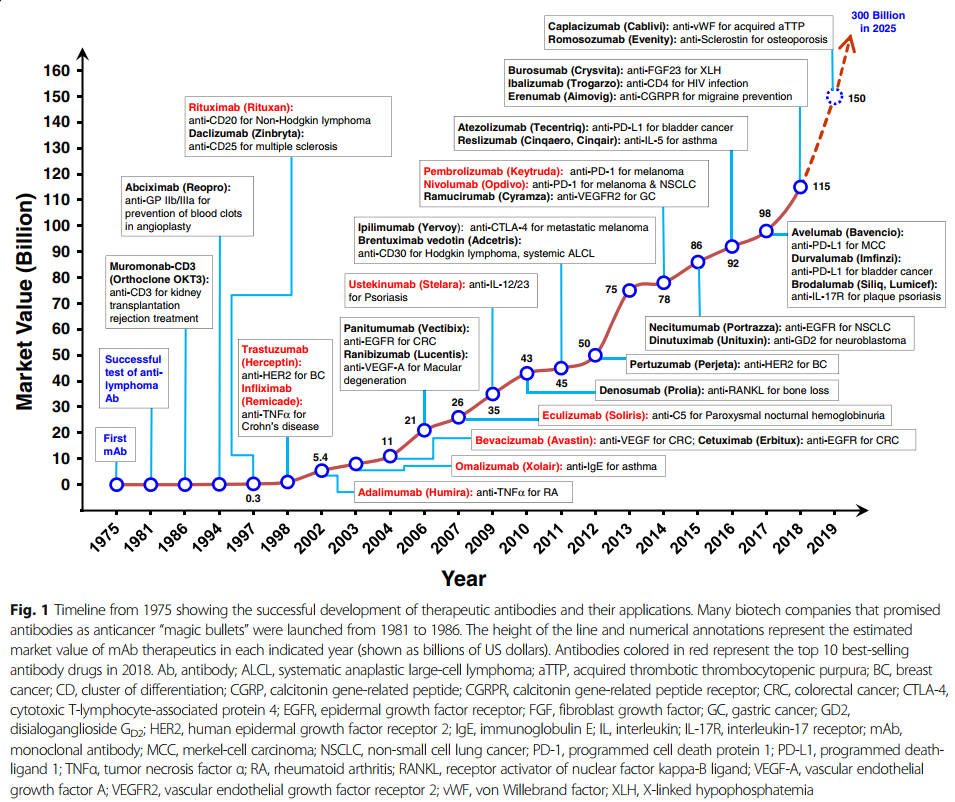
第一种治疗性单克隆抗体muromonab-CD3(Orthoclone OKT3)在1986年获得了美国FDA的批准[5],其中包含针对T细胞表达CD3的鼠单克隆抗体,该单克隆抗体可作为免疫抑制剂治疗急性移植排斥反应。 muromonab-CD3的销售终止日期为2011年7月30日(表1)。为了克服降低免疫原性潜力和功效的问题,同时使抗体在更长的治疗时间内应用成为可能,研究人员开发了将啮齿动物抗体转化为与人抗体更相似的结构而又不丧失结合特性的技术。第一种嵌合抗体,抗GPIIb / IIIa抗原结合片段(Fab)(abciximab),于1994年被美国FDA批准用于抑制心血管疾病中的血小板聚集(图1)。该药物是通过将鼠可变区和人恒定区的序列相结合而开发的(图2b)[6,7]。然后是第一个具有肿瘤学适应症的单克隆抗体,利妥昔单抗,一种嵌合抗CD20 IgG1,于1997年被美国FDA批准用于非霍奇金淋巴瘤(图1)[8,9]。
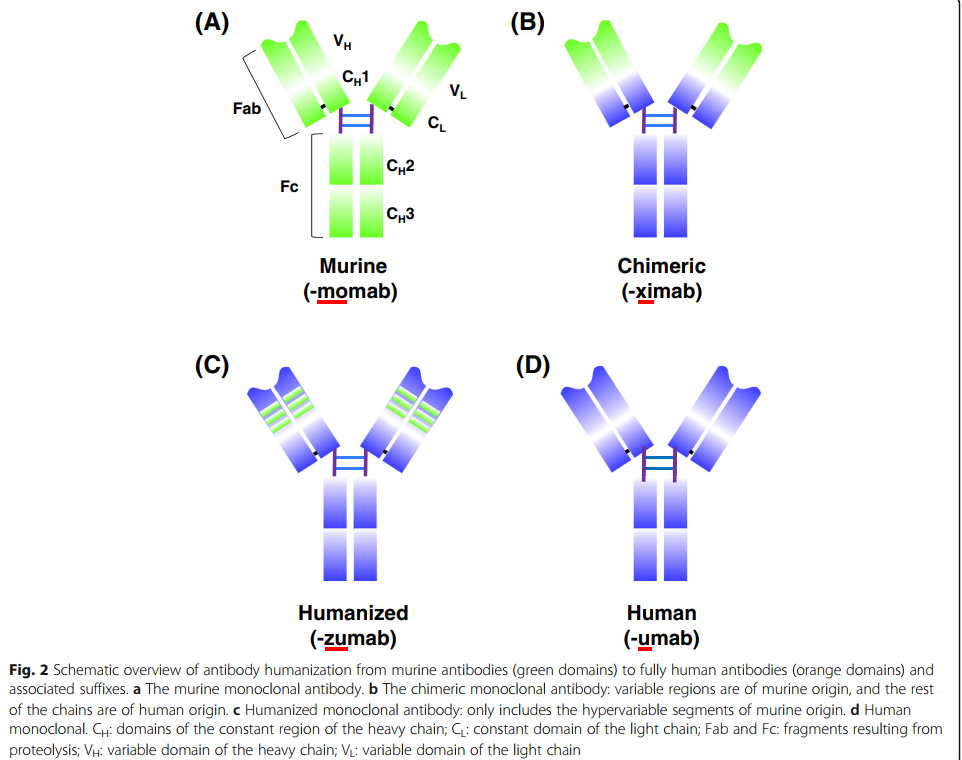
加速治疗性单抗批准的一项非凡进步是通过互补决定区(CDR)嫁接技术生成了人源化抗体[10]。在CDR移植中,非人类抗体CDR序列被移植到人类构架序列中,以维持靶标特异性[10](图2c)。 1997年,美国FDA批准的第一个人源化单克隆抗体是抗IL-2受体daclizumab,用于预防移植排斥(图1)[11]。抗体的人源化使其有可能在临床上应用针对需要长期治疗的疾病(例如癌症和自身免疫性疾病)的新型生物制剂[12]。
基于人源化单克隆抗体在临床上的成功,格雷格里·P·温特爵士(Sir Gregory P. Winter)于1990年开发了一种获得完全人源单克隆抗体的关键发现技术(图2d)[10,13]。该技术基于噬菌体展示,其中将各种外源基因掺入丝状噬菌体中以组成文库。然后将文库蛋白作为与噬菌体外壳蛋白的融合物呈现在噬菌体表面上,从而可以选择特定的结合物和亲和力特征。噬菌体展示技术是由乔治·史密斯(George P. Smith)首次提出的[14],它是一种强大的方法,可以快速识别与多种靶分子结合的肽或抗体片段,例如单链片段变量(scFv)或Fab(蛋白,细胞表面聚糖和受体)[15](图3b)。 2018年诺贝尔化学奖授予乔治·史密斯(George P.Smith)和格里高利·温特爵士(Sir Gregory P.Winter)。乔治·史密斯(George Smith)开发了噬菌体展示肽,可用于进化新蛋白质[14]。 Gregory P. Winter能够将噬菌体展示的抗体文库应用于抗体的发现和分离[13]。噬菌体展示技术也已通过CDR的定点诱变和亲和力选择用于抗体成熟。基于这些技术,美国FDA在2002年批准了首个完全人类治疗性抗体阿达木单抗(Humira),一种抗肿瘤坏死因子α(TNFα)人抗体[16](图1)。到目前为止,通过噬菌体展示产生的九种人抗体药物已获得美国FDA的批准(表5)。
转基因动物代表了另一种获得完全人源mAb的技术(图3c)。该技术是在1994年通过发表两种转基因小鼠品系HuMabMouse [35]和XenoMouse [36]引入的。对这些品系进行了基因修饰,将人类免疫球蛋白(Ig)基因插入基因组,取代了内源性Ig基因,使这些动物在免疫后能够合成完全的人类抗体[35,37]。在转基因小鼠中产生的首个抗表皮生长因子受体(EGFR)的人类抗体panitumumab已于2006年被美国FDA批准(图1)[38,39]。由转基因小鼠制成的完全人抗体的数量迅速增加,目前批准的药物数量为19种(表5)。取决于免疫方案,可以通过进一步选择从经免疫的转基因小鼠产生的杂交瘤克隆获得高亲和力的人抗体。使用理论上相似的方法,由人B细胞产生中和性人抗体也已为传染病治疗带来了有希望的结果。
双特异性抗体的最新发展为新型蛋白质疗法的设计提供了诱人的新机会。可以通过利用蛋白质工程技术连接两个抗原结合结构域(例如Fab或scFvs)来生成双特异性抗体,从而允许单个抗体同时结合不同的抗原。因此,可以将双特异性抗体工程化以表现出新颖的功能,这在两种亲本抗体的混合物中不存在。大多数双特异性抗体被设计为募集免疫系统的细胞毒性效应细胞以靶向病原细胞[40]。第一种批准的双特异性抗体是2009年在欧洲出现的catumaxomab [41]。 Catumaxomab靶向CD3和EpCAM以治疗恶性腹水患者的实体瘤。但是,由于商业原因,该药于2017年退出市场。当前,两种双特异性抗体已获得美国FDA批准并投放市场。首先,blinatumomab是一种针对CD3和CD19的双特异性T细胞接合子(BiTE),用于治疗B细胞前体急性淋巴细胞白血病(ALL)[42]。其次,艾米珠单抗是具有天然结构的全尺寸双特异性IgG,可结合活化的凝血因子IX和X来治疗A型血友病[43]。迄今为止,临床试验中有85种以上的双特异性抗体,其中约86%的抗癌药正在接受评估[40]。驱动双特异性抗体发展的概念和平台继续迅速发展,为实现重大的治疗突破创造了许多新的机会。
尽管mAb通常用于生物化学,分子和细胞生物学以及医学研究,但最有益的应用可能是将它们用作治疗人类疾病的治疗药物,例如癌症,哮喘,关节炎,牛皮癣,克罗恩病,移植排斥,偏头痛和传染病(表1)。在过去的十年中,抗体工程学的重要进展提高了治疗性抗体的安全性和有效性。这些发展,以及对抗体免疫调节特性的更深入了解,为下一代用于治疗人类疾病的新型基于抗体的新型药物铺平了道路。
二、治疗性抗体的临床应用和市场
目前被批准用于疾病治疗的治疗性抗体 mAb市场拥有健康的管道,并有望以不断增长的速度增长,目前在2018年的估值为1152亿美元[44]。尽管具有如此高的增长潜力,但新公司不太可能接管大市场,目前该市场由七家公司主导:基因泰克(30.8%),艾伯维(20.0%),强生(13.6%),百时美施贵宝Squibb(6.5%),默克·夏普(Merck Sharp&Dohme)(5.6%),诺华(5.5%),安进(4.9%),其他公司则占剩余的13%[44]。
许多单抗产品在2018年的年销售额超过30亿美元(图1),而六种(阿达木单抗,尼古拉单抗,派姆单抗,曲妥珠单抗,贝伐单抗,利妥昔单抗)的销售额超过60亿美元(表2)。阿达木单抗(Humira)的销售额创下生物制药产品的最高记录,接近199亿美元。表2列出了2018年最畅销的mAb产品。表2中,最畅销的mAb药物是根据生物或药理公司在2018年全年的新闻公告,电话会议,年度报告或投资者材料中报告的销售或收入进行排名的 ,显示名称,赞助商,疾病适应症和2018年销售额。
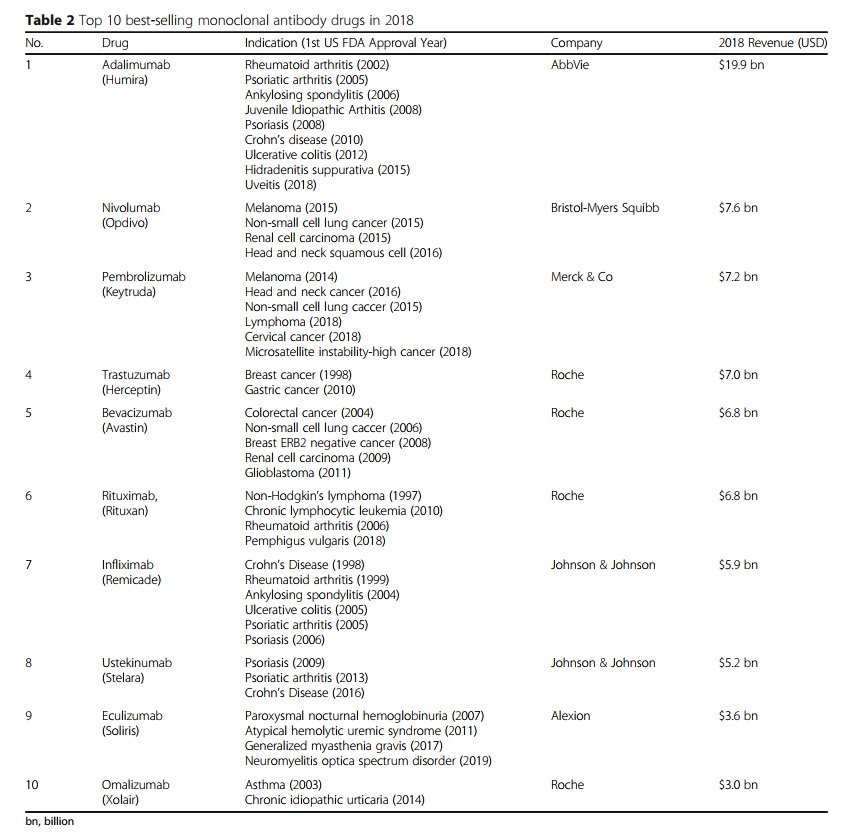
单克隆抗体越来越多地用于广泛的目标。肿瘤学,免疫学和血液学仍然是最流行的医学应用[45]。大多数mAb具有多种疾病迹象,并且至少一种与癌症相关(淋巴瘤,骨髓瘤,黑色素瘤,成胶质细胞瘤,神经母细胞瘤,肉瘤,结直肠癌,肺癌,乳腺癌,卵巢癌,头颈癌)。因此,肿瘤疾病是单克隆抗体治疗最容易获得的医学专业[45]。此外,已知可充当免疫系统刺激或抑制检查点的靶蛋白数量已大大增加,针对靶向程序性细胞死亡蛋白1(PD-1,西米普利单抗,nivolumab,pembrolizumab)及其配体程序性死亡的众多抗体疗法-配体1(PD-L1,durvalumab,avelumab,atezolizumab)或细胞毒性T淋巴细胞相关抗原4(CTLA-4,ipilimumab)已获准上市[46]。
阿达木单抗(Humira)是2018年全球最畅销的药物。阿达木单抗是一种皮下给药的生物疾病改良剂,用于治疗类风湿性关节炎和其他TNFα介导的慢性衰弱性疾病。它最初是由Abbvie在2002年获得美国FDA批准后在美国推出的。已证明,阿达木单抗可减轻成人中度至重度类风湿性关节炎的体征和症状,也可用于治疗银屑病关节炎,强直性脊柱炎,克罗恩氏病,溃疡性结肠炎,牛皮癣,化脓性汗腺炎,葡萄膜炎和青少年特发性关节炎[47,48]。它可以单独使用,也可以与改变疾病的抗风湿药联用[49]。
免疫检查点对于维持自我耐受和调节周围组织的生理免疫反应非常重要。因此,检查点下面的分子最近在癌症免疫治疗中引起了相当大的兴趣[50]。 nivolumab(Opdivo)和pembrolizumab(Keytruda)均为抗PD-1 mAb,分别是2018年最畅销的mAb药物的第二和第三名(表2)。 Nivolumab是一种人类抗体,可阻断通常可防止活化T细胞攻击癌细胞的信号。 nivolumab的靶标是PD-1受体,该抗体阻断PD-1及其配体PD-L1和PD-L2的相互作用,从而释放PD-1途径介导的免疫抑制作用[51,52]。Pembrolizumab 是一种人源化抗体,用于癌症免疫治疗,用于治疗黑素瘤,肺癌,头颈癌,霍奇金淋巴瘤和胃癌[53,54,55]。如果癌细胞过度表达PD-L1并且EGFR或间变性淋巴瘤激酶无突变,则Pembrolizumab是NSCLC的一线治疗药物[56,57]。大型的随机临床试验表明,与标准的二线治疗药物多西他赛相比,接受 nivolumab and pembrolizumab 治疗的NSCLC患者(均于2014年获得美国FDA批准)显示出总体生存率的提高。
2018年,美国共批准了12种新的单克隆抗体。这些产品中的大多数已批准用于非癌症适应症,这可能反映出抗体用于治疗其他疾病的批准成功率更高。批准了三种抗体(erenumab,galcanezumab和fremaezumab)用于预防偏头痛,一种抗体(Ibalizumab)用于人类免疫缺陷病毒(HIV)感染。三种预防偏头痛的药物Erenumab(Aimovig),galcanezumab(Emgality)和fremaezumab(Ajovy)是在偏头痛病因中阻断降钙素基因相关肽(CGRP)受体活性的mAb [59]。 CGRP通过异源受体起作用,该受体由G蛋白偶联受体(降钙素受体样受体:CALCRL)和受体活性修饰蛋白1(RAMP1)组成[60,61]。 galcanezumab和fremaezumab均与CGRP结合并阻断其与受体的结合。然而,erenumab是靶向人G蛋白偶联受体CALCRL和RAMP1的胞外域的三种抗体中的唯一一种,干扰了CGRP结合口袋[62]。
许多单克隆抗体正在开发中,以用于治疗传染病,目前美国FDA仅批准了四种单克隆抗体:雷西珠单抗和奥比妥昔单抗用于治疗吸入性炭疽[63],帕利珠单抗用于预防高危婴儿的呼吸道合胞病毒[64],和伊巴单抗治疗HIV感染患者[65]。 Ibalizumab(Trogarzo)是一种人源化IgG4 mAb,用作CD4结构域2导向的附着后HIV-1抑制剂。美国FDA批准了依巴珠单抗用于已感染HIV的成年患者,这些患者先前已经接受过治疗并且对目前可用的疗法有抵抗力。
目前在临床试验中的治疗性抗体
公司目前正在赞助570多种mAb的临床研究。其中,约90%是旨在评估患者人群安全性(第一阶段)或安全性和初步疗效(I / II阶段或II期)的早期研究。 I期的大多数mAb(〜70%)用于癌症治疗,而目前II期和后期临床研究(关键的II期,II / III期或第三阶段)[2]。
2018年,有29种新型抗体疗法正在针对非癌症适应症进行后期临床研究。在这些mAb的试验中,没有一个疗法占主导地位,但40%的疗法是免疫介导的疾病,这是最大的领域。在这组潜在的治疗方法中,leronlimab和brolucizumab将于2018年底进入监管审查,而五种mAb(肽类单抗,teprotumumab,crizanlizumab,satralizumab和tanezumab)可能会在2019年进入监管审查。相比之下,共有33种新型抗体疗法在2018年针对癌症适应症的后期临床研究中,实体肿瘤的抗体疗法显然占主导地位,只有不到20%的候选药物仅针对血液系统恶性肿瘤。五种单克隆抗体(伊沙妥昔单抗,斯巴达珠单抗,他法西坦单抗,多starlimab和ublituximab)许可申请已于2019年提交给美国FDA [2]。
Isatuximab是一种抗CD38 IgG1嵌合mAb,正在接受评估,可用于治疗多发性骨髓瘤(MM)患者。在针对MM患者的三项III期研究(ICARIA,IKEMA和IMROZ)中,正在测试isatuximab与不同化学疗法的组合。 ICARIA研究(NCT02990338)仅在难治性或复发性MM患者中评估isatuximab与pomalidomide和地塞米松联合治疗的疗效。 Pivotal III期ICARIA-MM试验结果表明,在2019年复发或难治性MM患者中,与单独使用pomalidomide和地塞米松相比,isatuximab联合疗法显示出统计学上的显着改善。美国FDA接受了isatuximab的生物制剂许可申请以复查复发的治疗或难治性MM患者。 FDA决定的目标行动日期是2020年4月[66]。 IKEMA(NCT03275285)和IMROZ(NCT03319667)研究正在评估MM患者中的isatuximab与其他化疗药物的结合[67]。
Spartalizumab是一种人源化IgG4 mAb,它以亚纳摩尔亲和力结合PD-1,并阻断其与PD-L1 / PD-L2的相互作用,阻止PD-1介导的抑制性信号传导并导致T细胞活化。 Spartalizumab的临床研究正在进行中,是一项随机,双盲,安慰剂对照的III期COMBI-i研究(NCT02967692),该研究评估了dabrafenib和曲美替尼联合spartalizumab的安全性和有效性,与之前未治疗的患者相比,安慰剂对照患有BRAF V600突变的不可切除或转移性黑色素瘤。该研究的主要终点是评估剂量限制毒性,肿瘤微环境中PD-L1水平和CD8 +细胞的变化以及无进展生存期。次要关键指标是总体生存率,总体缓解率和缓解持续时间。该研究的预计初步完成日期是2019年9月[68]。
Dostarlimab是一种抗PD-1 mAb,可用于治疗多种类型的癌症。葛兰素史克(GlaxoSmithKline)于2018年宣布了一项I期剂量递增和队列扩展研究(GARNET; NCT02715284)的结果,该研究有望支持在2019年向美国FDA提交生物制剂许可证申请。 GARNET研究中可用的治疗方法有限。在最初的4个周期中,每3周的剂量为500μmg,此后的四个队列中,每6周的剂量为1000μmg;微卫星不稳定性高(MSI-H)子宫内膜癌,MSI-H非子宫内膜癌,微卫星稳定型子宫内膜癌和非小细胞肺癌。 Dostarlimab也正在另一项III期研究(NCT03602859)中进行评估,该研究正在将以dostarlimab和niraparib为基础的铂类疗法与以铂类为基础的治疗方案作为III或IV期非粘液性上皮性卵巢癌的一线治疗进行比较[ 69]。
Ublituximab是一种糖工程化的抗CD20抗体,目前正在针对不同癌症(慢性淋巴细胞性白血病,CLL,非霍奇金淋巴瘤)和非癌症(多发性硬化症)适应症的五项后期临床研究中进行临床研究。三期III期研究正在探索ublituximab与其他抗癌药联合治疗的功效。在这些研究中,UNITY-CLL III期研究(NCT02612311)正在评估未治疗和先前治疗的CLL患者与抗CD20 obinutuzumab联合苯丁酸氮芥相比,ublituximab和PI3Kδ抑制剂TGR-1202的组合。其他两项III期研究(ULTIMATE 1,NCT03277261和ULTIMATE 2,NCT03277248)正在评估440复发性多发性硬化症患者与teriflunomide相比,ublituximab的疗效和安全性[70]。
三、开发治疗性抗体的方法
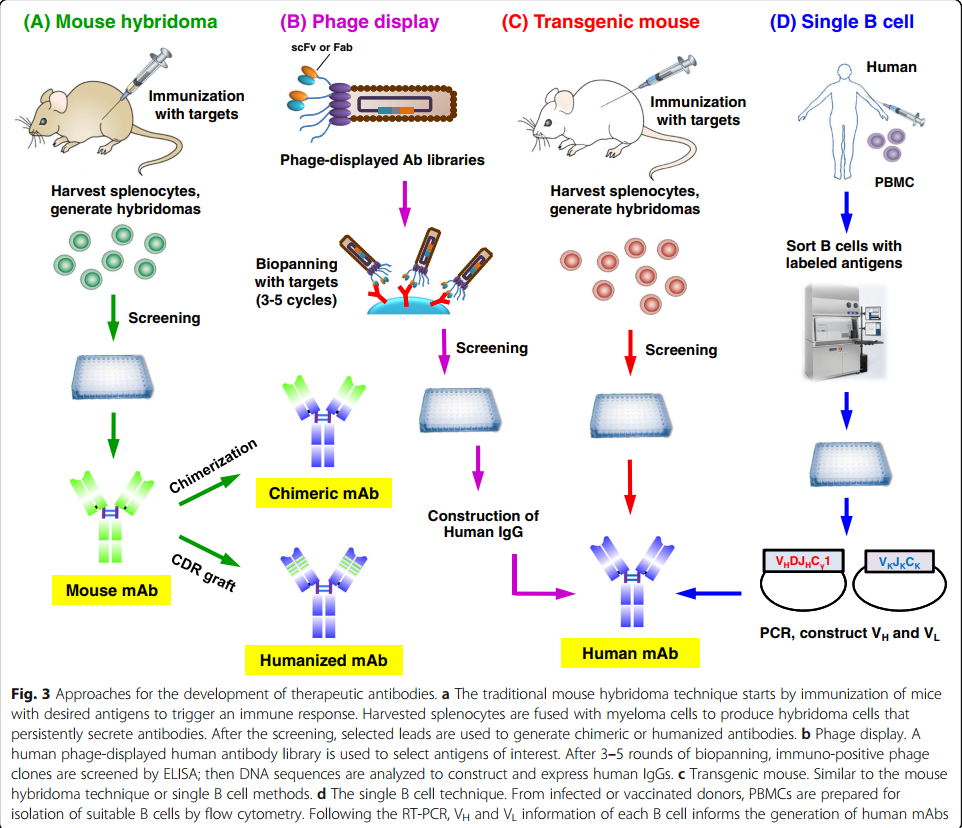
人,人源化,嵌合和鼠源抗体分别在临床使用中占所有mAb的51%,34.7%,12.5%和2.8%,使人源化和人源化mAb成为治疗性抗体领域的主要方式。在下一节中,我们首先介绍抗体人源化技术。然后,我们描述了与完全人类抗体的产生有关的三个技术平台,包括噬菌体展示,转基因小鼠和单B细胞抗体分离(图3)。最后,我们描述了使用亲和力成熟方法来优化抗体结合活性的方法。
3.1 单克隆抗体的人源化
由于鼠 mAb的可用性,低成本和快速的生产时间,已经大规模实施了鼠mAb的人源化。非人源化鼠单克隆抗体作为治疗方法有许多缺点。例如,用小鼠单克隆抗体治疗的患者将产生快速的人类抗小鼠抗体(HAMA)反应。 HAMAs不仅会加速小鼠mAb的清除,而且还可能产生不良的过敏反应和肿瘤渗透。而且,患者响应鼠片段可结晶区(Fc)而引发抗体依赖性细胞毒性(ADCC)的能力受到限制。另一方面,人源化mAb能够有效地发挥效应子功能,同时降低鼠抗体的免疫原性。
3.1.1 人源化单克隆抗体的产生
人源化单克隆抗体(其中只有轻链和重链的CDR是鼠类)于1988年首次进入临床研究阶段[71,72]。 CDR嫁接是人源化单克隆抗体生产中最流行的技术之一,最初由Gregory P. Winter在1986年开发[9]。使用这种技术,非人类CDR序列被移植到人类构架序列中,从而使抗体保持与靶抗原的结合活性[9]。 1997年,第一个美国FDA批准的CDR移植人源化单克隆抗体用于daclizumab,它与IL-2受体结合并用于防止移植排斥[11]。 Queen和合作者[73]不仅使用CDR嫁接,而且还使用与鼠类框架最大同源的人框架来开发daclizumab,以减少抗原识别的损失。在某些情况下,鼠框架中的某些氨基酸对于维持抗体结合活性至关重要。这些残基可与CDR协同作用以呈递抗体互补位或直接与抗原相互作用。目前,这些关键的构架残基可以通过X射线晶体学,冷冻电子显微镜和计算机辅助蛋白质同源性建模观察抗体-抗原复合物的结构来鉴定[74]。然后可以考虑通过CDR嫁接的人源化抗体中的“人回到小鼠”突变来恢复框架中氨基酸的位置,从而提高最终产品的亲和力和稳定性。当前,正在通过集成的生物信息学和抗体结构数据库来开发Web服务器,以进行人性化实验[75,76]。它们提供了用于人类模板选择,嫁接,反向突变评估和抗体建模的工具。但是,如果抗体的结合活性仍然受到损害,则应进一步进行亲和力成熟以改善这种情况。
已经开发出多种方法来量化mAbs可变区的人性。 Abhinandan和Martin设计了一种称为“ H评分”的工具来评估抗体序列的“人性”,与人可变区序列数据库的一个子集相比,该工具计算平均序列同一性[77]。随后定义生发指数以协助猕猴抗体的种系人源化[78]。 G分数源自H分数,以改善种系构架序列的分类[79]。 T20评分分析仪是在一个约38,700个人类抗体可变区序列的大型数据库下建立的,可以将人类序列与小鼠序列以及许多其他物种清楚地分开[80]。它用于揭示人源化抗体和完全人源抗体之间的相似性。这些人类得分工具可在线获得,并有助于人源化抗体的产生[80]。
人源化抗体的使用极大地帮助提高了mAb治疗剂的临床耐受性。对抗体序列的这种复杂控制为工程化单克隆抗体打开了大门,可在医学中广泛应用。当前,用于治疗人类的所有单克隆抗体中有一半是嵌合的或人源化的(图2,表1)。最著名的人源化抗体之一是曲妥珠单抗(赫赛汀),该药物于1998年获得批准,2018年的年销售额超过70亿美元(表2)。曲妥珠单抗用于治疗人表皮生长因子受体2(HER2)阳性转移性乳腺癌和胃食管连接腺癌[57,58]。
3.1.2 基于抗体的治疗剂的免疫原性
在临床环境中使用mAb应该具有几个必不可少的生物物理特性,包括高抗原结合活性,高稳定性和低免疫原性[81]。抗体的免疫原性是指宿主免疫系统可以识别这些治疗剂并对其做出反应的程度。可以发现由免疫系统诱导的抗药物抗体(ADA),同时在给予抗体药物的患者中发生了免疫原性。抗药物抗体具有中和治疗剂的潜力,这可能会降低药物的功效[82]。重要的是,抗药物抗体可能进一步在患者中引起从皮疹到全身性炎症反应的不良反应,这可能会影响抗体药物在临床中的安全性和功效[83]。免疫原性受多种因素影响,例如药物剂量,给药策略(途径和组合),杂质污染,Ab / Ag结合复合物产生的聚集体和结构特征(序列变异和糖基化)[84]。
人源化抗体在恒定区中携带人序列,在Fv中几乎包含所有人序列,其中只有CDR被鼠类移植。在临床环境中,类人抗体通常使它们具有较高的耐受性和较低的免疫原性。例如,Perpetua等展示了支持这一概念的案例[85]。他们将人源化抗CD52抗体与其亲本小鼠版本进行了比较,并证明了人源化显着降低了免疫原性。然而,人源化抗体保留鼠CDR,其可被宿主免疫系统视为外源抗原,并最终产生免疫原性。例如,在治疗过程中接受曲妥珠单抗治疗的转移性乳腺癌妇女中有0.5%检测到ADA [86]。最近,临床数据的免疫原性分析结果表明,曲妥珠单抗治疗的HER-2阳性乳腺癌患者的ADA率为7.1%(21/296)[87]。同一抗体药物的免疫原性差异可能是由许多潜在因素引起的:年龄,种族,遗传背景,其他相关疾病以及药物管理计划。
完整的人类抗体的CDR和框架是针对人类免疫球蛋白基因库而衍生的,因此理论上可以绕过免疫原性。然而,已经报道了几种完全人类抗体在患者中给药时可诱导明显的免疫反应[88]。据报道,人IgG1阿达木单抗(Humira)通过引起部分患者(5-89%)的抗独特型抗体产生明显的免疫反应,具体取决于疾病和治疗方法[89,90]。完全人类抗TNFα抗体戈利木单抗(Simponi)结合甲氨蝶呤用于治疗类风湿关节炎,导致16%的患者产生抗药物抗体[91]。这些情况的一个原因是人抗体的Fv序列与人种系不同:通过VJ和VDJ随机重组产生的抗体进化,以及通过体细胞超突变体内自然发生的亲和力成熟。到目前为止,还没有体外或计算机分析可以准确分析抗体的免疫原性。体内评估通常用于评估免疫原性,其结果将改善抗体治疗剂的设计和工程设计,以减少诱导抗药物抗体的潜力。
3.2 通过噬菌体展示产生人抗体
3.2。1 抗体噬菌体文库概述
噬菌体展示是体外抗体选择的第一个也是仍然最广泛使用的技术。该策略是基于1985年George P. Smith的出色工作开发的[14],他使用重组DNA技术将外源肽与噬菌体M13的外壳蛋白(pIII)融合,以便在噬菌体表面展示肽。然后,他创建了“抗体选择性噬菌体载体”,并描述了一种体外方法,该方法能够从10^8倍过量的噬菌体库中亲和选择抗原特异性噬菌体展示的抗体[92]。后来发现,scFv(小抗体形式)可以在噬菌体丝上表达。当时,有三个不同的研究机构独立建立了噬菌体展示的scFv或Fab抗体库:英国的MRC分子生物学实验室[13,93,94],德国的德国癌症研究中心[95],以及美国斯克里普斯研究所[96]。从那时起,这些噬菌体展示的抗体库已被证明是用于鉴定有效的,完全人源的单克隆抗体的可靠发现平台[97]。
从噬菌体展示的文库鉴定mAb的过程始于抗体文库的构建(图4a)。将代表Ig基因编码库的可变重链(VH)和可变轻链(VL)聚合酶链反应(PCR)产物连接到噬菌体展示载体(phagemid)中。来自人类外周血单核细胞(PBMC)的高质量mRNA被逆转录为cDNA。然后使用特异性引物扩增不同的VH和VL链区基因家族,以扩增Ig谱库中的所有转录可变区[98,99]。噬菌体展示文库中的抗体形式可以是scFv或Fab片段(图4b); scFv由通过短柔性接头连接的VH和VL域组成。展示在噬菌体外壳蛋白上的抗体Fab片段具有相对较高的结构稳定性,通常可以在不损害结合活性的情况下轻松转化为完整的IgG抗体[100,101]。通过噬菌体颗粒在抗体表型(特异性和敏感性)与基因型(遗传信息)之间的联系中可以明显看出噬菌体展示文库的优雅。由于噬菌体颗粒的小尺寸和高溶解度(10^13个颗粒/ ml),可以有效地产生多达10^11个独立克隆的库大小,并在单个文库中展示。

噬菌体展示文库的基因库可得自幼稚或免疫的动物,或可使用固定框架内的随机CDR序列合成构建文库。噬菌体展示纯正抗体库是由IgM组成部分的重排V基因构建的。由于基因序列是从人类供体的B细胞衍生而来的,因此幼稚的文库相对接近人类抗体的种系,并且具有较低的免疫原性风险。免疫文库比单纯文库的主要优势在于,免疫文库中的抗体基因在体内已经经历了天然亲和力成熟,从而可以开发出针对靶标的高亲和力抗体。但是,这种方法要求目标抗原可以成功诱导免疫原性应答,并且必须为每个新靶标准备新的文库。单个大的纯正[94、104、105]库和合成的[102、106、107]库已针对多种靶标产生了高亲和力抗体(亚纳摩尔范围)。因此,这种非免疫文库具有避免免疫小鼠免疫耐受性问题的独特优势,并且它们不需要为每个新靶标建立新的免疫文库。
目前,几乎所有可广泛使用的商业文库都是基于高度多样化的非免疫基因库,这些库可选择针对几乎无限数量的靶标的抗体[108]。值得注意的是,大多数在临床试验中经过评估的抗体药物都来自少数公司拥有的库。这些库包括:Cambridge Antibody Technology(现在是AstraZeneca的子公司MedImmune)的scFv片段文库,Dyax Corp(现在的Shire)人Fab片段文库,XOMA的scFv和Fab库以及完全合成的人组合抗体scFv(HuCAL )和由MorphoSys开发的Fab(HuCALGold)库[97]。
3.2.2 人类抗体的亲和力选择
通常通过迭代选择循环来筛选抗体文库,以富集靶结合噬菌体,然后在大肠杆菌细胞中扩增结合的噬菌体。抗体文库的亲和力筛选过程称为生物淘选(图4c)。重复的选择回合允许富集非常罕见的抗原结合噬菌体克隆,最终导致选择最高度特异性的结合剂。这个严格的过程是噬菌体展示的关键特征,它允许在短短几周的时间内分离出mAb,比传统的杂交瘤方法要快得多[99,109]。对于体外选择,必须将靶抗原固定在固体表面上。具有高蛋白结合能力的聚苯乙烯表面,例如96孔免疫板和免疫管,被广泛用于抗原固定。另外,具有蛋白G / A,链霉亲和素,马来酰亚胺或N-羟基琥珀酰亚胺的磁珠可用于固定抗原并在溶液中进行生物淘选。
生物淘选方法不仅限于已知的重组蛋白。实际上,噬菌体展示技术也可以用于选择针对全细胞的抗体,从而在肿瘤细胞表面上揭示出先前未知的抗原[110]。癌症是一种极为不同的疾病,只有少数具有茎样(stem-like)特性的肿瘤细胞能够启动并维持肿瘤的发展。这些细胞通常被称为肿瘤起始细胞或癌干细胞(CSC)[111]。噬菌体展示技术非常适合用于CSC研究,并且已经从噬菌体展示库中鉴定出了几种抗体,它们具有结合已知CSC标记(例如CD133和CD44)的能力[112,113]。此外,可以通过选择与CSC样群体结合的噬菌体展示抗体来鉴定新的CSC表面标记,然后鉴定相应的靶抗原[114,115]。肿瘤活检组织作为生物材料的使用使研究人员能够探查肿瘤的微环境,这可能与临床应用高度相关。噬菌体展示技术已用于探测癌组织活检,以产生能特异性识别肿瘤亚群的抗体片段,例如CSC和与肿瘤相关的内皮细胞[116,117,118]以及其他与临床相关的肿瘤抗原[119]。
抗体或抗体片段因其将药物归巢到肿瘤的能力而被称为靶向药物递送“导弹” [120]。例如,已经证明免疫脂质体可以提供具有癌症靶向能力的常规脂质体药物,从而可以提高抗癌药物的治疗功效[121]。靶向配体的细胞内在化是成功靶向肿瘤的脂质体药物递送的重要结果[99,122]。因此,设计了一种有效的基于噬菌体展示的选择方法来绘制肿瘤内在表位,其中将噬菌体展示的文库与活癌细胞在37°C下孵育[123]。该方法已成功用于快速鉴定几种类型的肿瘤中具有高内在化率的几种scFv。随后鉴定了靶抗原,并进一步开发了细胞内药物递送系统[99,124]。
具有噬菌体展示的单克隆抗体的鉴定完全是体外过程。因此,它不受免疫学耐受性的限制,从而允许鉴定针对免疫原性差的抗原的抗体或使用动物免疫方法难以获得的抗体(例如,聚糖或毒性剂)。当在突发性传染病暴发中鉴定针对新型或基因突变病原体的特异性抗体时,该测定法的体外性质可能特别有用[125,126,127]。病原体上的抗原通常会在患者体内引起强烈的免疫反应,使受感染的人自然会自然产生高亲和力抗体[128]。为了获得这些抗体,可以快速收集来自病原体感染者PBMC的mRNA,并将其用作噬菌体展示文库的基因库[129]。这样的文库可以允许快速鉴定高亲和力的抗体,然后将其用作疫苗设计或开发治疗药物和诊断试剂的指南。
此外,已经对生物淘选方法进行了修改,以分离和鉴定一些对大流行性流感病毒具有广泛中和活性的抗体[130,131]。 Chen等。报道了建立于噬菌体展示的Fab文库,该文库来自于感染新型甲型流感病毒H7N9的康复患者的PBMC,该文库于2013年爆发。使用该文库,分离了针对纯化的H7N9病毒体的抗体[132]。发现两种人抗体由于它们与病毒血凝素抗原的受体结合位点相互作用而对活H7N9病毒表现出高中和活性[132,133]。
新近出现的中东呼吸综合征冠状病毒(MERS-CoV)引起严重的急性呼吸综合征样疾病,死亡率约为43%[134]。迄今为止,尚无用于预防或临床治疗MERS的疫苗或抗病毒药物。大型噬菌体展示的人类天然scFv文库(Mehta I / II)具有Dana-Farber癌症研究所的2.7××10^10克隆,可用于分离抗MERS-CoV的人类抗体[135]。在另一个项目中,马来西亚的一个研究小组使用了一个纯真的人类scFv文库(库大小为109)改进了淘选策略,以成功鉴定出针对MERS-CoV核蛋白的单克隆抗体[136]。
诸如此类的研究提供了对人抗体对病毒病原体感染的反应的见解,并提供了如何利用爆发现场来开发基于人抗体的免疫疗法以预防和早期治疗病毒病原体的实例[137]。
3.2.3. 噬菌体展示技术成功开发抗体药物
从噬菌体展示或转基因小鼠方法中发现了目前临床使用的完全人类治疗性抗体[138]。噬菌体展示的优势是允许研究人员定制成功抗体药物的关键特征(例如亲和力,特异性,交叉反应性和稳定性)。目前有9种噬菌体展示来源的人类抗体已获得美国FDA批准用于治疗人类疾病(表1),证明了该技术作为抗体发现平台的可靠性。
阿达木单抗(Humira)由巴斯夫生物研究公司和Cambridge Antibody Technology开发。它不仅是首个获得市场认可的噬菌体展示衍生抗体,而且阿达木单抗也是首个获得批准(2002年)的完全人类单克隆抗体药物[139]。阿达木单抗结合并抑制TNFα,并被批准用于治疗炎症性疾病,例如类风湿和牛皮癣性关节炎,克罗恩病和牛皮癣。根据AbbVie的报告,阿达木单抗是全球最畅销的药物[140],2018年的销售额为199亿美元(表2)。 Cambridge Antibody Technology还从噬菌体展示中鉴定了靶向BLYS(B淋巴细胞刺激物)的人抗体[141]。 BLYS是细胞因子肿瘤坏死因子超家族的成员,可诱导B细胞增殖和分化,与系统性红斑狼疮(SLE)正相关。该抗BLYS抗体被命名为belimumab,并由葛兰素史克(GlaxoSmithKline)以Benlysta的形式销售,成为首个批准用于治疗SLE的药物(2011年)[142]。成立于1989年的Cambridge Antibody Technology在2006年被阿斯利康(AstraZeneca)以13.2亿美元的价格收购[143]。
酪氨酸激酶受体,包括EGFR和血管内皮生长因子受体2(VEGFR2),在肿瘤发生中起着至关重要的作用,在肿瘤中的表达和活化高于正常组织。这些特征使受体成为药物开发的潜在有价值的靶标。 Necitumumab(Portrazza)是一种抗EGFR人类抗体,通过用3.7××10^10克隆的未免疫噬菌体Fab文库筛选高表达EGFR的表皮癌细胞(A431)来鉴定[105]。 Necitumumab于2015年获得批准,现已成为吉西他滨和顺铂联合治疗鳞状NSCLC的一线疗法[144]。 VEGFR2不仅在调节肿瘤血管生成的肿瘤内皮细胞中高表达,而且还在癌细胞表面表达。抗VEGFR2人类抗体雷莫昔单抗(Cyramza)被批准用于治疗胃癌,转移性NSCLC和转移性结直肠癌[145,146]。通过使用噬菌体展示的人类幼稚Fab文库(Dyax)来启动ramucirumab的开发,该文库包含3.7××10^10个独立克隆,可针对人类VEGFR2蛋白的胞外域进行生物淘选[105]。选择三个Fab克隆D2C6,D2H2和D1H4,是基于它们以纳摩尔亲和力特异性结合VEGFR2以及中和VEGF-A激活的VEGFR2信号传导的能力。有趣的是,这三个Fab克隆不会与鼠VEGFR2交叉反应,并具有相同的VH序列[147]。在经过严格的生物淘淘轮亲和力成熟后,选择了Fab克隆1121(IMC-1121B),显示出VEGFR2结合活性提高了30倍以上。该克隆随后被工程化为具有50 pM亲和力的人类完整IgG1版本(ramucirumab)[148]。
PD-L1是一种细胞表面蛋白,与免疫细胞上的受体PD-1结合,下调T细胞的炎症活性,从而增强免疫系统的自我耐受性。已经发现许多类型的肿瘤利用免疫抑制作用逃避免疫攻击,从而在癌细胞表面表达PD-L1。 Avelumab(Bavencio)是抗PD-L1的完全人源IgG1λ抗体,其衍生自噬菌体展示的纯天然Fab文库(Dyax)[149]。 Avelumab不仅阻断PD-L1与PD-1的结合,而且还诱导癌症中的ADCC [150]。后面的功能不同于其他免疫检查点阻断抗体。美国FDA于2017年批准了avelumab用于治疗侵袭性皮肤癌尿路上皮癌和默克尔细胞癌[151]。
牛皮癣是一种慢性自身免疫性炎性疾病,会引起皮肤细胞过度生产,其特征是出现红肿,发红的病变和斑块,并伴有身体疼痛和瘙痒。 Guselkumab(Tremfya)是Janssen开发的完全人源抗体,可中和抗IL-23。在来自MorphoSys的许可下,使用了HuCAL抗体库来生成guselkumab [152,153]。 2017年,guselkumab被美国FDA批准用于治疗斑块状牛皮癣[154]。
遗传性血管性水肿是一种罕见的疾病,会导致自发性,复发性以及可能威胁生命的身体各部位肿胀发作[155]。该疾病通常与C1酯酶抑制剂的缺乏或功能障碍以及激肽释放酶过高引起的缓激肽产生有关[156]。 Lanadelumab(Takhzyro)是衍生自Dyax噬菌体文库的全人类mAb;它直接结合血浆激肽释放酶的活性位点以抑制缓激肽的产生。 Lanadelumab于2018年在美国和加拿大获得批准,用于预防≥12岁的患者发生遗传性血管水肿[157]。
药物开发工作的成功在很大程度上取决于获得产品和技术的专利保护,同时避免侵犯向他人授予的专利。因此,噬菌体展示抗体发现平台的知识产权构成了不断变化的格局,极大地影响了药物开发。目前(2019年),关于噬菌体展示技术的几乎所有关键专利都已过期,包括在2011年在欧洲到期的百年灵/杜贝尔(EP0440147)和麦卡菲蒂/冬季(EP0774511,EP0589877)专利[149]。涉及Dyax和Cambridge Antibody Technology噬菌体抗体库的美国专利也已经达到其20年保护期的末期(表3)。这些专利的到期将允许更多的公司创建噬菌体展示人类抗体库,从而将治疗性抗体推向临床。解除知识产权限制也将促使学术机构将已开发的噬菌体展示抗体转化为临床。
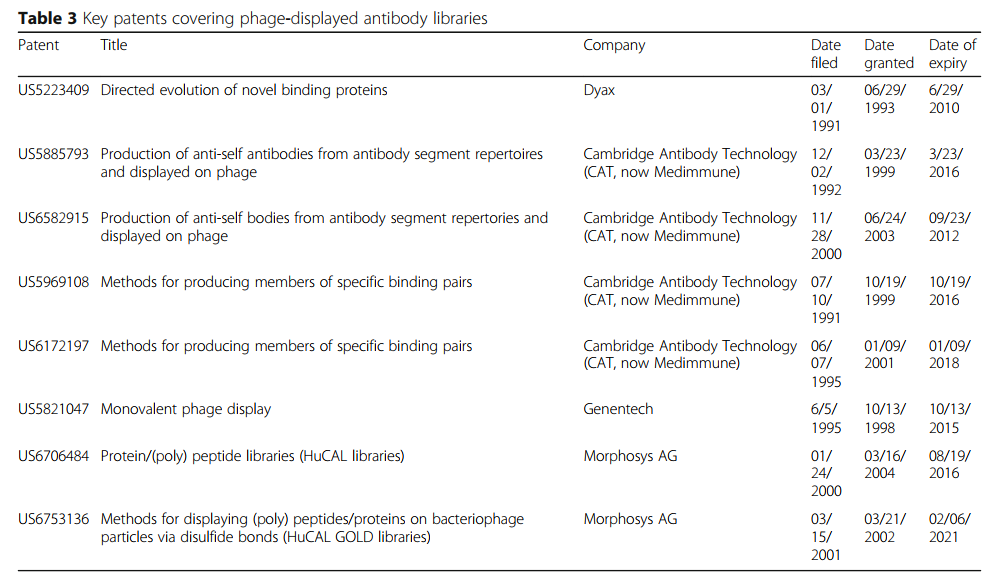
许多研究人员已开始利用这些免费技术。例如,哈佛大学Dana-Farber癌症研究所的Wayne Maraso及其同事已经构建了两个噬菌体展示文库,其中包含120亿个(Mehta I)和150亿个(Mehta II)人天真的scFv抗体噬菌体。这些文库已被用于鉴定针对多种靶标的众多人scFv抗体[158,159]。詹姆斯·马克(James Marks)的小组还在加利福尼亚大学旧金山分校建立了一个噬菌体展示的人类scFv库,该库包含67亿成员[98]。该文库产生了一组针对膜蛋白和具有纳摩尔级亲和力的生物组织的特异性抗体[98,160,161]。我们还在台湾中央研究院细胞与生物生物学研究所(ICOB)建立了噬菌体展示的人类幼稚scFv文库。从50个健康人类供体的PBMC中分离出ICOB噬菌体抗体库的抗体基因库,从而产生了600亿个单个scFv克隆的库大小。该收集物已成功用于选择与多种靶抗原结合的抗体,包括纯重组蛋白,聚糖,癌细胞和病毒颗粒[99、103、104]。
3.3 产生人抗体的小鼠
转基因动物为抗体药物开发提供了可靠的平台。 与生产人类抗体的其他技术相比,转基因动物具有多个优势,即无需人源化,更多的多样性,体内亲和力成熟和优化抗体的克隆选择。 然而,在转基因小鼠抗体技术的发展过程中,大规模人Ig基因座是一个挑战。 另外,在转基因小鼠中产生与人类相似或可比的库中的库需要多种多样的重排以及人V,D和J区段的高表达[162]。 为了克服这些主要挑战,已经成功地采用了不同的策略来产生表达人类抗体库的动物(表4)[35,36,165]。

3.3.1 完全人类抗体小鼠
1985年Alt等人首次提出在转基因小鼠中产生人抗体的想法。 [166]提出将人类抗体基因引入小鼠种系。这个想法是空前的,为人类抗体生产的发展提供了新的方向。 1989年,Brüggemann等人。 [167]克隆了第一个人类重链构建体,其中包含两个人类VH基因,用于连接人类重链连接簇(JH)和μ恒定区的多样性区段(D)。将25kb的构建体作为mililocus质粒微注射到受精的鼠卵中,使其随机插入鼠基因组中。在这些转基因小鼠中,约4%的B淋巴细胞以可检测的水平表达人μ链。另外,也可以使用该转基因菌株建立人IgM抗体的杂交瘤。 1992年,Taylor等人。克隆了人κ轻链[168]构建体,其中包含一个人κ轻链可变(Vκ)基因,人κ轻链连接簇(Jκ)和κ恒定区(Cκ)。小鼠表达人重链(VH-D-JH-Cμ-Cγ1)和人κ轻链时,人抗体的量不到总抗体的10%,因此人抗体的表达与小鼠内源性Ig的表达[168]。
在相似的时间,产生了多种鼠Ig敲除小鼠品系。 1993年,Chen等。通过基因靶向删除敲除鼠类JH和Jκ基因,使小鼠Ig失活[169,170]。然后,将人IgH和IgL转基因小鼠与鼠IgH和IgL敲除小鼠杂交,以尝试产生可以产生更多种人抗体的品系。 1994年,Longberg等人产生了第一个人类Ig转基因小鼠品系HuMabMouse [35]。在这一方面,人IgH和IgK在鼠IgH和IgK缺陷型小鼠中表达。整个人IgH基因组约为1.29 Mb,IgK约为1.39 Mb,但引入小鼠的人Ig基因组小于80 kb [35]。由于抗体多样性来自种系V(D)J基因,因此引入更多的人类可变基因将导致所生成抗体的更多多样性是合理的。
同样,Davies等。 [171]和Choi等。 [172]使用酵母人工染色体(YAC)载体在1993年通过酵母同源重组分别构建了人IgΚ(〜300 kb)和IgH(〜85 kb)基因。 1994年,Green等人。 [37]构建了人类IgΚ(〜170 kb)和IgH(〜220 kb)基因组YAC,并通过酵母原生质球-ES细胞融合成功地将它们引入小鼠胚胎干细胞。此外,在1997年,Mendez等人。 [36]将较大的人IgK(〜700 Kb)或IgH(〜1 Mb)YAC引入小鼠ES细胞,将人Ig小鼠与鼠IgH和IgL敲除小鼠杂交,产生XenoMouse [131]。正如预期的那样,XenoMouse仅表达人类抗体,而不表达小鼠抗体[173]。尽管该品系的开发消除了小鼠内源性Ig的干扰并扩展了人类Ig基因,但由于缺乏小鼠恒定区基因表达,人类抗体生成,Ig类转换和体细胞超突变的效率仍然很低[ 158]。
3.3.2 嵌合人类抗体小鼠
为了克服完全人重链抗体的缺点,必须保留原始的鼠恒定区。如果可以在小鼠中产生具有人Fab和鼠Fc的嵌合抗体,则鼠Fc将在抗体亲和力成熟[158、174、175]和抗体的效应子功能[174、176]时调节体细胞超突变的信号传导。按照这些思路,Osborn等人。 [163]在2013年将人类VH,D和JH基因与大鼠恒定区基因座相关联。通过细菌人工染色体(BAC)和YAC技术将人类IgH和IgL的大片段亚克隆并连接,然后显微注射将微型基因座质粒导入受精的大鼠卵母细胞中。同时,用锌指核酸酶沉默内源性大鼠Ig基因座。所得的大鼠品系(OmniRat)嵌合人表现出类似于野生型大鼠的抗体产生,抗原亲和力和体细胞突变。在2014年,Lee等人。 [164]利用在小鼠ES细胞中具有Cre / loxP重组的BAC产生了小鼠品系,其人VH-D-JH和Vκ-Jκ直接插入鼠Cμ和Cκ区(KyMouse)上游。抗原免疫后,KyMouse可以处理体细胞超突变并产生高亲和力的嵌合人抗体。在另一项努力中,墨菲等人。 [165]使用BAC组装大的人Ig基因,然后将构建体系列微注射到小鼠ES细胞中。人IgH和IgL基因靶向并取代了恒定区上游的鼠类IgH和IgL(VelocImmune小鼠)。
3.3.3 从人抗体小鼠开发成功的抗体药物
转基因动物产生人抗体的过程已经由7家公司完成:Abgenix,XenoMouse(2005年由Amgen收购); Medarex,HuMAbMouse(2009年由Bristol Myers Squibb收购); 配体,OmniRat; Kymab,KyMouse; Regeneron VelocImmune小鼠; 以及最新的Harbor抗体,H2L2小鼠和Trianni Inc.,Trianni小鼠[162,165](表4)。 第一种衍生自转基因小鼠的抗体药物于2006年被美国FDA批准[177],截至2019年,已有19种转基因动物衍生的抗体药物 Xenomouse,HuMabMouse和VelocImmune小鼠产生的(表5)。 其中八种药物用于癌症治疗,而其他药物用于自身免疫或炎性疾病。
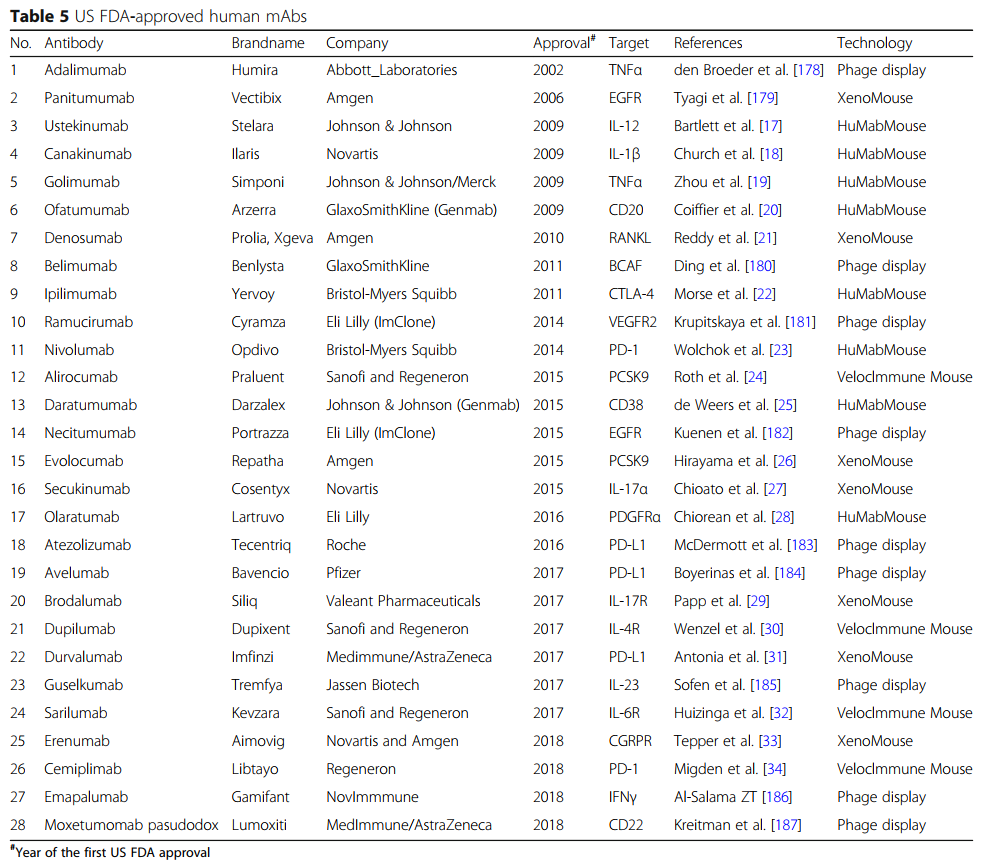
XenoMouse产生了七种美国FDA批准的抗体药物(表5)。 2006年,第一个帕尼单抗(帕尼单抗(Vectibix,Amgen,人IgG2 / kappa))被批准用于用野生型KRAS治疗表达EGFR的转移性结直肠癌[188]。该mAb阻断EGFR及其配体的相互作用,从而导致EGFR信号转导的抑制和癌细胞凋亡的诱导。 XenoMouse的两种抗体药物可用于自身免疫性皮肤病。一种是苏金单抗(Cosentyx,诺华,人IgG1),与促炎细胞因子IL-17α结合以减轻牛皮癣的炎症[189]。另一个是布罗达单抗(Siliq,Valeant Pharmaceuticals,人IgG2),其与IL-17受体结合以抑制IL-17家族细胞因子的作用。两种mAb药物分别于2015年和2017年获得美国FDA批准用于银屑病治疗。
从HuMabMouse中,也有八种被美国FDA批准的抗体药物(表5)。 ipilimumab(Yervoy,Bristol-Myers Squibb,人IgG1)和nivolumab(Opdivo,Bristol-Myers Squibb,人IgG4 / kappa)这两种药物用于黑色素瘤治疗;这些药物分别于2011年和2014年获得批准。伊匹木单抗与免疫检查点抑制剂CTLA-4结合,阻断其与APC上B7的相互作用,并引起细胞毒性T淋巴细胞杀死癌细胞[190]。 Nivolumab识别PD-1,减少抑制性信号传导,以恢复患者肿瘤特异性T细胞的免疫反应[191]。值得注意的是,nivolumab在2018年也被批准用于非小细胞肺癌治疗。在源自HuMabMouse的mAb药物中,有一些用于自身免疫性疾病。例如,ustekinumab(Stelara,Johnson&Johnson,人IgG1 / kappa)结合细胞因子,尤其是IL-12和IL-23的p40亚基,阻断促炎信号传导以减轻炎症。该药物于2009年被批准用于严重斑块状牛皮癣[17],并于2016年被批准用于克罗恩病[192]。
VelocImmune小鼠是第二代转基因嵌合小鼠,已经产生了四种批准的药物(表5)。作为湿疹治疗,Dupilumab(Dupixent,Sanofi and Regeneron,人IgG4)结合IL-4受体并抑制IL-4和IL-13途径。 Sarilumab(Kevzara,Sanofi和Regeneron,人IgG1)通过与IL-6受体(IL-6R)结合来抑制IL-6信号传导,否则该受体会上调类风湿关节炎相关因子从肝细胞的释放。这两种药物均于2017年获得批准。值得注意的是,尽管可以使用XenoMouse并拥有Cambridge Antibody Technology(Humira背后的噬菌体展示公司),但阿斯利康却以1.2亿美元的价格购买了几对繁殖的VelocImmune小鼠[193]。
为了改善产品的多样性并生产更好的抗体药物,自1989年生产第一只转基因小鼠以来的30多年间,主要的开发工作已经产生了模型,例如完全人抗体小鼠和第二代嵌合人抗体小鼠[167]。 ]。转基因动物的不断改良和进步为全球制药工厂开发抗体药物提供了更多可能性。
3.4 单B细胞抗体技术
在人类免疫系统中,抗体反应是强大的,高度特异性的,中和的和自我耐受的。使用传统的杂交瘤技术或转基因小鼠生产治疗性人类抗体需要长期的免疫程序和筛选,而临床使用鼠抗体可能会引发严重的免疫原性反应(例如HAMA)[194]。为了避免这些障碍,开发了一种用爱泼斯坦-巴尔病毒永生人类B细胞的技术[195,196,197]。该方法在某些情况下是有用的,但是它具有缺点,例如某些患者效率低下以及难以维持某些转化克隆的稳定性。虽然已经产生了携带人Ig基因的小鼠[35,36,163,164,165],但这些小鼠的免疫反应性通常无法像天然人抗体反应那样强大地触发。因此,在传染病等紧急情况下,单B细胞抗体技术的主要优势是仅需要少量细胞,从而可以高效,快速地分离潜在的mAb。此外,单B细胞克隆保留了生物学介导的重链和轻链配对,而不是噬菌体展示抗体库中mAb的随机配对。从scFv转移至完整IgG格式时,这些随机配对的mAb有时会失去结合亲和力或发展自身反应性。
3.4.1 鉴定和分离单个B细胞
可以使用显微操作[198,199],激光捕获显微切割[200]和荧光激活的细胞分选[199,201,202]从PBMC或淋巴组织中分离单个B细胞。通常,通过Ficoll-Paque密度梯度离心从PBMC或骨髓中纯化单核细胞。基于不同阶段特定细胞表面标志物的B细胞表达,通过荧光激活细胞分选分离单个B细胞已得到广泛利用,尤其是在稀有和离散B细胞亚群的鉴定中。抗原包被的磁珠[203]和荧光缀合的抗原[204,205,206]通常也用于选择抗原诱集过程中的抗原特异性B细胞。使用抗原包被的磁珠从分离的B细胞中产生针对Puumala病毒的中和性人单克隆抗体[207]。最近,已使用抗原结合的荧光珠来鉴定抗原特异性B细胞[208]。轮状病毒的荧光病毒样颗粒充当单个RV特异性B细胞的抗原诱饵,该B细胞是从感染了健康的轮状病毒的婴儿或成年供体中提取的[209]。 HIV包膜蛋白抗原也已用于分离广泛中和HIV-1的抗体[210,211]。此外,据报道有登革热病毒特异性记忆B细胞的分离[212,213]。因此,抗原诱集可以用作在多克隆混合物上使用的初步选择工具。
3.4.2 克隆单个B细胞并筛选抗体
在单B细胞分选后,应直接克隆每个Ig重链和相应的轻链[201,202]。此步骤涉及使用巢式或半巢式逆转录聚合酶链反应(RT-PCR)扩增每个鉴定出的B细胞的可变重链和轻链。通常,正向引物针对IgH和IgL可变前导序列,反向引物与Ig恒定区互补[201,214]。通过优化不同的引物组混合物,可以提高VH和VL的回收率[201,215]。然后将这些基因克隆并在哺乳动物细胞系中表达,以立即产生重组mAb。在检测mAb反应性之后,确定每个产生的mAb的特性。此外,为了高通量筛选和评估具有理想反应性的分泌mAb,已经描述了基于细胞的微阵列芯片系统[216]和微雕刻技术[217,218,219,220]。基于细胞的微阵列芯片系统,即芯片上的免疫斑点阵列测定法,能够通过涂有抗Ig抗体的芯片捕获分泌的抗体,因此,它可用于识别和回收特异性抗体分泌细胞[216]。微雕刻 ( microengraving )方法取决于使用软光刻技术来生成包含单细胞分泌抗体的微阵列[217]。这两种方法提供了对早期和快速鉴定对目的抗原具有高亲和力和特异性的克隆的优势。
3.4.3 单个B细胞产生人抗体
面对新出现的病原体的威胁,免疫疗法的快速发展或对抗体库多样性的见识都是有益的,单B细胞分选提供了实现这些目标的高效技术。过去,针对细菌,寄生虫,病毒感染或自身免疫性疾病的单B细胞方法已产生人mAb。
在细菌中,炭疽芽孢杆菌是最相关的物种之一。炭疽芽孢杆菌是一种致命的病原体,可导致人类严重的炭疽病,并已被用作生物武器。尽管抗生素可用于炭疽的治疗和作为暴露后的预防,但是来自单个人B细胞的抗炭疽保护性抗体仍将是治疗工具包的重要组成部分[221,222]。在针对酵母菌感染的一个例子中,通过单一人B细胞方法衍生的抗Candida mAbs抗体可以增强吞噬作用,从而防止传播念珠菌病[223]。
单B细胞方法还成功产生了抗病毒mAb。从人抗原特异性记忆B细胞培养物中快速分离出登革热中和抗体[224]以及DENV免疫个体外周血中抗原特异性B细胞的表征[213]。在另一个例子中,Iizuka及其同事描述了使用单个基于B细胞的抗体基因克隆来鉴定巨细胞病毒pp65抗原特异性人mAb [225]。对于轮状病毒,采用单B细胞方法分析幼稚和记忆B细胞亚群中VP6特异性B细胞的轮状病毒抗体基因谱[226],并通过从小肠粘膜分选单个B细胞来生成轮状病毒特异性人mAb。 [227]。抗寨卡病毒NS1的人单克隆抗体也已通过单B细胞方法产生[228]。除了用于细菌和病毒感染的单克隆抗体,单人B细胞方法还产生了针对癌症的补体因子H(CFH)治疗性抗体。重组抗CFH抗体可通过补体激活和释放过敏毒素来诱导补体介导的细胞毒性(CDC)[229]。
3.4.4 在临床试验中开发单个B细胞衍生的抗体
许多靶向病毒的单抗目前也正在临床试验中。例如,埃博拉病毒是一种高度致死性的病原体,可导致25-90%的人类死亡。埃博拉病毒感染的治疗性单克隆抗体源自已接种疫苗的人类供体或幸存者的B细胞[230,231,232]。令人印象深刻的是,人mAb114源自于针对扎伊尔埃博拉病毒糖蛋白的分类记忆B细胞,在攻击后的5天之内给药时可以保护猕猴[231]。该药物的临床试验处于I期(NCT03478891),II期和III期(NCT03719586)。
获得性免疫缺陷综合症是由艾滋病毒引起的,全世界估计有3690万人受到感染。 HIV-1包膜蛋白是抗体和疫苗设计的有吸引力的治疗靶标。通过单B细胞方法已经产生了五种抗HIV包膜蛋白的人单克隆抗体,并且正在临床试验中进行评估(3BNC117,I / II期; 10–1074,I期; VRC01,I / II期; PGT121,相I / II和N6,第一阶段)[233]。目前还正在进行一项第一期临床试验(NCT02579083),以通过MB 66结合抗单纯疱疹病毒抗体(AC8)和抗HIV抗体(VRC01)预防HIV-1和单纯疱疹病毒的性传播。 。
每年,不同的流感病毒都会引起流行病,而流感疫苗是预防季节性流感的最有用措施。用于产生有效的和广泛中和的抗流感抗体的单B细胞分离已成为一项流行的工作[234,235]。 MHAA4549A是一种针对甲型流感病毒血凝素茎的人单克隆抗体,是从接种了流感病毒的供体的单个人成浆细胞中克隆的[236]。最近完成了一项MHAA4549A的II期临床试验,该疗法用于在其他方面健康的成年人中治疗急性单纯性季节性A型流感(NCT02623322)。由Celltrion创建的CT P27包含两个人类mAb(CT P22和CT P23),处于II期(NCT03511066)。 RG 6024,也称为MHAB5553A,是由Genentech使用单B细胞分离方法的改良版[237]生成的;目前正在第一阶段(NCT02528903)试验中进行审查。另一种抗体TCN 032的II期试验于2012年停止(NCT01719874)。
从自然感染的成年人的记忆B细胞中提取呼吸道合胞病毒(RSV)抗体库[238],或从受RSV感染的婴儿中产生中和抗体[239]。 MEDI8897是MedImmune开发的抗RSV抗体,目前正在II期临床试验(NCT02878330)中进行安全性和有效性评估。
在过去的十年中,通过单B细胞技术生成mAb变得越来越有吸引力。但是,仍然没有通过这种方法开发的美国FDA批准的治疗性单克隆抗体可用于任何疾病的临床治疗。尽管单B细胞技术具有许多不可替代的优势,但仍然有许多挑战需要克服。例如,抗原标记技术,分选抗原的结构(例如,单体或二聚体)和引物组的设计都是成功产生mAb的重要考虑因素。将来,从单B细胞平台回收mAb可能是与下一代测序相结合的强大工具,可用于开发新型诊断方法,药代动力学应用和临床治疗方法。
3.5 抗体的亲和力成熟
从人源化,噬菌体或转基因方法中鉴定出的抗体通常会进一步工程化,包括在结合区中用结合liabilities 置换残基。此外,抗体结构中的点突变有时会导致产品的抗原相互作用比原始抗体弱(低亲和力),但某些突变会导致较强的相互作用(高亲和力)。增强对抗原的亲和力的过程称为亲和力成熟。 V(D)J重组后,在辅助T细胞的帮助下,成熟B细胞发生亲和力成熟。
亲和力成熟是体液免疫反应的重要特征,可导致抗体的皮摩尔亲和力低[240,241]。高亲和力是抗体中和细胞因子或生长因子诱导的信号传导的关键属性。通常,对于要考虑用于治疗药物开发的mAb,它对靶抗原的亲和力应为1 nM或更小[242]。此外,小鼠mAb的人源化经常会降低亲和力[243]。因此,使用亲和力成熟通常是抗体药物开发中必不可少的步骤[244]。
3.5.1 亲和力成熟的方法
噬菌体展示和酵母展示已被广泛用于抗体的亲和力成熟,因为它们易于筛选高亲和力变体和高通量应用[81]。增加抗体亲和力的方法可以大致分为两大类。首先是生成CDR或整个可变域序列的大型随机突变文库,然后从大量突变体中选择更高亲和力的变异体。另一种方法是通过模仿体内亲和力成熟的集中诱变或热点诱变来制备小文库。在这种集中方法中,选择一种高亲和力变异体,以使其随机分布在六个CDR中的每个CDR的各个位置或可变域中称为热点的离散点处。通常的做法是结合不同的突变,从而导致亲和力的小幅增加。这些不同突变的组合可能具有累加或协同作用,可能导致抗体与抗原的亲和力显着提高[245]。噬菌体展示技术可用于在严格的生物淘选条件下鉴定抗体基因突变文库中的高亲和力抗体,包括降低抗原量,延长孵育时间和强化洗涤步骤或通过与可溶性抗原竞争[104,246]。使用具有VH和VL CDR3突变文库的噬菌体展示,抗HER2抗体的亲和力提高了1200倍以上[97]。
抗体基因的多样化是体外亲和力成熟的第一步,可以使用各种策略来实现这一步骤,例如随机突变,靶向突变或链改组[246]。突变可通过易错PCR在突变大肠杆菌菌株中随机引入抗体基因的可变区[247,248]。链改组方法是将两条链中的一条(VH和VL)固定并与伙伴链库重组以生成下一代文库的方法[249]。此外,可以将突变引入抗体基因的特定区域。这种类型的靶向突变方法被用于使CDR残基多样化,并被证明可有效改善抗体的亲和力[250]。因此,此方法与B细胞进化过程中的体内体细胞突变更相关,因为突变比框架残基更有效地在CDR中积累。
四、未来展望
近年来,治疗性抗体领域经历了快速的增长,成为治疗剂市场中的主导力量。然而,治疗性抗体领域仍然具有显着的增长潜力。传统上,抗体已用于治疗癌症,自身免疫性疾病和感染性疾病。如果可以清楚地阐明特定疾病的分子机制,并且可以鉴定出发病机制中涉及的特定蛋白质或分子,抗体可能会提供有效的治疗选择。例如,已经开发了用于预防偏头痛的抗CGRP受体抗体(erenumab,galcanezumab或fremanezumab)。抗原蛋白转化酶枯草杆菌蛋白酶/ kexin 9型(PCSK9)抗体(evolocumab或alirocumab)用于治疗高胆固醇血症。抗成纤维细胞生长因子23(FGF23)抗体(burosumab)用于治疗X连锁性低磷血症。抗IL6R抗体(sarilumab和tocilizumab)可用于治疗类风湿关节炎。抗因子IXa / Xa抗体(emicizumab)是治疗A型血友病的重要方法。抗冯Willebrand因子抗体(caplacizumab)被批准用于治疗血栓性血小板减少性紫癜,其他抗体也将在不久的将来被批准用于新的适应症。
治疗性抗体可大致分为两大类(图5)。在第一类中,裸抗体直接用于疾病治疗。该类别的癌症治疗可以通过几种不同的机制起作用,包括介导的途径(例如,ADCC / CDC),直接靶向癌细胞以诱导凋亡,靶向肿瘤微环境或靶向免疫检查点。在介导的途径中,抗体通过募集天然杀伤细胞或其他免疫细胞来杀死癌细胞。最近,已经进行了新的技术开发来增强ADCC或CDC的治疗效果,例如抗体Fc点突变[251,252,253]或糖基化修饰[254,255,256,257,258]以提高癌细胞的杀伤能力。传统上,癌细胞中的直接诱导凋亡是治疗性抗体的优选机制。关于靶向肿瘤微环境,抗体可以通过靶向与癌细胞生长有关的因子来抑制肿瘤发生。例如,Avastin靶向血管内皮生长因子(VEGF)来抑制肿瘤周围的血管生长,从而切断癌细胞生长所需的营养供应。免疫检查站已被证明是治疗癌症的重要目标。将来,评估抗体与化学治疗药物,放射疗法或其他生物制剂的协同作用的研究将大大有益于抗体治疗剂的进一步发展。此外,新型生物标志物的鉴定可以改善针对人类疾病的基于抗体的疗法的功效和特异性。
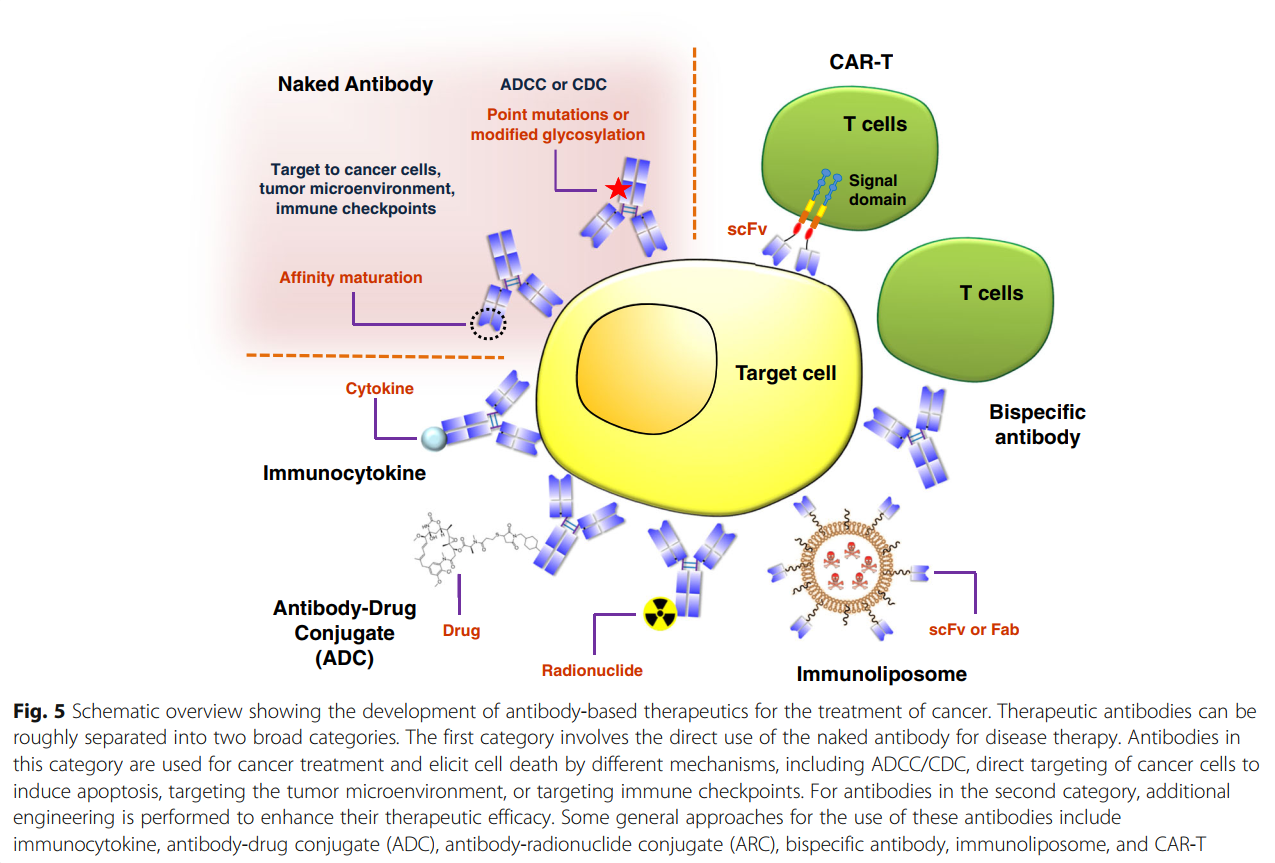
在第二类抗体药物中,对抗体进行了其他修饰,以增强其治疗价值。一些通用方法包括免疫细胞因子,抗体-药物偶联物,抗体-放射性核素偶联物,双特异性抗体,免疫脂质体和嵌合抗原受体T细胞(CAR-T)治疗。为了产生免疫细胞因子,将选定的细胞因子与抗体融合以增强递送特异性[259]。抗体药物偶联物由靶向与小分子药物偶联的癌症特异性标志物的抗体组成。该抗体增强了向肿瘤部位的递送,通过减少对非靶组织的非特异性毒性,提高了小分子的功效,同时减少了副作用[260]。抗体也可以与放射性核素缀合,以便更具体地将放射疗法引导至肿瘤部位[261]。对于双特异性抗体,设计了靶向两种受体的抗体以进一步增强治疗效果[262]。抗体结合的效应细胞功能可以增强双特异性抗体的治疗功效。关于免疫脂质体,将抗体(scFv或Fab)的结合位点从恒定区上切割下来,然后与不同的纳米药物递送系统(如脂质体药物)偶联,以提供更特异性的靶向作用[263,264]。最后,CAR-T涉及将靶向特定癌症标志物的嵌合T细胞受体-抗体基因插入T细胞,从而使工程细胞靶向并杀死癌细胞[265,266]。近年来,这种方法因其对癌症患者的显着临床益处而引起了科学和医学界的广泛关注。在许多情况下,患者已经完全缓解甚至治愈了癌症[267,268,269,270,271]。
尽管已经建立了建立完整人类抗体的新方法,例如人类抗体转基因小鼠和人类单B细胞抗体技术,但基于其高效和经济的体外选择方法,噬菌体展示作为抗体药物发现平台仍具有优势。最近,一些先进技术已应用于抗体发现中,包括高通量机器人筛选[272],下一代测序[273]和单细胞测序[274,275]。预计这些技术将极大地加速特定噬菌体结合剂的鉴定,从而促进单克隆抗体的开发,以用于研究,临床诊断和用于治疗人类疾病的药物。
通过审查目前批准的单克隆抗体,人们可以轻松地看到如何开发出复杂的形式,以应对治疗适应症带来的挑战。这些mAb工程解决方案的重点是抗体-药物偶联物,糖工程化mAb,免疫调节剂,双特异性mAb和CAR-T细胞。
四、结论
在这里,我们总结了与治疗性抗体的产生有关的五个技术平台,包括嵌合抗体,人源化,噬菌体展示,转基因小鼠和单B细胞抗体技术(图3d)。噬菌体展示,转基因小鼠和单B细胞抗体技术已被证明是生成人抗体的可靠方法。由于大量未知特性的抗体编码基因(> 10^10)的抗体库,高质量(抗体多样性)噬菌体抗体库对于成功鉴定治疗性单克隆抗体至关重要。另外,从噬菌体展示文库中的最佳选择取决于靶抗原的质量,抗原的固定以及对结合和洗涤条件的严格控制。此外,仔细的条件预筛选设计可以调整从生物淘选中发现的抗体的特征,包括构象特异性,表位特异性,内在化,中和性和种间交叉反应性。当前,从批准用于治疗的噬菌体文库中发现了九种完全人类抗体,还有数十种噬菌体衍生的抗体治疗剂正在临床试验中,等待进入市场[149](表5)。
为了提高抗体药物的质量,研究人员开发了几种转基因动物,包括完全人类小鼠和第二代人类嵌合小鼠。转基因动物的不断改良和进步为全球制药工厂的抗体药物开发提供了更多选择。所有批准用于治疗的转基因单克隆抗体均来自三个公司:Abgenix(XenoMouse)[36],Medarex(HuMAbMouse)[35]和Regeneron(VelocImmune)[165]。取决于免疫方案,可以通过选择动物中产生的克隆来获得高亲和力的人抗体。该选择主要通过杂交瘤技术完成。目前,从这三只转基因动物中发现了19种已批准的人mAb(表5)。
在过去的十年中,从孤立的单个B细胞生成mAb成为越来越有吸引力的方法。迄今为止,尚无美国FDA批准的治疗性单克隆抗体可从该方法中获得。但是,它具有几个主要优点,目前正在解决不断挑战。该方法的成功在很大程度上取决于抗原标记技术,分选抗原(例如单体或二聚体)的构型以及用于扩增的引物组。未来,从单个B细胞中回收单克隆抗体有望与诊断,药代动力学应用和临床治疗的下一代测序相结合,成为一种强大的工具。
由于近几十年来抗体药物的高度活跃发展,单克隆抗体已出现在用于治疗许多人类疾病(尤其是癌症,免疫性,传染性,神经性和代谢性疾病)的主要治疗剂中。直到1990年代末,第一批嵌合mAb获批(1997年的年销售额为3亿美元),mAb产品的销售增长和监管审批仍然缓慢。随着随后批准的人源化和完全人源化单克隆抗体的批准,单克隆抗体产品的产品批准率和销售量迅速增加,2018年所有单克隆抗体产品的全球销售收入为1152亿美元(图1)[276]。在未来几年中,mAb产品的持续增长预计将成为整个生物制药产品销售的主要推动力。
参考资料
- Journal of Biomedical Science volume 27, Article number: 1 (2020) 。 Development of therapeutic antibodies for the treatment of diseases。 https://jbiomedsci.biomedcentral.com/articles/10.1186/s12929-019-0592-z
