【2.7.5】抗原特异性纳米抗体的选择和鉴定的最新进展(library)
纳米抗体代表了下一代抗体衍生的生物制剂,与常规抗体相比具有重大进展。已经开发了几种用于分离高度特异性的纳米抗体的快速而可靠的技术。抗原特异性纳米抗体选自构建的纳米抗体文库,可分为3种主要类型:
- 免疫文库
- 纯天然文库
- 半合成/合成文库。
免疫文库是用于纳米抗体筛选的最广泛使用的策略。靶标特异性纳米抗体在免疫文库中比在非免疫文库中高度丰富;然而,它在很大程度上受到抗原的天然抗原性的限制。这样就开发出了naive的文库。尽管缺乏体细胞成熟(somatic maturation),蛋白质工程可以用来显着提高所选结合剂的亲和力。但是,从大量个体动物中采集的大量血液样本是确保天真文库多样性的先决条件。考虑到这个问题,半合成/合成文库可能是有希望的途径,可在不需要动物的情况下获得无数来源的针对各种抗原的纳米抗体。在这篇评论中,我们总结了具有不同库的最新筛选技术。本文介绍的方法可以进一步促进纳米抗体在生物医学和生物技术中的多样化应用。
一、前言
必须获得高亲和力和高特异性的抗体,才能满足研究,诊断和治疗的各种要求。几十年来,由于其独特的特性,包括纳米级尺寸,稳健的行为,高亲和力和特异性,深层的组织渗透(deep tissue penetration)以及可持续的来源(Wang等,2016)特性,单域抗体(通常称为纳米抗体)已成为制药和生物技术行业可靠的下一代抗体衍生生物制剂。
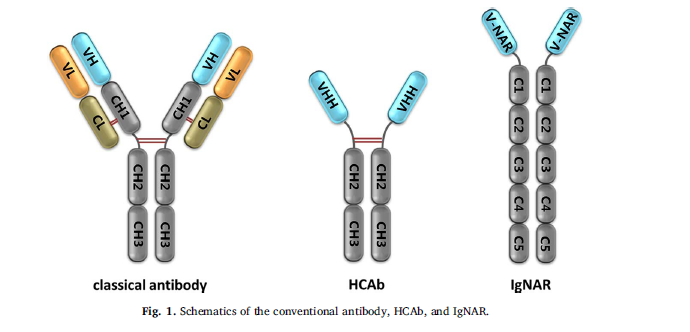
纳米抗体源自重链抗体(HCAb),这些抗体天然存在于所有骆驼科中。除了常规含有2条重链和2条轻链的抗体,所有骆驼科均在其血清中显着产生HCAb,缺乏轻链和重链中的经典恒定重链1(CH1)域(Hamers-Casterman等,1993)。一些软骨鱼类,包括护士鲨(Ginglymostoma cirratum),沃伯贡(wobbegong)(Orectolobus maculatus)和dogfish鲨(Squalus acanthias和Mustelus canis)也能显着产生功能性重链免疫球蛋白(Igs),称为IgNARs(Greenberg等人,1995; Liu等,2007a; Shao等,2007; Zielonka等,2015)(图1)。有趣的是,在人血清或小鼠杂交瘤中也发现了一些病理性和非功能性的HCAb,部分原因是可变重链(VH)和CH1区的重要部分被遗传删除(Alexander等,1982; Cogne等, 1989;莫里森(1978)。在骆驼中,这些HCAb具有由单个可变域(称为重链抗体(VHH)重链的可变域)组成的抗原识别部分。由于直径为2.5 nm的小直径和4 nm的高度,这些单一可变域因此被其最初的比利时开发商Ablynx®命名为纳米抗体,后者是从事VHH相关产品开发的领先生物制药公司。尽管来自IgNAR(VNAR)和VHH的可变域具有相似的特性,但术语Nanobody是仅用于骆驼科动物的重组VHH的商标。据报道,纳米抗体的分子量约为12-15 kDa,是在任何天然抗体中发现的最小的完整抗原结合单多肽链(Arbabi Ghahroudi等,1997; Harmsen和De Haard,2007; Muyldermans,2013)。
与传统的单克隆抗体不同,纳米抗体可以通过使用标准的微生物表达系统大量生产(Baghban等,2016; Ta等,2015; Thomassen等,2002; Zarschler等,2013)。
- 纳米抗体通常非常稳定(robust,),抗变性/热降解,易于在水溶性下操作,具有良好的隐性裂隙可及性,并且可以以nM或亚nM的亲和力结合抗原(Dumoulin等,2002; Lauwereys等,1998; Muyldermans等人,2009)。
- 纳米抗体还表现出优异的组织渗透性,身体分布和血液清除能力(Huang等,2008; Murugannadam等,2001; Vaneycken等,2011)。
- 值得注意的是,纳米抗体的保守框架区显示出与家族III的人VH结构域(VH3)的高度序列和结构同源性。因此,纳米抗体具有与人VH相当的免疫原性(Bartunek等,2013; Holz等,2013),引起了人们对其潜在临床和治疗应用的兴趣。
- 此外,抗原结合位点与C末端相对的位置使纳米抗体能够提供末端修饰的机会,使其成为研究和生物医学应用中的多功能工具(Campuzano等,2014; Ma等,2014)。
纳米抗体的这些优势为疾病诊断,药物输送和治疗,生物成像,基础生物医学研究以及农业和植物保护等领域的常规抗体提供了有希望的替代方法(Wang等,2016)。因此,用于分离高亲和力纳米抗体的广泛组成的快速而强大的技术是广泛使用这些分子的重要工具。已经构建了三种纳米抗体库,即:
- 免疫文库
- 纯天然文库
- 半合成/合成文库
用于选择具有高稳定性,特异性和亲和力的纳米抗体。 在这篇综述中,我们系统地总结了纳米抗体发现的最新技术,重点介绍了这三种不同纳米抗体库的筛选技术。
二、从免疫文库中筛选纳米抗体 Screen nanobodies from immune libraries
制备免疫文库首先需要对动物进行免疫,抗原特异性HCAb通过该动物进行亲和力成熟(De Genst等,2004)。通常可以通过从外周血淋巴细胞克隆V基因库并通过噬菌体展示或其他技术进行筛选来轻松获得纳米抗体。由〜50 mL血液样本构成的小型文库(〜10^6个单独的转化子)已经代表了免疫动物血液中淋巴细胞的免疫VHH组成。由于体细胞成熟,确保了从免疫文库中检索到的纳米抗体的独特特异性和高亲和力。通常,这些纳米抗体的亲和力据报道为低nM或pM水平(Muyldermans,2013)。但是,
- 当抗原具有高致病性(传染原)和毒性或代表非免疫原性小分子时,这是不可行的(Goldman等,2006)。
- 另外,维持骆驼科动物必须有患病和死亡的风险或个体间免疫力的自然差异的风险,这使该过程更加复杂。
2.1 噬菌体展示 Phage display
噬菌体展示于1985年由Smith(1985)首次描述。 该技术基于外源肽或蛋白质与外壳蛋白在噬菌体表面上的融合表达。 由于其简单性和有效性,噬菌体展示已被证明是研究不同蛋白质/肽分子之间特异性相互作用的强大而多功能的工具(Chen and Dreskin,2017)。 自1990年代以来,噬菌体展示是用于分离靶标特异性纳米抗体的最广泛,最标准的选择技术(Arbabi Ghahroudi等,1997; Li等,2017; Xu等,2018)。
抗原特异性HCAb通常在定期用0.1-1mg纯化抗原对单个骆驼科进行一系列皮下免疫后亲和力成熟(Arezumand等人,2016; Baharlou等人,2017; Wan等人,2018 Arbabi Ghahroudi等。 )。1997年通过噬菌体展示法分离出第一个纳米抗体序列(Arbabi Ghahroudi等,1997)。在这种方法中,根据标准免疫方案,用抗原对单峰骆驼进行免疫。然后从外周血淋巴细胞中分离出mRNA,并通过逆转录合成cDNA。 VHHs仅由〜360 bp的基因片段编码,可通过聚合酶链反应(PCR)轻松扩增,并连接到克隆载体中。随后将代表B细胞免疫VHH组成部分的连接DNA材料转化到大肠杆菌中,以构建骆驼VHH库。为了生成VHH的展示,在细胞生长至对数中期时,该文库被M13K07辅助噬菌体感染。通过聚乙二醇(PEG)沉淀制备噬菌体。以下抗原特异性纳米抗体筛选称为生物淘选。为了选择能特异性识别抗原的噬菌体展示纳米抗体,首先将抗原通过被动吸附固定在微量滴定板的孔中,或者在抗原被生物素化后固定在链霉亲和素包被的固体支持物上(Hoogenboom,2005年)。通常,进行2-3次淘选足以富集阳性克隆。可以在标准酶联免疫吸附测定(ELISA)中筛选单个克隆中抗原特异性纳米抗体的产生。对ELISA阳性克隆的核苷酸序列进行测序,以推断出纳米抗体的氨基酸(图2)。免疫文库中纳米抗体的抗原特异性和亲和力通常足以满足大多数生物医学应用,包括疾病诊断,生物成像,药物筛选和靶向治疗。然而,亲和力成熟已经成功地引入了纳米抗体的关键氨基酸中,以提高其同源抗原的稳定性和/或亲和力(Koide等,2007; Yau等,2005)。

抗原诱导的抗体体外产生被认为是产生抗体的一种有前途的替代方法(Comor等人,2017; Giacomini等人,1999; Hoogeboom等人,2015; Kato等人,2012)。 Comor等人的研究。描述了一种最少使用动物的强大纳米抗体发现技术(Comor等人,2017)。 立即从健康羊驼毛中采集的肝素化新鲜血液中分离出外周血单核细胞(PBMC)。与抗原在体外温育72小时后,收集PBMC以分离总RNA。如前所述,通过噬菌体展示选择纳米抗体。值得注意的是,在体外免疫过程中,Leu–Leu–OMe(LLME)和白介素需要2个关键成分。首先应从PBMC培养物中去除抑制抗原特异性B细胞活化的富含溶酶体的溶细胞性T细胞亚群。这些亚群对LLME敏感,因此在进行体外免疫之前被杀死(Borrebaeck等,1988)。同时,物种特异性白介素(主要是IL-2和IL-4)对于B细胞的活化和分化必不可少(Mosmann等,1987)。尽管与传统的抗体生产方法相比有很大的优势,但体外免疫可能存在一些不足,例如所获得抗体的亲和力较低(μM范围);另外,该方法倾向于产生IgM同种型而不是IgG。但是,加藤等人的研究指出培养条件,包括细胞密度,刺激物类型和初始细胞制备,是诱导小鼠脾细胞IgG反应的重要因素。通过仔细调节以下3个步骤,可以在短至6 d的时间内获得产生抗原特异性IgG的细胞:1)初始抗原刺激,2)用细胞因子混合物进行细胞扩增,以及3)第二次抗原刺激(Kato等)等人,2012年)。这可能是通过体外免疫发现纳米抗体的良好指导。亲和力相对较低的纳米抗体也已被证明可以用作通用的生物医学和生物技术工具。特别需要纳米级衍生的体内显像剂和用于亲和纯化的配体以表现出相对较低的亲和力,以快速进行体内清除和洗脱(Wang等人,2016)。因此,体外免疫被认为是一代纳米抗体的重要进步,具有广泛的潜在应用。
2.2 Cell surface display
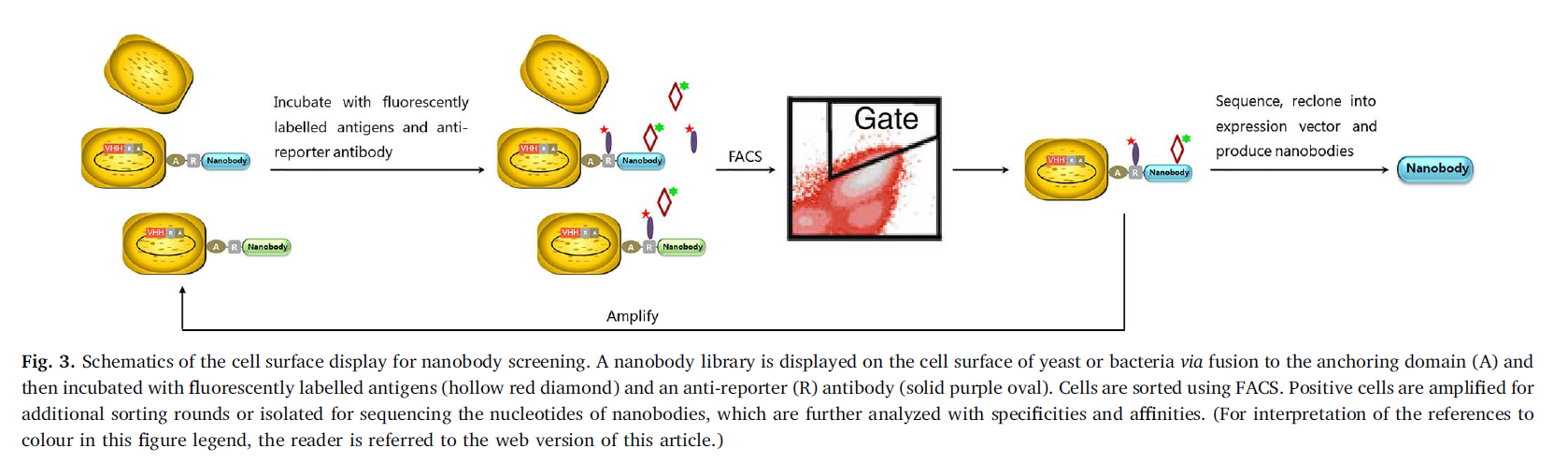
在细胞表面展示异源蛋白质是一种在微生物学和分子生物学中应用的强大方法(Ueda,2016)。该技术基于将蛋白质/肽定位在酵母或细菌细胞表面的机制(Fleetwood等人,2013; Ryckaertet等,2010)。已经开发并研究了使用不同宿主和锚定机制的细胞表面展示,以从免疫文库中分离出高亲和力纳米抗体。与噬菌体不同,细胞足够大,可以在流式细胞仪中检测到,从而可以对显示的文库进行基于荧光的分析和分类(图3)(Boderand Wittrup,1997; Daugherty等,1998)。该方法提供了量化每个细胞展示的蛋白质变体对靶标的相对亲和力的手段,这是通常以细胞分选为基础的最重要的参数。与其他现有选择技术相比,该方法还提供了出色的控制和直接的方法来监督选择配置文件。此外,通过使用荧光激活细胞分选(FACS),可以直接在细胞表面上确定抗体亲和力,从而避免了亚克隆,表达和纯化各种抗体候选物的麻烦,这既费时又费力(Chao等。 (2006)。
在Ryckaert等人的研究中,通过融合至alphaagglutinin的C端结构域,在巴斯德毕赤酵母表面上展示了用绿色荧光蛋白(GFP)免疫的美洲驼衍生的文库,该文库将纳米抗体锚定在细胞表面,并且用于功能展示纳米抗体。通过FACS富集后,分离出KD在nM范围内的GFP特异性纳米抗体(Ryckaertet等,2010)。小组还通过使用酵母表面展示的构象选择分离了靶向G蛋白偶联受体(GPCR)的纳米抗体。纳米抗体被用作重要的研究工具,以锁定处于特定构象状态的GPCR以获得晶体结构(Kruse等人,2013; Manglik等人,2017; Ring等人,2013)。酵母表面上抗体的展示和工程改造具有显着优势,包括与高级真核生物类似的分泌途径。蛋白质在内质网中折叠,其中伴侣蛋白,折叠酶以及一系列精心设计的质量控制机制确保仅正确折叠的蛋白质(Ryckaert et al。,2010),尤其是对于这些难以在原核细胞中表达的纳米抗体序列。
另外,革兰氏阳性细菌适用于重组展示和组合蛋白工程应用。 围绕细胞膜的肽聚糖厚层可在流式细胞仪的恶劣环境中保护细胞,从而在细胞分选后产生出色的细胞活力(Kronqvist等人,2010)。 Fleetwood等人使用革兰氏阳性菌肉食葡萄球菌和葡萄球菌A的细胞壁锚定域开发了一种细菌展示系统.FACS成功分离了许多GFP的亚nM亲和力结合剂,与之相比,亲和力平均高得多 噬菌体展示中平行衍生的纳米抗体(Fleetwood等,2013)。 铁汉 15:46:19
2.3 mRNA / cDNA展示 mRNA/cDNA display
基于细胞的展示方法部分受限于宿主生物的转染/转化效率,并且这些方法不适用于严格的选择条件。 相比之下,mRNA / cDNA展示采用共价键将编码的核酸片段与其编码的抗体相连,从而可以维持严格的,量身定制的抗原结合条件,这些条件特别适用于挑战性靶标,例如整合膜蛋白(Roberts和 Szostak,1997; Wang和Liu,2011)。 微型mRNA / cDNA显示方法高度集成,精简并适合高通量自动化。 该技术导致发现了针对全长人类整合膜蛋白靶标的高亲和力抗体,这对传统方法提出了严峻挑战(Hino等人,2013; Seddon等人,2004)。
通过使用DNA夹板辅助(splint-assisted)的RNA DNA连接,可以在mRNA的3’末端修饰一个寡核苷酸DNA尾部,该尾部包含一个polyA序列和一个模仿tRNA氨酰基部分的嘌呤霉素基。 然后,这种串联复合体在翻译过程中进入核糖体,并通过肽键接受不断增长的多肽链,从而导致编码/翻译的蛋白的C端共价结合至核酸的3’端,成为融合体(Roberts和 Szostak,1997年)。 通过oligo(dT)亲和层析纯化后,将融合蛋白逆转录,并暴露于预先固定在Ni- NTA亲和固相上的组氨酸标记靶抗原上。 洗涤以除去未结合的纳米抗体后,从固相洗脱融合目标复合物,并使用PCR再生全长纳米抗体编码基因。 TA克隆后分析序列(图4)。
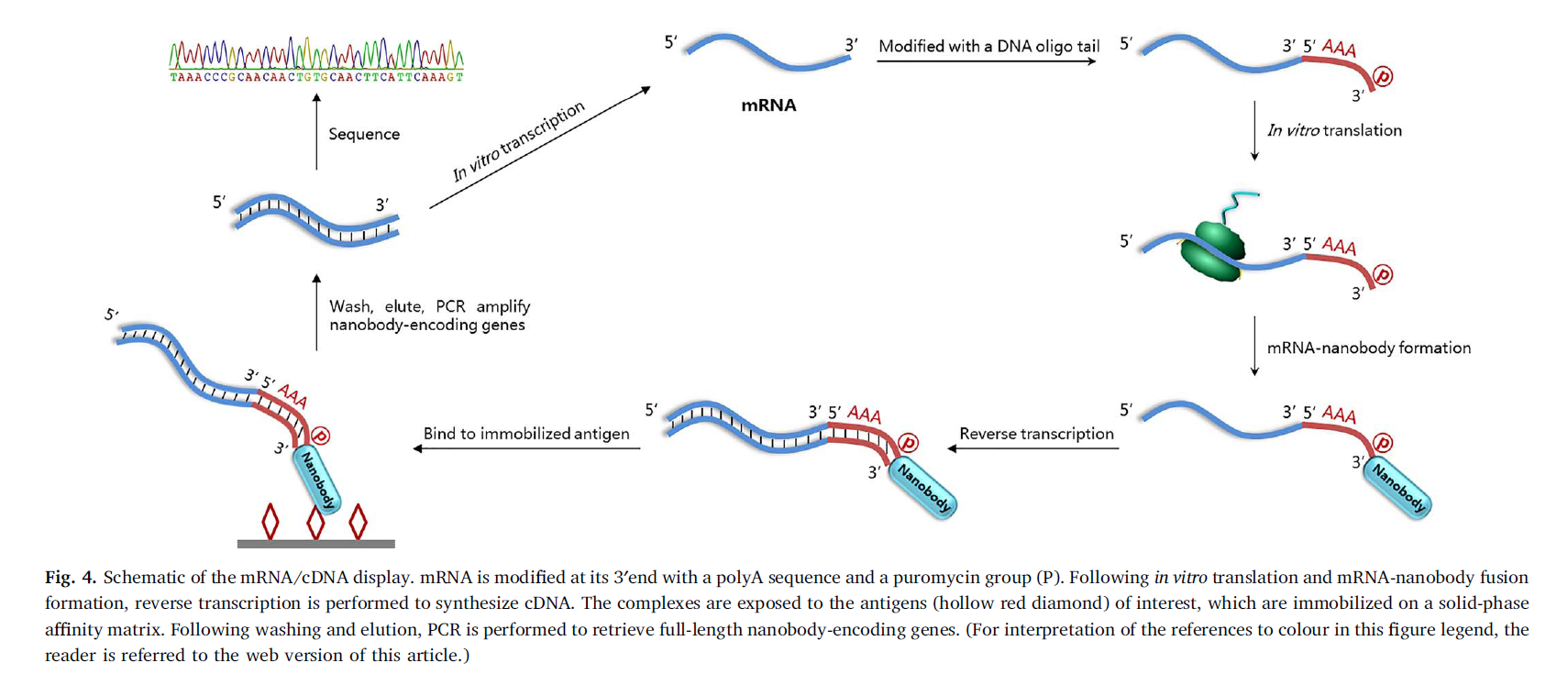
通过使用市售的纳米抗体文库,对上述方法进行了验证,以发现第一个报道的针对人类全长葡萄糖转运蛋白GLUT-1的纳米抗体。 在纳米抗体发现中,仅需10 ug纯化的靶抗原(1-3 g /轮展示),20 ug mRNA(5 g /轮展示)和市售可得的材料。 最终筛选的纳米抗体的平均KD为22.3±11.5 nM(Doshi等人,2014)
总之,可以进行mRNA / cDNA展示,以在2-3周内获得一种特定抗原的所需抗体。 此外,可以很容易地将其与几种抗原并行复用。 由于整个反应完全在体外进行,因此该方法具有完全自动化的潜力,并且机械操作过程精确的抽吸,离心,温育,分离和温度循环可以轻松实现自动化。
2.4 高通量DNA测序和质谱鉴定
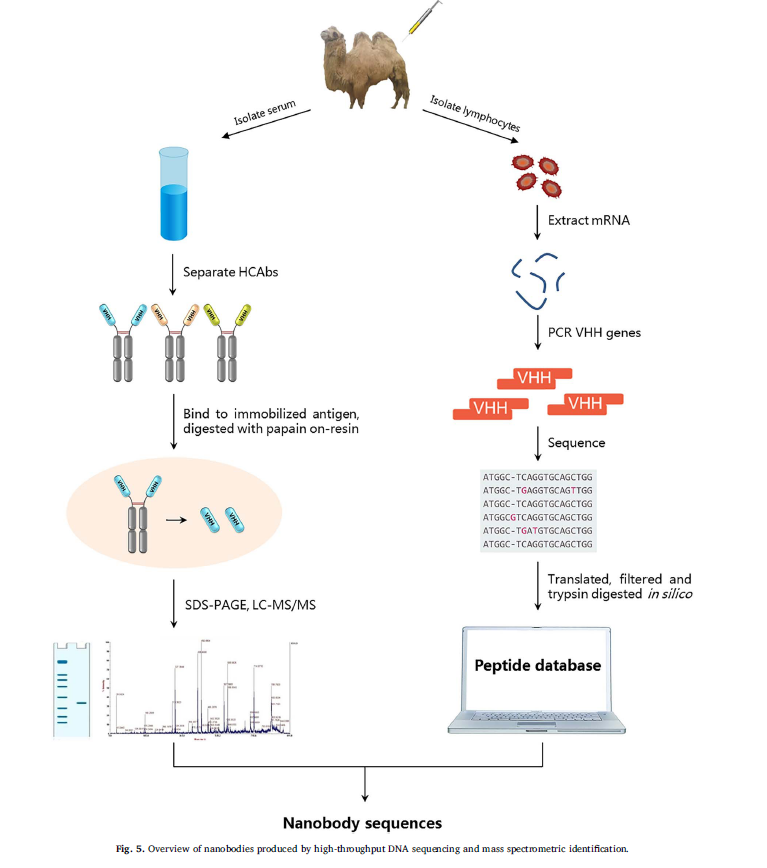
Fridy等人报告了一种高度优化的策略,该策略可以快速生成针对所选蛋白质的高亲和力纳米抗体的大量库(Fridy等人,2014)。该方法侧重于对来自免疫美洲驼的骨髓淋巴细胞VHH cDNA文库的高通量DNA测序,并结合质谱(S)鉴定源自同一动物血清的亲和纯化VHH区。在这种方法中,根据蛋白质A和蛋白质G对HCAb的亲和力与传统抗体的不同,在美洲驼免疫后将含VHH的HCAb在血清中进行连续分级(Hamers-Casterman等,1993)。为了进一步分离抗原结合的VHH片段,HCAb在抗原偶联的树脂上进行亲和纯化,并在树脂上用木瓜蛋白酶消化,以裂解掉恒定区。保留了所需的VHH区最小片段。在最高严格度洗涤后洗脱VHH片段以回收最高亲和力的VHH,然后通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSSPAGE)进行分离。用胰蛋白酶消化凝胶纯化的条带,并通过液相色谱-质谱(LCSS)和串联S分析。为创建动物特异性抗体序列数据库,从各个免疫的美洲驼获得淋巴细胞RNA,以产生cDNA。进行巢式PCR可以特异性扩增编码VHH区的序列,以进行高通量测序。翻译,过滤和胰蛋白酶消化该序列,以计算机方式创建用于S分析的可搜索肽数据库。在大肠杆菌中表达了针对抗原的纳米抗体的高概率命中。将大肠杆菌细胞裂解物通过抗原偶联树脂,以鉴定表达稳定且具有高特异性亲和力的纳米抗体。通过表面等离振子共振或其他技术进一步评估了纳米抗体的亲和力,其中KD值在单体纳米抗体的情况下处于亚微米范围内,而在超高亲和力二聚体形式下的KD值低至<30 pM(图5)。
在这种方法中,仅需要标准技术,包括IgG纯化,cDNA生成,PCR,高通量测序,MS,基因合成以及最终克隆和筛选。 从美洲驼收集样品后的4-6周内即可完成整个过程。 相比于噬菌体展示的最终淘选和选择步骤,该筛选步骤最初筛选多达10^7个克隆以鉴定甚至少量阳性克隆,因此单次筛选步骤的高成功率(57%S75%)是有利的( Arbabi Ghahroudi等,1997; Conrath等,2001)。
2.5 生物素化的纳米抗体筛选 Biotinylated nanobody screening
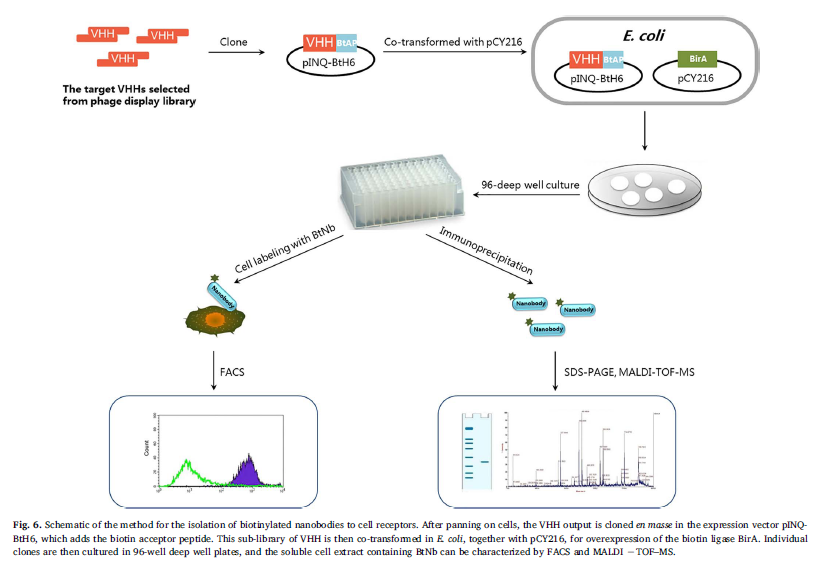
尽管针对所有类型的大分子抗原和半抗原已分离出各种各样的纳米抗体(uyldermans,2013; Tabares-da Rosa等,2011),但是当抗体靶标是复杂抗原的一部分时,挑战性更大。 ,例如细胞表面的受体。抗原识别对靶标本身的构象变化高度敏感。因此,如果重组蛋白无法复制其天然构象,则使用重组膜蛋白进行免疫和选择的常规方法通常会导致对天然细胞受体的交叉识别不足(Pardon等,2014)。 2015年,Rossotti等人为了解决这些局限性,有人提出了一种可用于高通量筛选的生物素化纳米抗体的生产方法(Rossotti等,2015)。用骨髓来源的树突状细胞(BDC)皮下免疫美洲驼,并如前所述构建噬菌体展示文库。为了淘选,首先将文库预先吸附在成纤维细胞上,以消除泛在的细胞受体结合剂。然后通过三轮淘选在BDC上选择未结合的级分。将来自第三输出的VHH整体克隆到带有生物素受体肽的pINQ-BtH6载体中,以构建子文库。然后将VHHs的这个子文库与pCY216一起在大肠杆菌中共转化,以过度表达生物素连接酶BirA,以直接生物素化细胞内的VHHs。然后采用流式细胞仪同时筛选大量生物素化的纳米抗体(BtNb)。筛选后,准备来自单个克隆的含有BtNb的可溶性细胞提取物以标记BDC。然后将阳性克隆的可溶性提取物直接上样到链霉亲和素琼脂糖中,然后将其用于免疫沉淀实验,以从BDC提取物中分离VHH目标受体。最后,通过SDSSPAGE和基质辅助激光解吸/电离飞行时间质谱(ALDISTOFSS)分析了免疫沉淀的蛋白质(图6)。 ac-1(CD11b / CD18),HC II和小鼠Ly-5白细胞共同抗原(CD45)受体的纳米抗体的选择和表征证明了该策略的潜力。该策略简化了纳米抗体的发现,而无需以高通量的方式纯化单个克隆到细胞膜受体,而细胞膜受体则是组成最大的药物和分析靶标的群体。
2.6 细菌二杂交系统 Bacterial-two-hybrid system
体外选择方法产生的抗原结合剂在细胞外环境中遇到的氧化条件下可正常运行。但是,这些结合剂在还原性环境中在细胞质中表达和使用时,常常无法维持其抗原结合能力(Ewert等,2004)。为了避免这个问题,已经引入了双混合系统。迄今为止,酵母双杂交系统是用于鉴定protein- protein相互作用的最广泛使用的选择技术。不幸的是,这种方法不足以用于相当大和多样的库(> 10^7个潜在的粘合剂),这对于有效选择合适的目标粘合剂通常是必需的。因此,需要通过缩小酵母库大小的步骤来进一步通过酵母双杂交系统进行选择(Visintin等,2004)。还提出了该方法的问题,即必须将富集文库重新克隆到酵母双杂交载体。过去,酵母双杂交系统仅限于酵母细胞的缓慢生长。幸运的是,可以通过在快速生长的细菌而不是酵母中容纳双杂交系统来弥补这些缺陷。
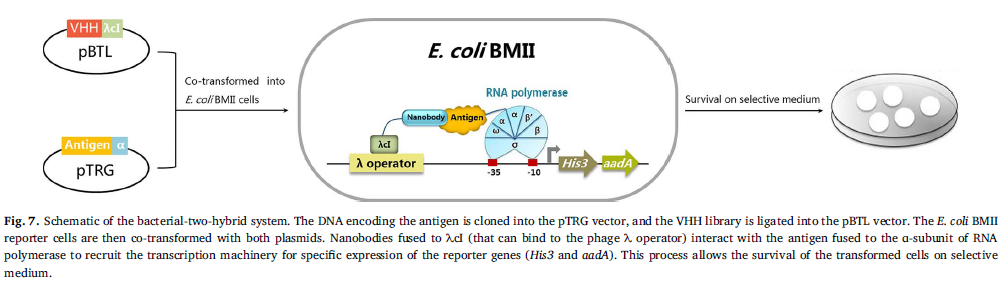
在2012年,Pellis等人验证了通过使用细菌两杂交法从免疫文库中一步分离细胞内功能骆驼科动物纳米抗体的方法。为了构建系统,将编码抗原的DNA克隆到pTRG载体中以编码抗原与RNA聚合酶Q亚基的融合蛋白,并将VHH文库连接到pBTL载体中以编码与-λcI融合的纳米抗体。 。大肠杆菌BII报告细胞,其中His3和aadA基因(可评估的基因型)在噬菌体的控制下-然后用两个质粒将其完全转化。与-λcI融合的纳米抗体(可与噬菌体λ操纵子结合)与RNA聚合酶Q亚基融合的抗原相互作用,以募集转录机制,从中特异性表达报告基因(His3和aadA)。 λ操作员,允许转化细胞在选择性培养基(即含有3-AT和链霉素的培养基)上存活(图7)(Pellis等,2012)。这种方法成功地分离了具有亚亲和力的针对HIV-1整合酶,GFP和锥虫锥虫核苷水解酶的纳米抗体。因此,这些纳米抗体的序列多样性,固有结构域稳定性,抗原特异性和亲和力与通过噬菌体展示淘选平行检索的那些相比具有优势(Pellis等,2012)。
三、从天然文库中筛选纳米抗体
通过动物免疫已成功产生了抗体。无论如何,该方法受到动物使用,血液稳定性,靶标的抗原性和毒性以及扩大规模的总体实际可行性的限制。相比之下,天然的文库可以识别任何潜在抗原的结合剂种类更广泛(onegal等,2009; Yan等,2015)。由于缺乏通过体内免疫刺激的体细胞成熟,只有从大多样性文库中选择(~10^9个单独的克隆)时才能实现高特异性和亲和力(uyldermans,2013)。此外,可以采用体外成熟技术,例如DNA改组,易错PCR和随机引物来增加互补决定区(CDR)的多样性以及纳米抗体的特异性和亲和力(Farasat等。 ,2017; Fromant等,1995; Hoseinpoor等,2014; Stemmer,1994)。据我们所知,噬菌体展示和核糖体展示是尝试从naive文库中筛选纳米抗体的仅有的两种主要策略。
3.1 噬菌体展示
为了构建原始的VHH文库,将从未免疫的美洲驼血液中收集的外周血淋巴细胞用于mRNA提取。原始文库的理论多样性随最初收集的淋巴细胞数量的增加而增加。因此,从不同的个体动物采集的大量血样(通常超过1 L)是保持最高遗传多样性的前提。另外,为避免在文库克隆过程中不必要的多样性减少,应谨慎执行所有必要步骤以减少材料损失。或者,也可以通过混合从不同个体动物收集的血液样本来增加最终文库的大小,以确保文库的多样性(Wang等人,2016)。第一个描述的美洲驼naive VHH噬菌体展示文库在2001年成功地为人脑微血管内皮细胞(HCEC)提供了有用的结合物,尽管它最初仅是由雄性美洲驼的肝素化血液中的10^7个淋巴细胞构建的(uruganandam等, 2001)。这些纳米抗体证明了在体外人血脑屏障(BBB)模型中迁移的有效能力,并发现了更多的应用来促进药物在BBB中的转运。在2006年,Verheesen等人从8个未经免疫的美洲驼采集的血液样本中分离出4种与肌肉疾病相关的蛋白的VHH:emerin,actin,tropomyosin-1和核poly(A)结合蛋白。据报道亲和力处于nM水平(Verheesen等,2006)。另一项研究表明,由从11种未免疫的美洲驼中分离出的109个淋巴细胞构建的美洲驼naive文库可用于以nM亲和力回收抗人成纤维细胞生长因子受体1的纳米抗体,仅在少数几周情况下具有广泛的应用(onegal等,2009)。
鲨鱼重链抗体IgNAR从脾细胞分泌。 由于频繁的体细胞突变,IgNAR可变域中的序列似乎高度多样化(Diaz等,1998; Greenberg等,1995)。 天然存在的V-NAR可以从免疫的鲨鱼或幼鲨(未免疫的)鲨鱼中获得(Dooley等,2003; Liu等,2007a; Nuttall等,2001)。 鉴于鲨鱼难以维护,仅由几个小组构建了原始鲨鱼文库,并已使用不同的毒素和蛋白酶淘选了具有治疗价值的V-NAR(Liu等人,2007a; Nuttall等人 (2002; Nuttall等,2001)。 尽管这些结合剂具有相对较低的亲和力,但是可以采用蛋白质工程来改善这种亲和力。
3.2 核糖体展示
与前面提到的mRNA / cDNA展示相似,核糖体展示基于通过核糖体与其编码蛋白相连的mRNA(Hanes等,2000; Hanes等,1998)。在选择步骤(生物淘选)中,在固定的配体(抗原)上亲和选择复合物中正确折叠的蛋白质。通过严格洗涤除去未结合的复合物,并释放与所选复合物连接的mRNA分子以逆转录为cDNA,可将其分离以克隆或突变以进行亲和力成熟(Jermutus等人,2001; Yan和Xu,2006)。文库的大小不受DNA转化为细胞的限制;因此,核糖体展示抗体库的大小上限(最多10^15个拷贝)比噬菌体库的上限高3个数量级(Yau等,2003)。使用噬菌体展示系统,结合剂对大抗原的亲和力通常在中等至高n之间,而小半抗原(W <500 Da)的亲和力则低10至100倍。有趣的是,通过使用核糖体展示,以uM亲和力分离了针对小半抗原的结合剂,这表明该技术在生产针对小分子(即M.W <500 Da)的抗体中可能特别有用(Yau等人(2003年)。因此,该技术应在不进行动物免疫的情况下更有效地获得所需抗体,以便能够检测农业和食品工业中的小半抗原,例如农药(Hall等,1993),环境污染物或有毒物质(cElhiney等,1993)。
2003年,Yau等人报道了通过核糖体展示分离出的第一个纳米抗体。 在这项研究中,从未免疫的美洲驼的10^7个淋巴细胞构建了VHH cDNA文库,然后对其进行了工程改造以允许在体外转录和翻译。 在转录物上没有终止密码子的情况下,产生了mRNA,核糖体和新生肽的三聚体复合物。 在用苦瓜素(一种内吸性除草剂)淘洗数个周期后,分离出KD在高uM范围内的纳米抗体(Yau等,2003)。 相比之下,针对吡咯烷酮的未免疫的美洲驼VHH噬菌体展示文库的淘选未能产生任何结合物(Tanha等,2002)。 无论如何,通过核糖体展示与易错诱变相结合,从鲨鱼文库中分离出pM范围KD的抗鸡蛋溶菌酶的高亲和力结合剂(Fennell等,2010)。
尽管体外核糖体展示有许多优点,但是mRNA-ribosome-antibody复合物的大规模生产非常昂贵,并且蛋白质产量相对较低。为了解决这个问题,Contreras-artinez和DeLisa开发了一种简化的体内生产核糖体复合物的方法,其成本大大低于体外生产核糖体复合物的成本(Contrera-artinez和DeLisa,2007)。然而,体内表达通常被认为是耗时的,并且靶蛋白的毒性可能提出重大挑战。考虑到每种表达系统的优缺点,Bencurova等人为了构建体内和体外合成mRNA-ribosomeSVHH复合物的通用盒(Bencurova et al。,2015)。通过双重叠延伸PCR,VHH与F1片段(包含T7启动子,物种无关的翻译序列和ATG起始密码子)和F2片段(包含mCherry,yc-tag,tether,Sec停滞序列和32茎环)生成全长DNA盒。包含mCherry是为了简化合成链的检测和新生链的正确折叠。并入yc-tag以捕获抗yc-affinity珠粒上的核糖体复合物,从而有效地纯化文库。系链序列充当将蛋白质束缚到核糖体并保持适当折叠的间隔子。 Sec序列终止了翻译,并在大肠杆菌中在体内形成了稳定的核糖体复合物,而3’环序列保护了mRNA免受核酸外切酶的影响。将合成的表达盒直接与无细胞的裂解物(大肠杆菌,塔什坦利什曼原虫或兔网织红细胞)一起孵育或连接到pQE-30载体中,然后转化到大肠杆菌中以在体内和体外产生核糖体复合物。来自3种不同的疏螺旋体和弗氏杆菌的全细胞抗原证实了VHH复合物的配体结合能力(Bencurova等人,2015)。这种快速而通用的技术可以有效地用于抗体核糖体展示和VHH生产。 铁汉 15:46:48
四、 Screen nanobodies from semisynthetic/synthetic libraries
有限的大小和多样性是影响从免疫文库乃至大型纯朴文库中筛选抗体效率的关键因素。由于常规IgG中的可变重/可变轻配对没有广泛的多样性,骆驼科动物的亲和力成熟度在很大程度上依赖于体细胞超突变。该过程精确地调节CDR以识别任何给定的抗原(De Genst等,2006; Nguyen等,2000)。因此,提出了半合成/合成文库,其模仿了这种体内多样化以产生能够产生针对任何特定抗原的纳米抗体的足够多样化的文库。每个纳米抗体都包含对应于高变序列的CDR,这些CDR确定抗原特异性,并包含保守的框架区(FR),这对于保存纳米抗体的结构完整性至关重要。该方法试图保留FR,并使CDR的长度和序列随机多样化,特别是延长的CDR3的长度和序列,已知这会增加抗原结合表面并显着促进抗原结合选择性(uyldermans,2013)。
- 2016年,outel等人在强大的纳米抗体支架hs2dAb的基础上创建了一个高度多样性的非免疫重组纳米抗体文库。
- 通过合理控制CDR1和CDR2的每个位置,在对200多个天然VHH中发现的多样性进行统计分析的基础上,将合成多样性引入3个CDR中,同时减少了疏水性最高的残基的存在,从而防止了聚合倾向。
- CDR3区的每个位置都带有一个随机氨基酸(半胱氨酸除外)。
- 对于CDR1和CDR2,大小固定为7个氨基酸,而对于CDR3,选择4个大小(9、12、15和18个氨基酸)以覆盖此光谱。
然后进行大规模PCR,确保至少使用10^10个不同的DNA分子作为基质。将合成文库插入修饰的pHEN2噬菌粒载体中,并转化到大肠杆菌TG1细胞中,以构建10^9个独立克隆的高多样性噬菌体展示文库。成功筛选了通用合成文库,以鉴定针对高度多样的靶标(荧光蛋白,肌动蛋白,微管蛋白,p53和HP1)的高功能结合剂。选择性结合剂的亲和力在10 nM到50 pM的数量级之间,相当好,对于未经体内免疫或体外亲和力成熟获得的单价结合剂,通常很少观察到(outel et al。,2016)。
鲨鱼V-NAR含有4个FR和2个CDR,缺少常规的CDR2(Diaz等,1998; Stanfield等,2004; Stanfield等,2007)。与骆驼科VHH抗体相似,V-NAR区具有异常长的CDR3环,其长度和序列多样性最高(Diaz等,1998; Diaz等,2002; Nuttall等,2001)。已知CDR3对抗原结合选择性有显着贡献。在天然存在的V-NAR序列的基础上,多项研究通过使用CDR3随机引物(Liu et al。,2007a)或易错PCR与剪接相结合的方式在CDR3中引入大小和序列变异,从而构建了半合成/合成鲨鱼纳米抗体文库。 根据Genbank数据库中存储的V-NAR区域,CDR3的长度在11个氨基酸到25个氨基酸之间,样本平均值为18.3个氨基酸(Shao等,2007)。长度上的合成CDR3区13-22残基用于构建半合成/合成鲨鱼纳米抗体文库。与人线粒体(Tom70)(Nuttall等,2003),毒素(葡萄球菌肠毒素B,蓖麻毒蛋白和肉毒杆菌毒素A复合类毒素)(Liu等,2007b),姜黄素K蛋白酶的外膜跨膜受体结合从淘选展示文库中分离出牙龈卟啉单胞菌(Nuttall等,2001),溶菌酶和瘦蛋白(Shao等,2007)。通常,所选粘合剂的亲和力在nm范围内。
半合成/合成纳米抗体文库的多样性接近10^9,可能需要消耗至少1 L的血液样本才能为naive文库的每个文库获得~10^9个单独的克隆。 因此,半合成/合成文库比没有免疫或收集大量血样的天然原始VHH或V-NAR文库具有更高的CDR3多样性和实用性。 另外,由于从半合成/合成文库筛选抗体所涉及的所有步骤均在体外进行,因此可以相对容易的操作要求严格控制实验条件。 因此,半合成/合成纳米抗体文库可能是获得无数种针对各种抗原的纳米抗体来源的有前途的途径,而无需动物免疫或收集大量血样。
五、结论
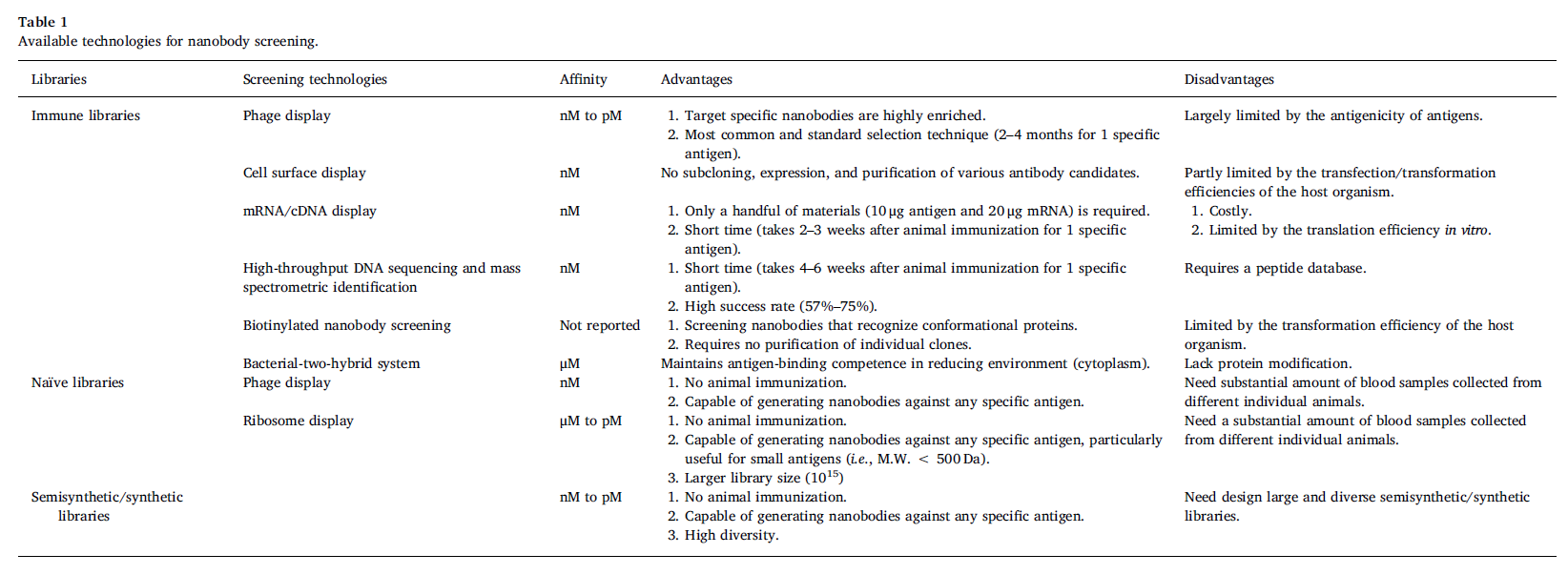
由于其优越的性能,纳米抗体在各种领域具有广泛的应用潜力,包括体内和体外疾病诊断,靶向治疗,靶向药物递送,开发免疫生物传感器,体内成像以及基于纳米的研究。这篇综述系统地总结和评估了迄今为止开发的用于从高度多样化的文库中快速选择和改进纳米抗体的最新技术(表1)。首先,从免疫文库中检索纳米抗体仍然是首选,因为目标特异性纳米抗体在免疫文库中高度富集。但是,该方法在很大程度上受到抗原的天然抗原性的限制。否则,必须从动物免疫开始为每种新抗原准备新的免疫文库。为了解决这些问题,已经开发了原始库和半合成/合成库。非免疫文库可以快速选择各种功能强大的结合剂。但是,由于缺乏体细胞成熟,因此只有从庞大的功能库中进行选择时才能获得高特异性和高亲和力的结合剂。从不同动物身上采集的大量血液样本(通常超过1 L)是确保原始库的多样性的先决条件。考虑到这一点,通过避免动物免疫和血液样本采集,半合成/合成文库可能是更实际的选择。与构建文库的方法无关,已经有大量文献证明了多种选择技术,包括噬菌体展示,酵母展示,细菌展示,mRNA / cDNA展示,细胞内双杂交系统和核糖体展示,可促进给定抗原的筛选和淘选。特异性纳米抗体。这些方法或显示平台中的大多数都可以应用于任何库类型。通过将文库与选择方案结合,再加上亲和力成熟技术,可以有效地生产出更多的纳米抗体用于各种应用。
参考资料
- Molecular Immunology 96 (2018) 37–47. Recent advances in the selection and identification of antigen-specific nanobodies
