【3.1.2】TCR亲和力如何影响TCR工程改造的T细胞抗肿瘤反应
- 亲和力(affinity)是指一个抗体的抗原结合部位与抗原的抗原决定簇的结合能力.
- 亲合力(aidity)是指一个抗体与整个抗原结合的能力.
在过去的几十年中,T细胞的过继转移彻底改变了癌症免疫疗法。特别是,T细胞的T细胞受体(TCR)工程技术在开发更精确和个性化的癌症免疫疗法方面具有重要的里程碑意义。但是,要从这种方法中获得最大收益,了解TCR亲和力,亲和力和功能性亲和力(affinity, avidity, and functional avidity)在肿瘤相关抗原(TAA,tumor-associated antigen)识别的背景下对TCR和T细胞如何发挥功能的作用,对于持续产生改善至关重要过继性T细胞疗法。除了与TCR相关的参数外,控制T细胞活化的其他关键因素是TCR共受体对TCR肽主要组织相容性复合物(pMHC)稳定化和TCR信号传导,肿瘤表位密度以及TCR中TCR表达水平的影响。
一、TCR亲和力,亲和力和功能亲合力简介 Introduction to TCR Affinity, Avidity, and Functional Avidity
从肿瘤浸润淋巴细胞到T细胞受体(TCR)和嵌合抗原受体(CAR,chimeric antigen receptor)T细胞工程,T细胞已成为癌症免疫治疗中的重要里程碑[1]。由于其TCR,T细胞在主要组织相容性复合物(MHC)的背景下识别短肽表位。该受体是免疫球蛋白基因超家族的异二聚体,由传统的αβT细胞中的两个不同的α和β多肽组成。参与抗原识别的细胞外结构域包括可变区,恒定区和铰链,二硫键位于该铰链处以稳定TCR链之间的相互作用。它继续进入跨膜区和细胞内结构域,后者与CD3γ,δ,ε和ζ蛋白非共价相互作用形成TCR-CD3复合物。当TCR正确识别同源肽-MHC复合物(pMHC),包括MHC类型与CD4 / CD8共受体之间的正确匹配时,TCR会发生一系列构象变化,从而导致第一个激活信号[2]。三种不同的TCR参数是控制该pMHC识别和后T细胞活化的主要因素,即TCR亲和力,亲和力和功能亲合力(TCR affinity, avidity, and functional avidity )(图1)。
- TCR亲和力(TCR affinity )是控制T细胞对抗原敏感性的关键因素,它被定义为单个TCR与pMHC配体之间相互作用的强度[3]。它通常由缔合率(kon)和解离速率(koff)决定,并表示为平衡解离常数(KD)[3]。
- 如果TCR亲和力与单个受体有关,则TCR亲和力(TCR avidity)可衡量多个TCR–pMHC结合的强度,并考虑其他分子(如TCR共同受体)在相互作用中的作用,而功能亲合力(functional avidity)则代表不同浓度下的T细胞适应性和活性肽表位。平均功能亲合力(functional avidity)通常描述为EC50浓度,代表达到T细胞群体半数最大激活的肽剂量[4]。尽管生理学TCR亲和力的范围可以从1 µM到100 µM [5,6],但是一些研究已经标记了在5–10 µM的肽表位上对最大T细胞活性(包括抗肿瘤T细胞反应)的亲和力阈值[3]。在与TCR样CAR进行天然TCR的比较研究中,已证明TCR样CAR中抗体片段的亲和力决定了获得更好的T细胞反应。在这项研究中,与Zhong等人所做的类似。 [6],TCR亲和力不能提高到5 µM以上,而类似TCR的CARs在nM范围内会显示出更高的亲和力阈值[7]。相反,对常规高亲和力单链TCR和TCR样CAR的比较显示,尽管TCR样CAR的表达水平较高,但它们在识别配体时不那么敏感,这可能归因于其信号传导动力学[ 9]。在一系列针对癌症/睾丸抗原(CTA)纽约食道鳞状细胞癌1(NY-ESO-1)的生理范围内具有增强亲和力的TCR中,TCR转导的T细胞可以对5 µM以上的亲和力作出反应这种亲和力可以限制T细胞的最大活化[8]。这个事实很可能是由于TCR亲和力对阈值以上[6]的TCR亲和力的贡献降低所致。此外,从TCR-pMHC相互作用的12个表型模型进行的计算分析表明,TCR affinity不是T细胞反应的可靠标记[10]。
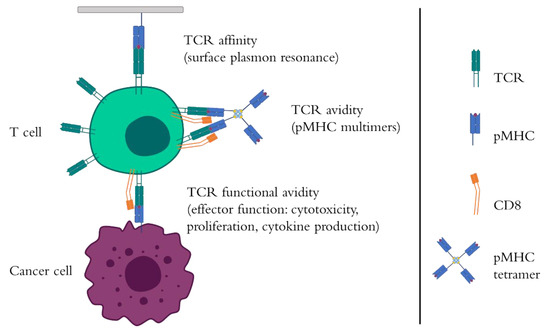
图1。 T细胞受体(TCR)与主要组织相容性肽复合物(pMHC)之间的相互作用。T细胞通过pMHC识别肿瘤肽表位。不同的参数会影响T细胞(包括T细胞受体(TCR)工程化的T细胞)对pMHC表现出的敏感性。TCR亲和力描述了单个TCR和pMHC之间相互作用的强度。通常使用称为表面等离振子共振的技术进行测量。另一方面,TCR avidity 反映了多个TCR和pMHC的接触。因此,由许多通过链霉亲和素-生物素复合物连接至荧光染料的pMHC组成的多聚体可用于染色抗原特异性T细胞并测量其TCR亲和力。此参数还考虑了T细胞共受体(例如CD8)在稳定TCR-pMHC结合中的作用。与TCR亲和力密切相关,功能亲合力显示T细胞对靶抗原的适应性取决于其激活和效应子功能,即T细胞增殖,抗肿瘤细胞毒性,细胞因子产生,激活标记的上调等。
TCR在成熟过程中获得特异性,该过程基于变量(V),连接(J)的体细胞重排,并且仅在β链中具有多样性(D)TCR片段[ 11]]。这些重排产生具有不同特异性的TCR几乎无限的库,包括识别自身抗原即人体天然表达的抗原的TCR。过继性T细胞疗法中靶向的许多肿瘤相关抗原(TAA)是自身抗原,也可以存在于健康组织中。由于自身反应性淋巴细胞阴性选择的机制,通常消除了对自身抗原具有高亲和力的T细胞克隆。因此,循环T细胞中针对TAA的高亲和力TCR的频率较低。实际上,天然癌症特异性TCR通常会促进T细胞对生理表位密度的不良反应,这可以解释为什么肿瘤能够避免被T细胞识别[ 12]]。相反,具有更高亲和力和更长的TCR–pMHC结合动力学半衰期的TCR通常可以产生更好的T细胞反应,因为它们可以感知到较低的肽表位密度[ 12 ]。由于编辑了T细胞库,并且循环T细胞对自身TAA的亲和力通常很低,因此体外亲和力成熟是增加T细胞识别低剂量肽表位的能力的有效工具,甚至可以导致亲和力增加700倍[ 13]。但是,重要的是要强调,亲和力成熟可能并不总是解决不认识到低表位密度的问题,因为已经证明,具有非常高亲和力的亲和力成熟的TCR可以提高T细胞反应的速度,但会失败应对pMHC的低密度[ 13 ]。较低的TCR亲和力可恢复这种识别不足,导致半衰期超过10 s,但半衰期从10 2到10 3 s会导致灵敏度降低[ 13 ]。在一项分析k off的研究中接种不同肽后的低和高抗原特异性T细胞克隆文库的解离速率,解离速率与靶标识别和Ca 2+动员相关[ 14 ]。更重要的是,用于疫苗的肽的亲和力对疫苗接种后患者体内产生的T细胞克隆的亲和力具有重大影响,天然和低亲和力的肽可以促进癌症特异性T细胞的分化。二、表位密度的作用 The Role of Epitope Density
T细胞的活化取决于TCR–pMHC的结合动力学,而TCR–pMHC的结合动力学又受肿瘤细胞或抗原呈递细胞(APC)膜上抗原决定簇密度的影响[ 15 ]。TAA在细胞内加工,与MHC分子结合形成pMHC,并呈递到细胞膜上。肿瘤肽和MHC分子之间的结合亲和力已与T细胞的反应方式相关。似乎需要10 nM或更高的肽-MHC亲和力才能使肿瘤消退[ 16 ]。然而,由于其抗原加工和呈递机制的缺陷,例如人类白细胞抗原(HLA)分子水平的下调,肿瘤肽抗原通常在肿瘤细胞表面少量表达[ 17]。]。在许多情况下,使用基于mRNA的技术分析TAA的水平,这可能会误解T细胞可用的实际pMHC数量[ 18 ]。在预测的替代剪接形式的肽组分析中,观察到与正常转录本相比,癌症剪接变体中过量的肽代表了HLA I类表位的少数[ 19 ]。此外,从癌组织的转录物中发现亲水性氨基酸含量更高,这可以解释为什么癌症特异性肽更不容易被预测为MHC表位[ 19]。]。一些研究试图通过使用针对CTAs NY-ESO-1和L抗原家族成员1(LAGE-1),过表达的TAA,或分化相关的TAA [ 20,21,22 ]。这项技术表明,天然加工的TAA肽表位通常以每细胞10到150个拷贝的比例出现[ 20 ]。这些数目对于抗原特异性T细胞就足够了,因为已经证明一个单一的TCR-pMHC相互作用可以诱导辅助性T细胞中的T细胞活化[ 23]。]。这种pMHC可以与不同的TCR分子结合,并在与大约200个TCR结合后触发T细胞活化[ 24 ]。而且,三个pMHC复合物足以促进细胞毒性T细胞的杀伤[ 25 ]。然而,最近的观察将正确的T细胞活化所需的pMHC配体数量增加到最少90个[ 26 ]。
尽管TCR affinity与T细胞感知较低密度抗原的能力直接相关,但是当pMHC数量很低时,TCR(功能性)亲和力可预测TCR改造的T细胞诱导肿瘤特异性反应的能力。 。一些证据表明,表位密度而不是TCR亲和力或亲和力在引发癌症特异性T细胞反应中起主要作用。在非霍奇金B细胞淋巴瘤小鼠模型中,Segal及其同事观察到,亲和力在消除肿瘤负担方面没有主要作用[ 27]。高亲和力和低亲和力的TCR均可成功根除小肿瘤,并且无法对大肿瘤做出反应。重要的是,与低亲和力T细胞相比,高亲和力T细胞的数量减少了,这很可能是由于第一组细胞凋亡的诱导。T细胞适应性可以通过改变表位密度来恢复,以降低肿瘤一侧的亲和力。Dougan及其合作者针对内源性黑色素瘤抗原酪氨酸酶相关蛋白1(TRP1)也描述了类似的观察结果[ 28 ]。另一报告认为,亲和力是消除体内白血病细胞的主要因素,而不是表位密度,肽-MHC亲和力或pMHC的稳定性[ 29]。]。这些发现支持存在亲和力和亲和力的阈值,在该阈值之上,T细胞克隆中进一步的亲和力增强或超生理亲和力的选择不会转化为更好的体内反应。因此,这挑战了为临床前和临床测试选择T细胞克隆和TCR的方式。然而,Jaigirdar及其同事的一项研究表明,针对白血病抗原Wilms’肿瘤1(WT1)的高亲和力TCR无法识别天然加工的WT1肽[ 30 ]。这些分歧的研究强调了在癌症识别的背景下TCR-pMHC相互作用的复杂性,以及将T细胞克隆或TCR的选择过于简化以进行TCR工程改造以达到最佳TCR亲和力或亲和力的风险。
三、TCR共受体的作用 The Role of TCR Co-Receptors
一旦TCR结合了相应的pMHC,TCR共同受体CD4和CD8分别结合到II类和I类MHC分子的恒定区。通常已知的是,这些共同受体增强T细胞的灵敏度和响应作为两种主要效应的结果:
- TCR和同源的pMHC 之间的弱相互作用的稳定化;
- 共受体相关的酪氨酸的细胞内激酶招募的Lck到TCR的附近信号复合物,从而增强了TCR信号级联的启动。
然而,尽管许多研究支持CD8在后一种效应中的作用,其中CD8依赖性的TCR亲和力阈值范围为60至120 µM [ 36 ],但CD4仅起到加速TCR触发的信号传导的作用,而不能稳定TCR-pMHC相互作用[ 37,38 ]。CD4对MHC分子的亲和力极低,这种能力引起争议[ 39 ]。然而,抗CD4和抗CD8抗体会减少或阻断,并且在某些抗体克隆的情况下甚至会增强TCR与之相互作用的程度,这说明了共受体参与TCR与pMHC结合的重要性 [ 40,41]。当TCR以低亲和力与pMHC结合时,这种抗体的阻断或增强作用更加明显[ 41 ]。而且,对于具有低亲和力的TCR的T细胞增强的激活,但对于具有高亲和力的TCR的T细胞的激活,CD8共受体的胞外域提供的稳定似乎是必不可少的[ 42 ]。
CD8共同受体已经发现通过改变TCR-的pMHC相互作用[的结合和解离速率二者以增强在亚最佳TCR-的pMHC亲和力结合效率43,44 ]。此外,CD8通过将TCR–pMHC I类复合物以取决于CD8对MHC亲和力的速率动员到膜微区,从而调节TCR敏感性或触发阈值[ 44]。]。与细胞外结构域相反,CD8的细胞内信号结构域对于增强T细胞活化具有至关重要的作用,而与TCR的强度无关[ 42 ]。此CD8 /的Lck依赖性酪氨酸激酶活性的降低,降低TCR的灵敏度,并且因此,阻止T细胞效应子功能[ 45,46,47 ]。基于这些发现,对CD8增强T细胞功能的依赖性程度取决于其TCR对同源pMHC的亲和力。此外,使用pMHC多聚体的研究表明CD8在抗原特异性TCR结合中起关键作用。在CD8结合位点带有突变的四聚体选择性结合高亲和力T细胞,但不结合低亲和力T细胞[ 48]。此外,CD8共同受体的接合增强T细胞和它们的同源多聚体[之间的相互作用的亲合力和稳定性48,49 ]。前述观察强调了TCR共受体的存在或不存在如何影响T细胞与同源pMHC分子之间的相互作用。另外,共受体表达水平或MHC结合能力的改变也影响T细胞功能。HLA-A2的α3结构域中的人为突变证明了这一点,该突变取消了CD8共受体结合,从而抑制了T细胞介导的靶细胞特异性裂解,而又不干扰TCR-pMHC的相互作用[ 50]。另一方面,人工改变的具有增强的CD8结合能力的HLA-A * 68分子导致T细胞增殖和细胞因子分泌增加[ 51 ]。CD8–pMHC相互作用的功能作用还被以下事实所强调:只有在存在共受体参与的情况下,才能实现较低亲和力的pMHC刺激的T细胞的IFN-γ分泌和CD107a表面表达[ 43 ]。最后,CD8与低亲和力TCR的协同作用提出了针对自身肽的不良自身反应性问题。然而,T细胞具有通过下调CD8膜表达以减少其功能性亲合力,从而它们的自身反应性潜力的能力[.l
]52,53 ]。
四、癌症特异性TCR的选择 Selection of Cancer-Specific TCRs
搜寻特定于癌症的TCR候选药物的一个很好的起点,是将其与经工程改造以表达完整肿瘤抗原或被靶肽脉冲处理的基于肽的疫苗或树突状细胞(DC)治疗后有反应的患者隔离开来(由[ 54 ]审查)。使用的DC基于肽的或抗原mRNA的基于癌症疫苗中的应用集中在表位密度的抗原呈递细胞的表面上的增量,以促进免疫系统针对一种或多种肿瘤相关抗原(由[综述55,56])。当患者细胞不可用时,使用供体材料是另一种选择。可以使用自体肽加载的单核细胞衍生的DCs分离来自幼稚库的高免疫性T细胞克隆,然后用肽加载的外周血单核细胞(PBMC)进行再刺激[ 57 ]。尽管由于缺乏针对自身抗原的高反应性克隆,这可能很难实现。肿瘤反应性T细胞克隆的另一个来源是同种异体材料。在这种情况下,从供体不匹配的细胞用于旨在实现对充分的pMHC而不是单独的肽[同种异体反应性T细胞的特异性58,59,60]。可替换地,已接种的靶肽的转基因小鼠表示通常通过朝配体[具有高亲和力定义鼠TCR的源极61,62,63 ]。但是,该策略的一个缺点是同种异体TCR可能显示抗原决定簇混杂,并可能引起脱靶反应[ 58 ]。为了提高TCR候选物的特异性和亲和力,可以从病毒相关的恶性肿瘤中使用病毒抗原(综述见[ 64]),但针对这些表位的反应性T细胞的使用将仅限于一定数量的患者。对肿瘤新抗原具有反应性的T细胞克隆正获得发展势头,因为后者是真正的癌症表位,在健康组织中没有发现[ 65 ]。这些特定的新抗原T细胞提供高度特异性的肿瘤反应性TCR的遗传传递[源66,67 ]。然而,这种方法提出了与候选新表位的正确鉴定有关的挑战,因此与新抗原特异性T细胞克隆型的鉴定有关,以及与肿瘤突变的异质性和这些抗原的表位密度有关的其他挑战[ 68]。 ]。
无论其来源如何,通过使用pMHC多聚体的结合测定和功能测定[ 69 ] ,选定的TCR候选物均应接受进一步测试以确保其特异性和功效[ 69 ](图1)。由于TCR对自身抗原的结合强度比对病毒抗原的结合强度弱,这一点尤其重要[ 69 ]。TCR亲和力与T细胞免疫反应之间的这种相关性通过用病毒(较高亲和力)或癌症特异性(较低亲和力)TCR改造的T细胞反应方式的差异清楚地证明了[ 69 ]。此外,与低亲和力的TCR相比,高亲和力的TCR倾向于更少地依赖于CD8共受体结合的作用[ 69]。使用的pMHC多聚体已经使用II的pMHC类多聚体仍然具有挑战性的〔被广泛地用作选择的第一种方法来分析TCR亲合力,尤其是对CD8阳性T细胞,作为检测抗原特异性CD4 T细胞的70,71 ]。但是,如前所述,pMHC多聚体不能提供有关功能亲合力的信息,甚至可能无法鉴定重要的抗原特异性TCR组成部分[ 72 ]。为此,Morimoto及其同事开发了一种TCR缺陷型CD8阳性Jurkat衍生细胞系,以快速,一致地评估克隆的TCR的功能亲合力[ 73]。这种称为2D3的细胞系提供了一种使T细胞功能性亲和力测量均质化/标准化的方法。它具有激活的T细胞(NFAT)驱动的增强型绿色荧光蛋白(EGFP)报告基因的核因子,因此TCR激活可以与EGFP表达相关[ 73 ]。一的该细胞系的优点是,它可以被容易地转用编码使用任何类型的工程方法[的TCR的DNA或mRNA修饰73,74]。Rosskopf及其同事进一步向三种Jurkat衍生的细胞系中添加了三种荧光蛋白:EGFP,青色荧光蛋白(CFP)和mCherry。借助此三参数报告平台,最多三个转录因子-NFAT,活化的B细胞核因子κ-轻链增强子(NF-κB)和活化蛋白1(AP-1),它们在T细胞中起关键作用-细胞激活-可以同时进行分析以评估TCR功能[ 75 ]。CD137是刺激CD8 T细胞后24小时上调的激活标记,可以用作富集标记,用于从纯天然库中扩增不同T细胞亚群的高存活率T细胞克隆[ 76]]。选择亲和力优化的TCR的最大挑战之一是降低目标上或目标外交叉反应的风险。边界等。萨尔瓦多等人描述了一种扫描方法,通过该方法可以确定有效的TCR,同时指出可能是潜在危险的TCR [ 77 ]。该扫描方法基于基于亲和力和功能亲合力的天然TCR的第一选择,然后是那些TCR的亲和力增强以及进一步的亲和力和功能表征。然后通过使用X扫描比较最终的候选物,X扫描是一种系统,其中目标肽的所有残基都突变为每种可能的氨基酸。这种广泛的筛选确保了候选物不会识别其他潜在的肽,而是目标肽。
我们的小组还强调了选择正确的APC来正确分析TCR亲和力的重要性[ 4]。为了分析TCR亲和力并预测癌症特异性TCR工程改造的T细胞的敏感性,APC用不同浓度的肽抗原(通常在微摩尔范围内)脉冲处理。尤其是,T2细胞系,即T细胞-B细胞杂交瘤,已成为此类分析的金标准。该细胞系在与抗原加工(TAP)蛋白相关的转运蛋白上存在缺陷,导致细胞表面上存在“空” HLA分子。尽管此功能在肽脉冲测定中是合乎需要的,但与自然加工的TAA肽相比,高于生理水平的脉冲肽的丰度可能会导致TCR亲和力的错误表述。实际上,当通常使用微摩尔量的肽进行肽脉冲测定时[ 74[ 78 ],需要以低纳摩尔浓度对T2细胞进行脉冲刺激,使其类似于生理量的表位[ 21 ]。当然,其他用于研究肿瘤杀灭,细胞因子产生(对于与细胞因子风暴有关的不良反应也很重要)的细胞系和测定方法,以及一般而言,任何其他T细胞适应性和抗肿瘤反应特异性的指标都是可能的。
五、改善TCR工程改造的T细胞抗肿瘤反应
尽管TCR亲和力与T细胞活性之间的相关性存在一些分歧,但选择高亲和力TCR或提高低亲和力TCR的亲和力构成了改善抗肿瘤反应的手段(图2)。不同的技术被用于TCR的亲和力成熟,包括:
- 噬菌体展示系统可在皮摩尔范围内实现TCR的亲和力【3,79,80 ],
- 酵母TCR显示系统[ 81 ],
- 丙氨酸哺乳动物逆转录病毒展示系统-scanning的方法来识别关键氨基酸残基[ 82 ]
- 关键氨基酸在TCR互补决定区(CDR)取代[ 83,84,85 ]
- 使用体细胞超突变[ 86 ]
另一个要注意的是,提高T细胞表面的转基因TCR二聚化和TCR可用性代表了一种改善TCR亲和力并因此改善T细胞功能的方法[ 36 ]。一个在TCR工程的陷阱的是转基因的TCR的低表达由于与天然TCR,其又可以引起有害的反应性,和竞争的TCR复合物机械[错配87,88,89,90 ]。多年来,针对TCR机械的不同方面,已经开发出了多种技术来解决此问题(图2):
- 一种提高在细胞表面上可用的转基因TCR的量,同时降低了天然TCR的存在是通过沉默使用或者包含在同一载体中的短发夹RNA的天然TCR序列,其中所述转基因TCR位于[ 91,92,93,94 ]或通过沉默性RNA(siRNA)转染。在这两种情况下,siRNA均针对TCR链的恒定区,一次靶向多个天然TCR序列。完全去除的天然TCR的可通过技术如锌指核酸酶(ZFN)来实现95,转录激活样效应核酸酶(TALEN)] [ 96,97,98],或者,最近,群集规则间隔开的短回文重复序列(CRISPR)-Cas9系统[ 97,98,99,100 ]。
- 尽管天然TCR抑制是减少TCR错配的简单方法,但是其他策略也可以解决转基因TCR的稳定性,并通过这样做降低TCR错配(图2)。因此,对于T细胞的基因工程的TCR已被修改以额外二硫键[ 101,102,103 ],它最近已在高亲和力的TCR可溶性采用[ 104]。这是通过在TCRα和β链中引入半胱氨酸来实现的。备选地,人TCR链的恒定结构域可以替代鼠类αβ或人γδTCR。与此策略,αβTCR链的恒定区被交换,以产生保留其抗肿瘤功能[嵌合TCR的105,106,107,108,109 ]。尽管增强了TCR抗肿瘤功能,但异种材料的存在可能会导致免疫原性,从而可能阻碍细胞的作用。这个问题可以通过用鼠源的TCR恒定区中的关键残基代替[ 110]来解决。]。此外,尽管该策略仍会产生配对错误的TCR,但它们无法与CD3结合,从而使其无效[ 105 ]。但是,使用这些策略,配对仍然可能发生。为了在很大程度上避免不正确的配对,单链TCR基于与连接子相连的TCRα和β链可变区的融合[ 111 ]。然后将该结构连接到TCRβ恒定区以形成单链TCR,而恒定TCRα则单独添加以允许募集CD3复合物。与完整的TCR相似,在可变区中添加额外的二硫键可以增强分子的稳定性,甚至可以改善工程细胞的功能活性[ 111]]。天然TCR池或转基因TCR结构的这些改变当然可以组合以进一步增加TCR亲和力并促进更好的T细胞应答。
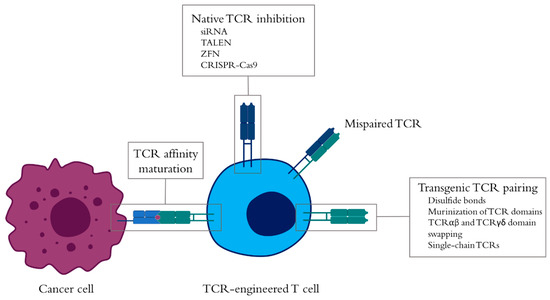
图2. 肿瘤特异性T细胞受体(TCR)工程化的T细胞的增强。可通过TCR亲和力成熟过程(例如噬菌体展示或互补性中关键氨基酸的替代)来改善TCR-肽-主要组织相容性复合体(pMHC)相互作用的亲和力,从而利用TCR工程化T细胞的抗肿瘤功能。确定TCR的区域(CDR)。另一方面,天然TCR和转基因TCR的存在会导致其TCR链错配,从而降低T细胞表面转基因TCR的水平。为克服此问题,可以通过沉默靶向mRNA转录物中TCR恒定序列的RNA来下调天然TCR的存在,或完全废除诸如锌指核酸酶(ZFN)之类的工具,转录激活子样效应核酸酶(TALENs),或成簇规则间隔的短回文重复序列(CRISPR)-Cas9系统。这些技术可以与通过添加二硫键,TCRαβ恒定结构域的murinization或在TCRαβ中使用TCRγδ结构域来改善TCR配对相结合。最后,将两条TCR链转换为一条TCR链的系统还可以确保在不取消其表达的情况下,不会与天然TCR发生错配。
六、 TCR亲和力和亲和力在癌症特异性TCR工程改造的T细胞中的临床影响 Clinical Impact of TCR Affinity and Avidity in Cancer-Specific TCR-Engineered T Cells
癌症特异性TCR工程改造的T细胞已在临床中使用了十多年[ 112 ],同时还提出了TCR亲和力和亲和力将在成功消除癌细胞中起主要作用的想法[ 113 ]。亲和力成熟的TCR-改造的T细胞已经成功地在肿瘤中诱导临床应答表达由T细胞(MART-1)[识别的黑色素瘤抗原114,115,116 ],糖蛋白100(GP100)[ 114 ],WT1蛋白[ 117 ],癌胚抗原(CEA)[ 118 ],NY-ESO-1 [ 119,120,121,122,123,124 ],LAGE-1 [ 124 ],或黑素瘤相关抗原A(MAGE-A)家族[ 125,126,127,128 ]。抗肿瘤亲和力增强型TCR尽管能提高对具有低表位密度的肿瘤细胞的识别能力,但也增加了与正常组织抗原发生交叉反应的风险。脱靶识别和交叉反应性已经在临床试验中使用亲和增强的TCR [被证实118,125,127,128 ]。从带有CEA肽的免疫小鼠中分离的用亲和力增强的HLA-A * 02限制的TCR工程化的T细胞导致严重的短暂性结肠炎[118 ]; 而源自经MAGE-A3疫苗接种的转基因小鼠的亲和力增强的HLA-A * 02限制性MAGE-A3 / A9 / A12特异性TCR则由于脑细胞对MAGE-A12的识别而引起了神经毒性[ 125 ]。针对骨髓瘤和黑色素瘤发展的另一种高亲和力HLA-A * 01限制性MAGE-A3特异性TCR导致心源性休克并导致前两名治疗的患者最终死亡[ 127 ]。临床前研究表明,没有预期的脱靶反应性[ 128 ]。然而,用这种TCR改造的T细胞引起患者严重的心脏组织损伤由于识别一个横纹肌肌肉特异性肌联蛋白衍生肽[的127,128]。尽管未经历亲和力增强的TCR也会发生致命的不良事件[ 129 ],但这项研究表明,如果没有事先进行交叉反应性的广泛测试,使用具有亲和力的TCR就有风险。为了解决这个问题,Sanderson及其同事开发了一种广泛的体外临床前测试方案,以通过使用多种测试材料(包括人类肿瘤细胞系,原发性肿瘤)来评估亲和性增强的MAGE-A4特异性TCR的安全性和有效性。 EBV转化的B淋巴细胞细胞系(B-LCL)的材料和面板,可表达多个HLA等位基因和分子分析[ 130]。经过此测试程序后,Sanderson及其同事获得了具有安全临床特征的亲和力增强型TCR候选药物,可以在临床试验中进行测试(NCT03132922,NCT04044768)。涉及亲和力增强的TCR的另一个问题围绕着通过识别HLA分子产生的恒定的强直信号。尽管这个问题最初可能不会使患者的生命处于危险之中,但由于TCR-CD3下调和抑制受体上调,它损害了工程化T细胞的功能活性[ 131 ]。从好的方面来说,可以通过微调TCR的亲和力来防止这种恒定的TCR激活[ 131 ]。
TCR的内源性和转基因TCR链之间的错配,但不限于高亲和力的TCR,要被考虑用于过继TCR-改造的T细胞疗法[安全的担忧88,89 ]。尽管到目前为止尚未报道由与TCR错误配对相关的新反应性引起的不良事件,但这是一个潜在的问题,可以通过使用多种技术破坏内源性TCR来解决(图2),其中一些技术已经在TCR中进行了测试。诊所阳性结果[ 117,132,133]。尤其是,CRISPR-Cas9系统以其简单,保真和多功能性,彻底改变了细胞基因工程化方法以治疗癌症[ 134 ]。最近,这种方法已用于难治性癌症患者,以癌症特异性TCR修饰T细胞,同时抑制多重系统中的内源性TCR链和阴性免疫检查点编程的细胞死亡蛋白1(PD-1)基因[ 132] ]。
在难以分离癌症特异性TCR的患者中,来自健康供体的T细胞可能是一个很好的选择[ 135 ]。此选项的优点之一是,可以筛选出无限数量的T细胞数量没有受到损害的供体,直到获得最佳的高亲和力TCR。但是,患者和供体的HLA谱应匹配,以防止内源性供体TCR的同种异体反应[ 135 ]。该策略的另一个问题是由供体TCR引起的潜在脱靶反应性,可以使用使TCR错配最小化的相同技术来预防。由于源自细胞毒性CD8 T细胞的TCR具有潜在的严重毒性,因此从调节性T细胞(Treg)获得高亲和力TCR [ 136]]或辅助CD4 T细胞[ 137,138 ]代表癌特异性的TCR的替代来源。尽管使用Treg衍生的TCR引起了人们对体内工程化的辅助CD4 T细胞向Tregs重定向的可能性的担忧,但迄今为止在患者中并未观察到这种情况,而是导致了转移性癌症患者的肿瘤消退[ 139 ]
七、结论和未来展望
TCR亲和力,亲和力,共受体和表位密度之间的微妙联系强调了在增加的TCR亲和力或亲和力以降低表位密度和超生理学T细胞活性之间寻找平衡的重要性,以避免潜在的危险交叉反应。在这个方向上,新的方法来生产具有微调亲和力[TCR的140 ],从头生成肿瘤特异性的TCR [的141 ]和新抗原的选择[ 142,143 ]或TAP非依赖性抗原[ 143,144作为用于肿瘤靶向的表位将有利于产生更有效和更安全的TCR修饰的T细胞。TCR疗法的未来越来越成为不限于传统的T细胞,如非传统淋巴细胞如γδT细胞,和它们的TCR,和自然杀伤细胞正在探讨在临床前和临床设定[ 145,146,147,148]。这些细胞类型绕过与TCR错配和交叉反应性相关的关注,同时具有固有的抗肿瘤活性。由于缺乏移植物抗宿主并发症,它们还提供了生产自体异基因产物的可能性。此外,组合方法,以改善用细胞因子或免疫检查点T细胞活性抑制剂可消除需要产生的TCR与超生理的亲和力,可能导致严重的副作用[ 132,149,150,151]。总之,TCR-pMHC相互作用的复杂性以及T细胞-肿瘤细胞相互作用的复杂性将要求TCR基因工程采取整体方法来开发更精确和有效的过继性T细胞癌症疗法。
参考资料
- The Quest for the Best: How TCR Affinity, Avidity, and Functional Avidity Affect TCR-Engineered T-Cell Antitumor Responses. https://www.mdpi.com/2073-4409/9/7/1720/htm
