【3.1.3】肿瘤浸润淋巴细胞(TILs)-TCR工程改造
TILs(Tumor Infiltrating Lymphocytes)是肿瘤微环境中识别肿瘤相关抗原的T细胞。
肿瘤相关抗原的发现是TILs研究的基础。1991年van derBruggen等人发现了第一个肿瘤相关抗原,黑色素瘤相关抗原1(melanoma-associated antigen 1 ,MAGE-1)(文献1)。之后,一系列肿瘤相关抗原,肿瘤特异性抗原被鉴定。
2007年使用黑色素瘤相关抗原MART-1特异性TILs治疗的肿瘤病人,比非特异性TILs治疗的病人,中位生存时间提高15倍(文献2)。
下表举例常见的肿瘤相关抗原

CTA:癌-睾丸抗原,天然存在于胚胎发育的组织,滋养层细胞,胎盘等,也被称之为Universal的肿瘤抗原。
表达调控异常的抗原:在肿瘤高表达,或者发生了突变。但是在正常组织也有表达。突变产生的新抗原,也称之为肿瘤新生抗原。
最理想的作为靶点抗原,只在肿瘤表达而不表达于正常组织。如果在正常组织表达,最大的安全隐患是“on-target,off-tumor”
一、TCR工程改造
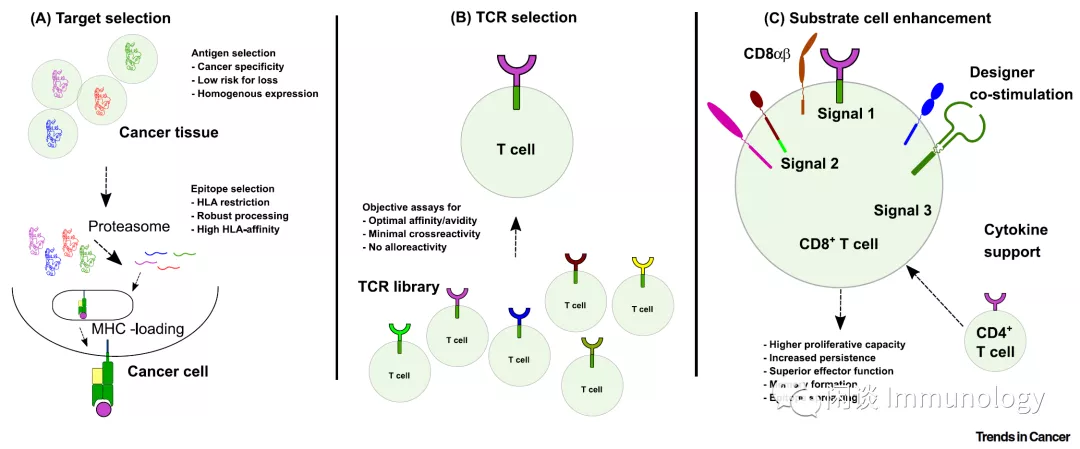
1.1 肿瘤特异性TCR筛选
T细胞的抗原特异性,由TCR决定。TCR是由α和β链组成的异二聚体,和CD3组成复合物,并通过CD3的胞内段传导T细胞活化的信号。
筛选TAA特异性T细胞:使用负载特异性TAA的APC细胞筛选,或者使用TAA的转基因小鼠,筛选带有可与TAA结合TCR的T细胞。
鉴定肿瘤特异性TCR的α链和β链,然后将α和β链基因转入细胞,看是否能够重组出特异性结合TAA的TCR。 最初Cole将基因转入Jurkat细胞(一种T细胞系),发现重组的TCR可以识别TAA多肽,但是不能识别黑色素瘤细胞系上的TAA(文献3)。之后Clay使用外周血来源的T细胞,则重组的TCR既可以结合TAA,也可以识别黑色素瘤细胞。
1.2 亲和力增强
过继细胞治疗中使用的TCR多是MHC-I类分子限制性的,经典理论CD8细胞是需要的(MHC-I类分子识别CD8T TCR, MHC-II类分子识别CD4T TCR)。 但是现在很多研究组结果显示,MHC-I限制性的CD4T TCR,并不需要CD8T细胞存在。换句话说,天然情况下,TCR和MHC是低亲和力的,所以需要CD4T和CD8T与MHC分子的匹配。如果MHC-1和TCR是高亲和力结合则无需依赖CD8T细胞,MHC-1类分子可以和CD4T细胞TCR结合(文献5)。
自然情况下,因为阴性选择,高亲和力的TCR非常少。所以可以通过基因修饰,产生高亲和力的TCR。 常用的方法是:单个或者几个氨基酸的替换,TCR的CDR区和肿瘤抗原的亲和力就可以极大提高(文献6)。美国国家癌症研究所2011年,使用靶向NY-ESO-1基因修饰TCR(CDR区两个氨基酸替换)治疗转移性黑色素瘤和转移性滑膜细胞肉瘤,11个黑色素瘤病人,5个发生客观应答(OR),6个转移性滑膜细胞肉瘤则4个发生OR。(文献7)
除了积极的临床结果,也有一些负面的报道。基因修饰的TCR(靶向MAGE-A3/A9/A12)治疗转移性黑色素瘤,9个病人2个发生了致命性神经副作用,原因脱靶结合存在于大脑的MAGE-A12,典型的“on-target, off-tumor”副作用(文献8)
后续又发现靶向MAGE-A3的基因修饰TCR的TILs治疗黑色素瘤等,结果2个病人因为急性心脏衰竭发生死亡。后来发现是和心脏的titin蛋白发生了交叉反应,这种事“off-target,off-tumor”(文献9)。
1.3 载体设计
现在最多使用的是整合基因组的病毒载体(逆转录病毒和慢病毒系统),也有尝试腺病毒和痘病毒。
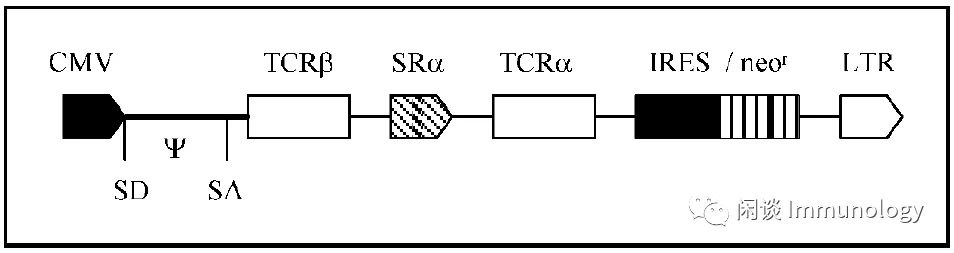
图片源于文献10
1990年Rosenberg使用逆转录病毒修饰TCR的TILs治疗晚期黑色素瘤(文献11)。
逆转录病毒将α和β链基因整合入基因组中,转染细胞会表达多拷贝的α和β链(转导拷贝和内源性拷贝)。当内源性和转导的α链和β链组成异二聚体TCR时,不但起不到增强和TAA亲和的作用,而且这种异常表达的蛋白质,可能引起机体的免疫反应,导致自身免疫性疾病的发生(文献12)。
转导TCR α链和β链配对表达策略
- 密码子优化,改变基因序列,增加翻译效率,不改变蛋白质序列的情况下,增加转导α和β链成对表达,也被证实可以增加对肿瘤的识别。TCR胞外区的亮氨酸残基,导致在α和β之间形成二硫键,增加潜在的配对可能性。在α和β链加上亮氨酸拉链,导致coiled-coil形成,增加亚基之间的结合。 (文献13)
- 将小鼠的CDR区加入TCR,导致小鼠-人嵌合体TCR高表达,证实可以增加T细胞功能,且增加CD3结合稳定性。
- 为了彻底克服错配的问题,Voss发明了单链TCR,融合了α链和β链可变区和恒定区。(文献14)
- 为了防止TCR错配,另外一种方式是将内源性的TCR敲除,如使用siRNA,TALENs,CRISPR等。
Foley等比较了不同TCR优化方式,小鼠-人嵌合体TCR,亮氨酸拉链,可以更显著的增加表面TCR表达和增加细胞因子产生(文献15)。
1.4 细胞因子和肿瘤微环境
在进行过继细胞移植治疗时,需要非清髓化疗进行淋巴细胞清除,目的减少对于有限的细胞因子的竞争,以及清除抑制性淋巴细胞(如Treg),减少内源性T细胞对于抗原的结合,增加输注T细胞的活性。
Dudley等进行的临床试验显示,使用环磷酰胺和氟达拉滨进行非清髓化疗,清除内源性淋巴细胞,再进行TILs过继治疗,展示出超过50%的客观响应。 Dudley也试验了使用全身辐照(TBI)进行淋巴细胞清除,再输注TILs,结果显示2Gy的TBI组的客观相应是52%,而12Gy的TBI组为72%。 Dudley等也尝试了通过系统注射IL-2增加T细胞的功能和存活。(文献16.17)
但是淋巴细胞清除和IL-2注射都增加了毒副作用。因而可通过基因修饰,增加细胞存活和存续时间,减少淋巴细胞清除和IL-2的使用量。或者TILs自己携带编码细胞因子基因(如表达IL-2,IL-12,IL-2Rα),趋化因子受体CXCR2(其结合肿瘤表达的趋化因子CXCL1),趋化TILs到肿瘤微环境。
1.5 T细胞代谢谱
检测TILs功能除了IFN-γ,TNF-a,IL-2等细胞因子谱外,代谢谱也需要。可参考阅读:T细胞代谢与功能的关系
TILs作为携带肿瘤特异性抗原TCR的细胞,在免疫细胞治疗应该有很大潜力,Rosenberg等大佬们,也都做过很多工作,国内也有几家企业开始深入开发,期望好消息。
参考资料
