【8.1.2】11类肿瘤抗原
1.癌症种系抗原(CGAs)
癌症种系抗原(Cancer germline antigens,CGAs),也称癌症-睾丸抗原,来源于胎儿发育过程中表达的基因。这些基因在大多数健康成人组织中被表观遗传学沉默(除了生殖细胞和胎盘滋养细胞)。
然而,它们通过DNA去甲基化可以在多种肿瘤中表达,并可以产生被T细胞识别的肽片段。如NYESO-1和MAGE-A蛋白,由X染色体编码,并在几种类型的癌症中表达。
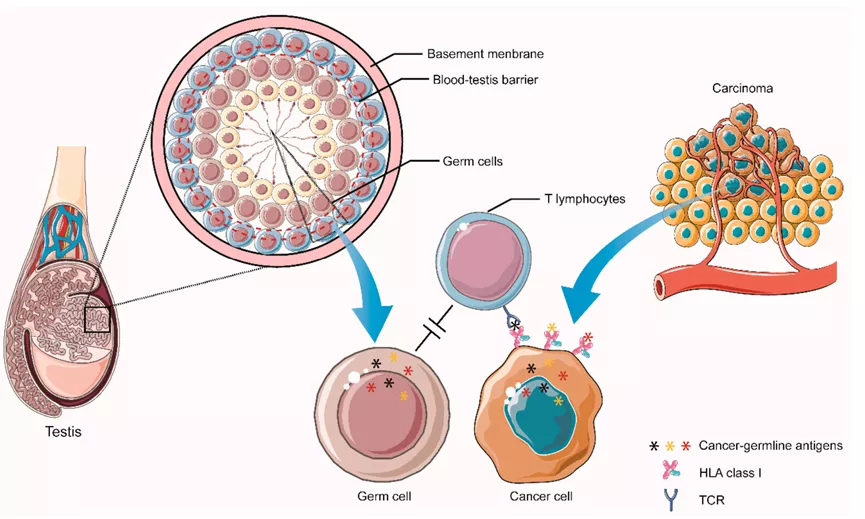
人们已经多次尝试通过用CGA疫苗治疗癌症。然而,尽管在血液中产生了高频率的反应性T细胞,但未能实现肿瘤消退,也未能预防手术切除肿瘤患者的癌症复发(NCT00796445 A Phase III Study to Test the Benefit of a New Kind of Anti-cancer Treatment in Patients With Melanoma, After Surgical Removal of Their Tumor)。
使用亲和力增强和MHCI类限制TCR的自体淋巴细胞靶向NY-ESO-1,在超过50%的NYESO-1阳性转移性黑色素瘤和滑膜细胞肉瘤患者,观察到客观的、短暂的反应,对正常组织没有毒性。 靶向MAGE-A3的T细胞疗法,出现了对大脑MAGE-A12和心脏肌动蛋白的交叉反应。所以CGA虽然是肿瘤特异性的,但还是会在特定情况下出现脱靶毒性。
2.人内源性逆转录病毒(HERVs)抗原
人类内源性逆转录病毒(Human endogenous retroviruses,HERVs)是古代逆转录病毒整合事件的残余,位于整个人类基因组,约占基因组DNA的8.5%,但其中只有一小部分包含可以成功翻译的完整序列。正常组织中在表观遗传学上被沉默(通过DNA甲基化)。
与CGAs类似,HERVs可以通过DNA去甲基化在肿瘤中表达,并可以产生多肽,并被患者自身的T细胞识别。除了自身具有免疫原性外,HERV还可能导致双链RNA的形成,从而触发类似于病毒感染的细胞免疫反应,这种现象被称为病毒模仿。
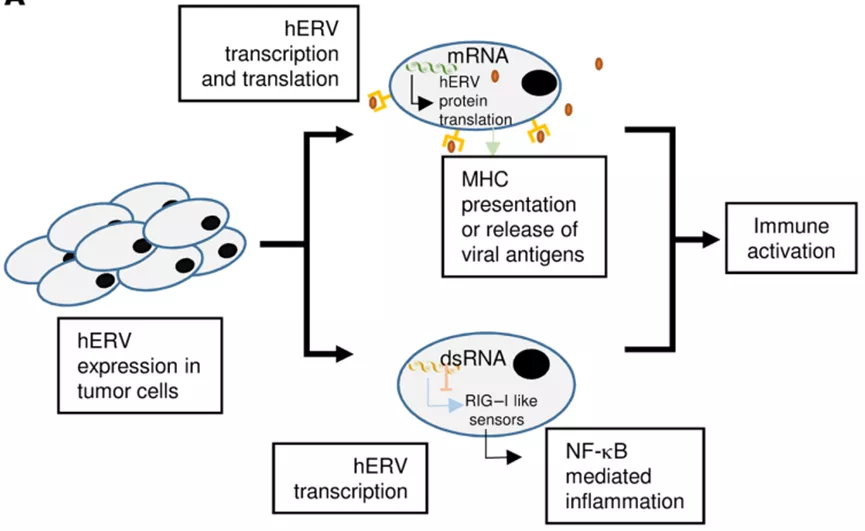
一些研究表明,HERV可能有助于介导免疫治疗后的肿瘤消退。一名转移性肾细胞癌(RCC)患者在造血干细胞移植后肿瘤完全消退,发现循环供体T细胞能够识别HERV-E衍生肽。此外,在免疫检查点抑制剂治疗的转移性RCC患者中,应答患者的hERV的表达明显高于无应答者。
虽然癌症细胞表达,但是正常组织中也表达HERV,所以只有有限的几项相关临床研究 (NCT03354390,HERV-E TCR Transduced Autologous T Cells in People With Metastatic Clear Cell Renal Cell Carcinoma)
3.组织分化抗原(TDAs)
编码组织分化抗原(tissue differentiation antigens,TDAs)的基因,表达仅限于肿瘤和肿瘤来源的组织。例如,MART-1和gp100,首次发现都是在黑色素瘤,但后来被发现在皮肤、内耳和眼睛的正常黑色素细胞也有表达。
许多临床研究试图用基于TDA的疫苗治疗癌症患者,但在绝大多数病例中未能提供有意义的临床受益。sipuleucel-T(针对前列腺酸性磷酸酶,一种前列腺TDAs)是其中结果最好的,导致无症状总生存期适度延长,获得FDA批准。然而,由于没有客观的肿瘤消退,甚至没有特定的肿瘤标志物的显著减少,因而这种疗法未被广泛使用。

靶向TDAs的细胞治疗,有影响正常组织的显著毒性风险。例如,在一项对36例转移性黑色素瘤患者的研究中,用高亲和力TCR靶向MART-1和gp100,分别导致30%和19%的患者的癌症消退。然而,它也会导致正常黑色素细胞的破坏,从而导致白癜风和严重的眼部和听觉症状,需要使用高剂量的局部类固醇治疗。
4.过表达肿瘤抗原
这些抗原是正常基因的产物,在正常组织中表达,并在某些类型的癌症中过表达;例如,卵巢癌和乳腺癌中的HER2和癌胚抗原(CEA)。此类抗原缺乏肿瘤特异性。HER2的开发以抗体药物为主(单抗、双抗、ADC药物)。
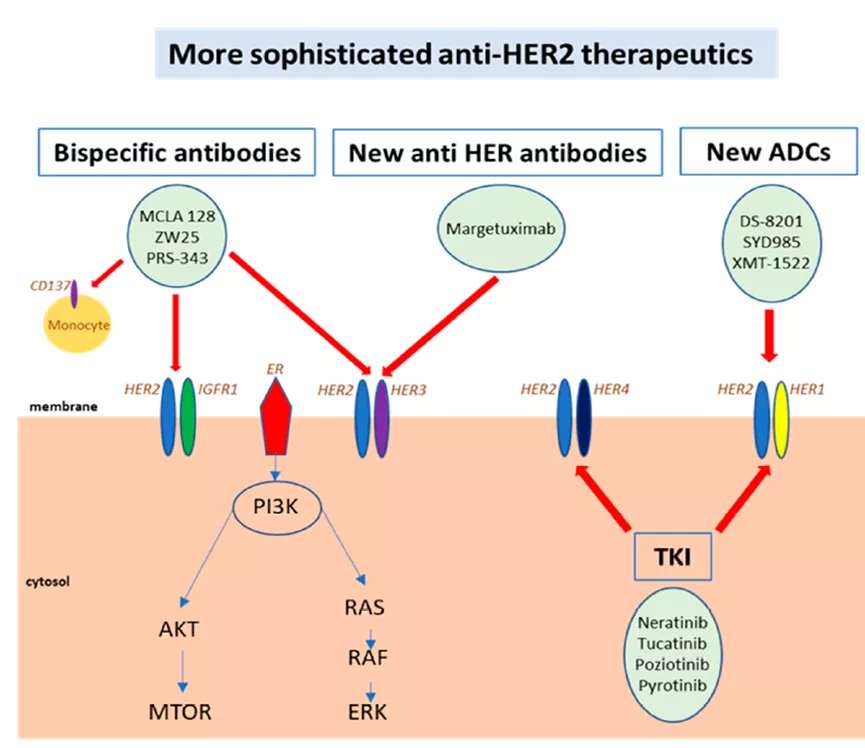
过继细胞转移疗法,会产生明显的off tumor的毒性。例如,在一项涉及3例结直肠癌患者的研究中,对CEA具有高亲和力TCR-T细胞导致了1例患者的客观癌症消退,但在所有3例病例中都导致了正常结肠黏膜严重的不可逆破坏。
5.错义单核苷酸变异(mSNVs)新生抗原
错义单核苷酸变异(mSNVs)是不同类型实体肿瘤的主要突变形式,可导致细胞蛋白在其序列中存在单一氨基酸变异,如果这种变异使得多肽获得与MHC分子结合的特性,则这些蛋白可能获得了免疫原性,可以被TCR识别。
免疫原性mSNV只代表所有癌症突变的一小部分,可以在大多数不同类型的癌症患者中检测到,包括那些总体突变负荷较低的患者(如大多数胃肠道肿瘤)。MUM1、CDK4和CTNNB1是最早通过从cDNA筛选的方法从转移性黑色素瘤患者发现的mSNV驱动的肿瘤新生抗原。
一名错配修复熟练的转移性结肠癌患者接受了自体TIL产品的治疗,该产品包含约75%的CD8+细胞,识别来自KRAS基因热点(G12D)突变的新生抗原。这导致了所有转移性肺病变开始消退。其中一个在9个月后进展,随后被切除,使患者无疾病生存。
靶向mSNV来源的新生抗原T细胞,可以介导持久的肿瘤消退,而不会对正常组织造成任何毒性。然而,需要注意的是,大多数接受治疗的患者(尤其胃肠道癌症患者),仍然对这种治疗没有反应。
6.插入和删除突变(INDELs)新生抗原
根据受影响的碱基对数量,核苷酸插入和缺失(insertion and deletions ,INDELs)可能导致蛋白质形成一个或多个氨基酸的获得或丢失(非移码INDELs)。或者,它们可能会产生具有移码序列的蛋白质,这些序列通常由于过早的终止密码子(移码INDELs[fsINDELs])而被截断。
一些研究表明INDEL衍生的肽可以具有免疫原性。例如,TGFBRII是一种移码缺失,在结直肠癌中经常失活,产生被CD8+和CD4+细胞识别的多肽。此外,一名转移性黑色素瘤患者对TILs治疗,产生完全缓解,分析显示,存在一个CD8+T细胞克隆,识别了肿瘤抑制因子CDKN2A移码缺失的产物。
总的来说,INDEL在癌症中的发病率低于mSNV,在所有非同义突变中占比约为5%,RCC例外,约为12%。据预测,fsINDELs产生的高亲和力MHC结合物数量至少是mSNVs的三倍
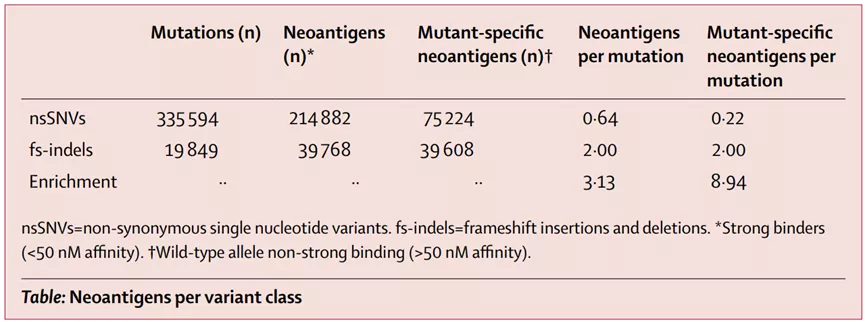
7.基因融合新生抗原
基因融合可以通过大规模的基因组重排(如染色体易位、缺失或染色体倒置)而产生,它可能产生癌症特有的融合蛋白,可以被患者的T细胞识别,比如慢性粒细胞白血病患者9和22号染色体易位导致的融合蛋白BCR-ABL,滑膜细胞肉瘤患者的症状X:18易位引起的SYT-SSX1融合,头颈部癌症DEK-AFF2基因融合的肽,腺样囊性癌(ACC) MYBNFIB基因融合。
不同类型实体肿瘤的总体基因融合负荷明显低于总SNV负荷,但预计基因融合会产生更多的潜在新抗原。但是有研究显示,融合新抗原负荷不能预测对转移性黑色素瘤患者使用ICIs的获益之间的相关性。
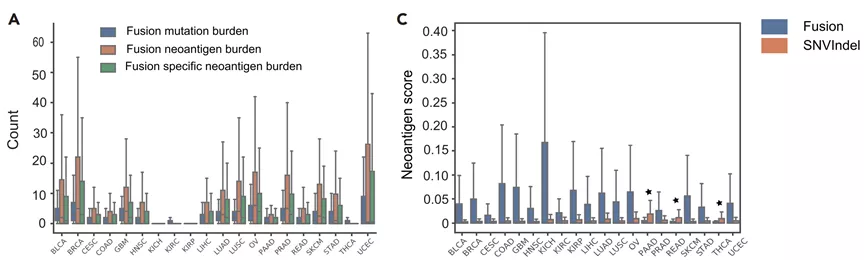
通过免疫治疗靶向融合新抗原的尝试仅限于一些基于疫苗的方法,但是缺乏积极的临床结果。虽然绝大多数的基因融合是遗传不稳定的副产品,没有已知的功能,但也有一些产生的融合蛋白在患者之间共享,作为致癌基因发挥作用,是有价值的免疫治疗靶点。包括甲状腺癌中的CCDC6-RET和前列腺癌中的TMPRSS2-ERG,或FGFR3-TACC3,占各类癌症患者的1%-2%。
8.病毒癌蛋白抗原
实体癌症一部分是病毒感染的结果,其中病毒基因整合到细胞基因组中,导致具有致癌特性的病毒蛋白表达。例如,E6和E7癌蛋白的表达是人类乳头瘤病毒(HPV病毒)感染,驱动头颈部、宫颈癌和肛门癌的进化。同时,从这些“外来”蛋白质中提取的多肽可以被患者的T细胞识别。默克尔细胞多瘤病毒(MCPyV)感染引起的默克尔细胞癌, EBV感染引起的鼻咽癌。一般来说,由于病毒抗原与正常细胞蛋白显著不同,因此能够引起高亲和力的TCR反应。
一些细胞治疗和疫苗的临床试验在开展,并且产生了包括肿瘤消退在内的反应,并且对于正常组织没有明显毒性,所以对于肿瘤治疗是有吸引力的靶点。
9.异常mRNA剪接相关肿瘤抗原
肿瘤中异常的mRNA剪接可导致内含子的保留。随后,保留内含子序列可以被翻译,并产生多肽,与MHC分子结合,并被T细胞识别。
利用cDNA文库筛选方法,已经鉴定出了几种这样的内含子抗原,包括黑色素瘤中MUM-1基因的外显子-内含子连接编码多肽。在这里,内含子保留本身并不是肿瘤特异性的,但内含子包含一个肿瘤特异性突变,使其成为真正的新生抗原。在另一个来自黑色素瘤患者的例子中,T细胞识别出了一种由gp100基因中保留内含子编码多肽。然而,该内含子没有发生突变,并在正常的黑色素细胞中发现了相似的表达水平。保留内含子增加了新生肿瘤抗原的检测数量,但是否能够成为肿瘤特异性的新生抗原,需要进行大量的比较研究。有研究显示,同SNVs相比,保留内含子的突变与临床获益相关性不大。
肿瘤中异常的RNA剪接也可能导致新的外显子-外显子连接(EEJs)的形成,这可能导致免疫原性蛋白/肽。在一项比较肿瘤WES和RNA测序数据的研究中,一部分新的EEJs仅在癌细胞中检测到,而在相应的正常组织中没有检测到,一些EEJs在不同类型的癌症中反复检测到。
10.异常RNA翻译衍生肿瘤抗原
这些抗原也被称为隐藏抗原,要么通过替代开放阅读框(aORF)翻译的蛋白质,要么通过原本推测为非编码序列翻译而来。
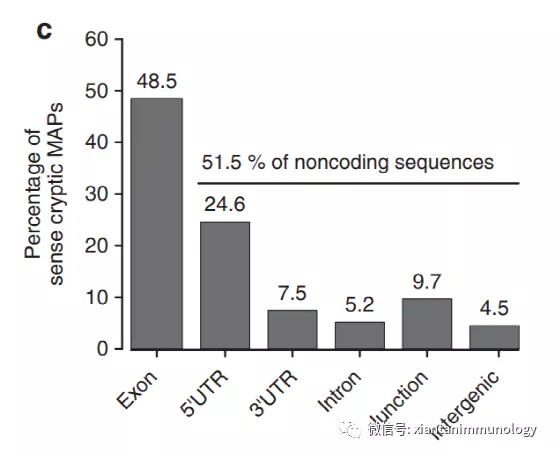
与其他非常规抗原一样,隐藏抗原既可以是肿瘤相关的,也可以是肿瘤特异性的。第一个被鉴定的是gp75基因aORF中编码的多肽。该基因被发现在两个重叠的ORF中被翻译,从而形成两个完全不同的蛋白质。这些蛋白中只有一种产生了免疫原性肽,被TILs识别,介导转移性黑色素瘤患者的客观肿瘤消退。
11.翻译后修饰衍生肿瘤抗原
细胞蛋白或多肽的翻译后修饰是产生肿瘤抗原的另外一个途径,包括一类融合肽(由蛋白酶体剪接两个单独的肽片段),来自相同的蛋白质(顺式剪接)或来自不同的蛋白质(反式剪接)。第一个被鉴定的抗原是通过连接两个肽片段(一个5-和一个4-mer)获得的肽,这些片段在FGF5编码的亲本蛋白中被40个氨基酸分割,随后发现了其他蛋白质中剪接的免疫原性肽,包括gp100、SP110和酪氨酸酶。
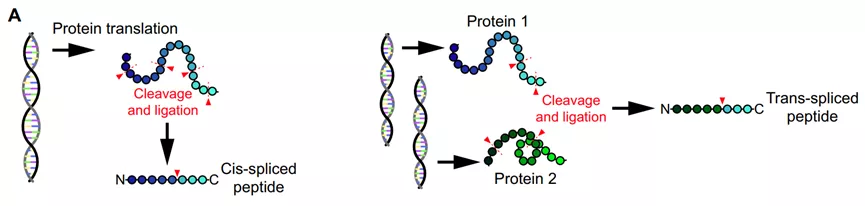
另一类翻译后修饰的肿瘤抗原包括经历酶促氨基酸修饰的蛋白质,如磷酸化、乙酰化、瓜氨酸化、糖基化或脱酰胺化,可以被患者的免疫细胞识别。
酶修饰的肿瘤抗原最丰富的是磷酸化蛋白,是癌症中激酶介导的信号通路失调的结果,已经成功地从癌症组织和癌细胞系的表面MHC分子中洗脱获得。他们可以被循环CD4+T细胞识别,是免疫治疗的有吸引力的靶点。
参考资料
