【8.1.3】新抗原预测和建议--ESMO
新一代测序技术的使用使得能够快速识别癌细胞中的非同义体细胞突变。新抗原是源自正常组织中不存在的体细胞突变的突变肽,可能导致出现能够引发抗肿瘤 T 细胞反应的肿瘤特异性肽。基于新抗原的个性化癌症疫苗和过继性 T 细胞疗法已被证明可以激发宿主对肿瘤细胞的免疫力,并且正在进行临床试验开发。然而,需要优化和标准化新抗原鉴定及其作为免疫疗法的递送,以增加肿瘤特异性 T 细胞反应,从而提高当前癌症免疫疗法的临床疗效。
欧洲肿瘤内科学会 (ESMO) 转化研究和精准医学工作组(TR 和 PM WG)启动了一个合作项目,特别是在新抗原预测的框架内,对当前科学证据的分析和关于
- 与新抗原和免疫原性概念相关的最重要定义;
- 目前用于新抗原预测的计算方法以及体外方法在鉴定配体组和 T 细胞反应性方面的作用;
- 该领域的开放挑战以及这些知识将如何推动精准免疫疗法的进步。
一、免疫原性和新抗原景观 Immunogenicity and neoantigen landscape
免疫原性是与 MHC 分子结合的肽诱导适应性免疫反应的能力。被 CD8 + T 细胞识别的新抗原源自体细胞突变,这些突变导致 MHC-I 分子在肿瘤细胞表面呈递的新型肽的产生。此外,专职抗原呈递细胞 (APC) 可以呈递源自与其 MHC-II 分子结合的胞外蛋白的突变肽。
在这里,我们将新抗原景观称为肿瘤内准确识别的真正新抗原的集合。肿瘤中大多数已鉴定的突变肽不被 T 细胞识别(即不具有免疫原性)。原因可能是并非所有可能表达的突变肽都会被 MHC 分子加工并呈递到细胞表面,也不是所有 MHC 呈递的肽都会诱导 T 细胞反应性并充当免疫原性 T 细胞表位。T 细胞对所有预测的新抗原的反应可能受到免疫优势的限制,在该过程中,T 细胞反应性仅受对一小部分潜在表位的反应支配。因此,从测序数据中预测哪些非同义体细胞突变代表真正的新抗原或筛选方法[综述于 Garcia-Garijo、Fajardo 和 Gros (2019)49] 是一项重大挑战。
免疫原性取决于几个因素,包括:
- 肽-MHC 复合物的稳定性和结合亲和力
- 肽对 MHC 结合的竞争
- T 细胞受体 (TCR) 库的多样性、
- CD8 + TCR 识别肽-的倾向HLA 复合体和新抗原外源性
- 此外,蛋白质表达、翻译后修饰、抗原加工和转运也起着重要作用。
1.1 产生新抗原的突变
最常研究的一类新抗原是那些源自体细胞非同义单核苷酸变体 (SNV) 的新抗原,根据定义,它们不存在于匹配的正常组织中。然而,源自 SNV 的新抗原与其未突变的对应物并无太大不同。因此,这些候选新抗原中只有少数可能具有免疫原性。在具有高 TMB 的癌症中,例如黑色素瘤和肺癌,SNV 衍生的新抗原特别相关。
除了 SNV 衍生的新抗原外,最近还发现了由非 SNV 基因组原因引起的高特异性肿瘤抗原。这些包括源自突变移码、剪接变体、基因融合、内源性逆转录元件和其他肿瘤特异性过程的新抗原。与 SNV 相比,这些突变类型有可能以更显着的方式改变蛋白质序列,并可能产生更具免疫原性的新抗原。
突变移码是核苷酸的插入或缺失,会改变蛋白质的阅读框。在许多情况下,改变的阅读框会产生新的肽,这些肽的长度足以被 T 细胞识别。事实上,突变移码预计每次突变产生的新抗原比 SNV 多 9 倍。移码新抗原与微卫星不稳定性高的肿瘤和肾细胞癌特别相关,这两者都与突变插入和删除的高负担有关。这种改变可能会产生全新的转录本,没有野生型、“正常”等同物,因此可能具有特别的免疫原性,因此代表了免疫疗法的理想候选者。
剪接变体可能由剪接位点突变(例如MET外显子 14 跳跃)或剪接因子(例如SF3B1、U2AF1)、内含子保留和各种其他转录后修饰引起。有人提出,剪接位点的突变产生的预测新抗原比错义 SNV 多 2.5 倍。剪接变体衍生的新抗原可能与突变很少但含有剪接因子突变的癌症类型特别相关,例如白血病和淋巴瘤。
基因融合是免疫原性新抗原的来源,可以介导对免疫疗法的反应。尽管肿瘤中的突变负荷低且治疗前免疫浸润最小,但转移性头颈癌的异常反应者对免疫检查点抑制剂治疗产生了完全反应。一种新的基因融合 ( DEK – AFF2 ) 被鉴定并证明可以产生一种新抗原,这种新抗原可以特异性地引发宿主细胞毒性 T 细胞反应。这些发现为其他低突变负荷癌症和/或融合驱动的癌症铺平了道路,包括慢性粒细胞白血病中的BCR- ABL 、前列腺癌中的TMPRSS2-ERG 、尤文氏肉瘤中的EWS-FLI1和肺腺癌中的EML4-ALK ,以免疫原性有待进一步研究。INTEGRATE-neo 和 NeoFuse 等计算工具可以根据肿瘤 RNA 测序数据预测推定的融合抗原。
与目前用于个性化癌症疫苗的 SNV 新抗原很少在患者之间共享不同,多个癌症患者中常见的几个热点突变和一些非 SNV 衍生的新抗原(融合和移码)可能具有多种肿瘤共有的优势,并且 患有特定癌症类型的患者。。例如,KRAS G12D 驱动突变已被证明在 HLA-C*08:02 基因型的背景下具有免疫原性。
然而,对于大多数实体瘤,可能没有可预测反应患者的复发性新抗原肽序列。例如,在一组 10 名转移性胃肠道癌患者中,这些患者之间没有共享的免疫原性表位,强调开发通用疫苗的挑战。相比之下,对 10 186 份癌症基因组图谱( TCGA ) 肿瘤样本的分析描述了常见新抗原的来源,这些新抗原源自多种癌症中存在的移码突变。然而,这些新抗原是否会引起 T 细胞或临床反应迄今尚未得到证实。
新抗原的一小部分但相关的子集是由致癌驱动突变产生的。从推定的致癌驱动物靶向新抗原的优势在于它们通常是克隆的(即存在于所有癌细胞中)并且降低它们的表达对肿瘤是不利的。免疫系统可能会负面选择具有抗原性遗传改变的肿瘤克隆。事实上,MHC-I和 MHC-II 往往不能很好地呈现致癌驱动因素。此外,针对单个驱动突变可能会促进选择具有替代驱动改变的抗性亚克隆。先前在小鼠模型和人类肿瘤中的研究表明,当暴露于 T 细胞压力时,T 细胞识别的新抗原可能会从肿瘤细胞群中丢失。然而,识别这些共享新抗原的好处是它们可以用于现成的免疫疗法。
1.2 新抗原的克隆性和肿瘤异质性 Clonality of neoantigens and tumour heterogeneity
肿瘤异质性和克隆和亚克隆(即估计仅由一些肿瘤细胞表达)新抗原的分布可能影响它们对免疫治疗反应的预测作用以及与免疫逃避机制的相关性。
新抗原的克隆性似乎有助于从免疫检查点抑制剂(即 PD-1/PD-L1 阻断剂)中获得持久的益处。最近的研究表明,当仅关注在接受抗 PD-1 治疗的肺癌患者中肿瘤克隆表达的预测新抗原时,由 T 细胞表位的计算机预测确定的新抗原负荷的预测值得到改善治疗。此外,在少数患者中观察到针对克隆突变而非亚克隆抗原的新抗原特异性 T 细胞反应。高克隆性新抗原负荷与发炎的肿瘤微环境有关。与此相一致的是,最近对 249 名接受免疫检查点治疗的患者进行的分析发现,肿瘤表现出大量亚克隆突变 (>50%) 的患者不太可能从治疗中获益。因此,尚不清楚亚克隆新抗原是否代表预后不良的标志,或者克隆新抗原是否只是引发更有效的免疫反应。
与克隆新抗原的重要性一致,最近的一项研究使用黑色素瘤同源小鼠模型和患者数据来研究肿瘤内异质性对免疫反应的影响。这项研究表明,癌症新抗原的高度肿瘤内异质性会导致免疫逃避和对检查点抑制剂的耐药性,这表明需要量化肿瘤内异质性以改善患者对这些疗法的选择。 播散性致死性乳腺癌患者的多区域转移证明大多数预测的新抗原起源于每个患者的转移共享的突变,只有少数是个体转移私有的(或独特的)或来自驱动基因。就新抗原的耗竭而言,免疫选择在转移灶中几乎看不到,这表明在晚期乳腺癌中,大多数转移灶处于免疫编辑的逃逸期
二、新抗原的鉴定和选择
随着新一代测序 (NGS) 技术的进步,识别个体肿瘤外显子组中存在的基因突变变得可行。一旦识别出这些突变,就可以预测编码的突变肽与患者 HLA 等位基因的结合亲和力,从而预测潜在的新抗原。这一发展使新抗原发现管道的实施成为可能(图 1)
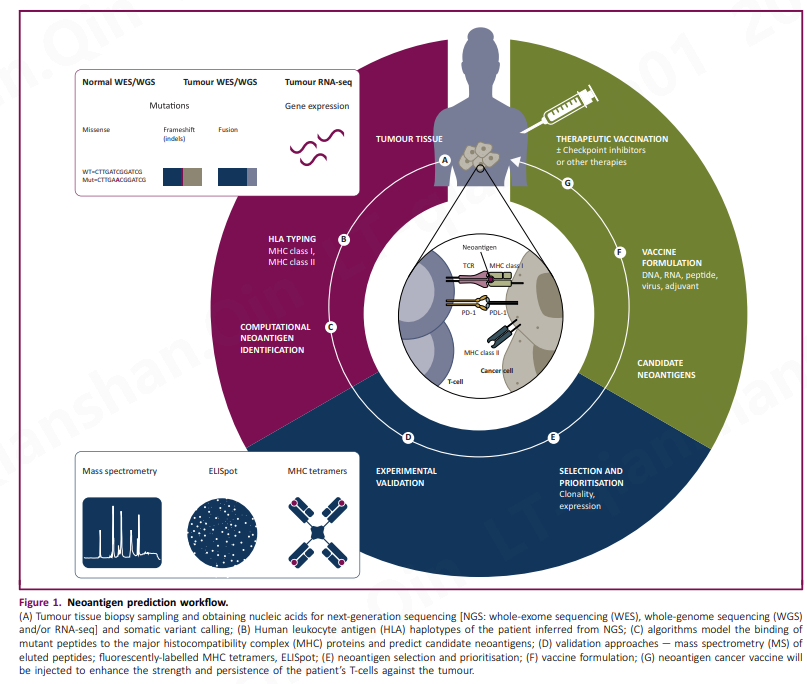
当前用于从体细胞突变预测候选新抗原的生物信息学管道共享四个主要计算模块:
- 来自肿瘤 RNA-seq、全基因组(WGS)或全外显子组测序(WES)数据的 HLA 分型;
- 由一组体细胞突变引起的突变肽的推断;
- HLA 结合和抗原呈递的预测;
- 候选新抗原的优先排序和选择。
正在积极完善生物信息学管道,以改进新抗原的识别和选择。在本节中,我们将讨论四个模块中每个模块所涉及的生物信息学工具。
2.1 HLA分型
将呈递以供 T 细胞识别的肿瘤新抗原库取决于患者的 HLA 等位基因。因此,新抗原预测的第一个关键步骤涉及确定患者的 HLA 基因型。现在有几种计算工具可以使用 NGS 数据来完成这项任务。这些工具的不同之处在于它们用作输入的数据类型、它们预测的 HLA 分子类型(I 类和/或 II 类)以及它们可以提供的 HLA 分辨率(补充表 S1,可在 Annals of Oncology获取在线的)。
大多数方法使用 DNA 衍生的 NGS 数据,WES 或 WGS。光学类型和聚溶剂仅识别 I 类 HLA 等位基因,而其他方法包括 ArcasHLA,seq2HLA,Athlates 可以识别 I 类和 II 类 HLA 的等位基因(补充表 S1,可在Annals of Oncology在线获取)。RNA-seq 数据也可用于分型 HLA 等位基因。Optitype 报告说,与从 RNA-seq 数据获得的结果相比,从 WES 获得的 HLA 分型显示出更好的结果
2.2 由一组体细胞突变引起的突变肽的推断
目前从 NGS 数据中识别候选新抗原的过程通常始于使用肿瘤和正常 DNA 的 WES 绘制肿瘤特异性遗传畸变的图谱(图 1 )。此外,RNA-seq NGS 数据可以与 WES 整合,以确定突变基因是否在肿瘤中表达。RNA-seq 还可用于推断突变等位基因表达的相对频率(即等位基因特异性表达),并告知可变剪接事件的存在。
2.3 HLA 结合和抗原呈递的预测
MHC 结合预测
已经开发了几种计算方法来识别基于 MHC I 类和 II 类处理和呈递的 T 细胞新抗原。最先进的计算方法主要依赖机器学习 (ML) 算法,包括线性回归 (LR) 和人工神经网络 (ANN),在 HLA 结合肽的大型实验数据集上训练(补充表 S2 ,可用在在线肿瘤学年鉴)。尽管观察到 ANN 方法提供比 LR 更好的性能,但最近的基准研究表明,对于所有 HLA 等位基因,没有单一的最佳性能方法。此外,计算方法可以进一步分类为等位基因特异性或泛等位基因预测因子,这取决于它们为未包含在训练数据中的 MHC 等位基因提供预测的能力。由于没有可用于绝大多数已知人类等位基因的实验结合数据,因此泛等位基因预测因子可能代表更好的临床应用解决方案。
许多 MHC-I 等位基因特异性预测因子显示在补充表 S2中(可在Annals of Oncology在线获取)。感兴趣的是,NetMHCpan是一种针对 MHC-I 等位基因的“泛特异性”ML 方法,它将来自结合亲和力数据的信息与质谱 (MS) 肽组数据相结合。它结合了 HLA 等位基因之间序列/特征相似性的概念,以允许它根据它们与具有数据的 HLA 等位基因的相似程度来推断不存在训练数据的等位基因。与识别癌症新抗原的最先进方法相比,它显示出预测性能的提高。
与 I 类相比,预测 MHC-II 结合特异性更具挑战性。识别肽的长度和序列组成的较高可变性以及 MHC-II 二聚体本身的多样性通常被认为是计算预测性能较低的主要原因。预测肽与 MHC-II 等位基因结合的参考方法是 NetMHCII 和 NetMHCIIpan,分别是等位基因特异性和泛等位基因。
2.4 候选新抗原的优先排序和选择 Candidate neoantigen prioritisation and selection
候选新抗原的优先级排序通常基于预测的肽和 MHC 分子之间的结合亲和力,单独考虑或与其他特征结合考虑。蛋白酶体切割和肽转运到内质网等过程在新抗原呈递中发挥作用,但它们的建模在预测性能方面带来了边际收益。
具体的新抗原预测方法已被描述(补充表 S3,可在Annals of Oncology在线获取)。TIminer 是一个用户友好的计算框架,用于执行不同的肿瘤免疫基因组分析,包括从体细胞突变中预测新抗原。pVACtools 是一种通过癌症测序 (pVAC-Seq) 识别个性化变异抗原的计算工作流程,它整合了肿瘤突变和表达数据,并确定了在 DNA 载体中递送时候选新抗原的最佳顺序。它已被用于为新抗原研究预测新表位并确定其优先级9以及多项癌症疫苗临床试验(例如 NCT02348320 和 NCT03122106)。
Bulik-Sullivan 等人。建立了来自五种癌症类型的 74 名患者的人类肿瘤和邻近正常组织的 MS 和 RNA-seq 数据概要。使用这些数据,他们训练了一种 ML 方法来预测肽呈递的等位基因特异性概率。他们使用这些数据来训练肽呈递的 ML 预测因子,相对于仅根据 HLA 结合亲和力测定数据训练的模型获得更高的阳性预测值 (PPV) 性能。
另一个可以考虑用于新抗原优先排序的特征是预测的肽与哪个 HLA 等位基因结合。已发现 HLA 基因在癌症中发生显着突变。最近的研究表明,HLA 等位基因的拷贝数丢失在肺癌演变过程中普遍存在。因此,与多个 HLA 等位基因结合的推定新抗原可能是更有吸引力的靶标,应该优先考虑。HLA 分型后,可以使用 Polysolver 检测 HLA 基因的突变,在确定给定肿瘤中存在哪些等位基因时,可以使用生物信息学工具 LOHHLA(HLA 杂合性缺失)。通过 HLA 丢失而失去呈递新抗原的能力似乎是癌症中常见的免疫逃避机制。发现抵消这种情况的新方法将很重要,还应探索癌症疫苗与增加癌细胞中 MHC 表达的药物的组合
三、体外非计算方法的作用
体外非计算方法已被应用于鉴定配体组和/或新抗原反应性 T 细胞。
3.1 通过 MS 分析 HLA 结合肽
MS 分析直接调查由 I 类和 II 类 MHC 分子(即免疫肽组)显示的肽库,并且还具有验证计算机预测的能力。已经开发了几种方法来识别免疫肽组。最成熟的方法似乎是基于 MHC 分子的免疫沉淀、MHC 结合肽的提取和高压液相色谱结合 MS 的分析。MS 的主要局限之一是该技术只能检测细胞表面 MHC 分子所代表的总肽中相对较小的一部分,因此缺乏灵敏度。
3.2 基于 T 细胞的检测
MHC 呈递新抗原的最终预期效果是它们被 TCR 识别并激活 T 细胞。测量 T 细胞对肿瘤的反应程度需要基于细胞的检测,其优点是可以直接检测 MHC 呈递的新抗原是否已被患者的 T 细胞库识别。
多种评估新抗原特异性 T 细胞反应性的方法[例如直接识别 T 细胞识别的突变抗原、多色标记的 MHC 四聚体和酶联免疫吸附点 (ELISpot)] 或 T 细胞库分析(例如 ImmunoSEQ,GLIPH, TracerR,pRESTO) 已经报道。它们已被用于新抗原反应性 T 细胞的验证或筛选。特定 T 细胞的突变相关新抗原功能扩增 (MANAFEST) 测定被开发为监测抗肿瘤免疫的敏感平台。对 T 细胞识别和 TCR 分析的广泛讨论超出了这项工作的范围,并已在其他地方进行了审查。
这些基于细胞的实验耗时耗力,需要大量细胞,难以标准化,并且会影响疫苗设计的周转时间。因此,需要使用有关人类肿瘤的基因组信息来有效确定哪些表位可以被 CD4 +或 CD8 + T 细胞识别的高通量和无偏见的计算策略。由于缺乏可用的数据,该领域的发展受到限制。 铁汉 17:13:48
四、Neoantigen: towards clinical benefit
4.1 疫苗
临床疫苗略。。
4.2 过继性 T 细胞疗法
另一种针对新抗原的治疗方式是过继性 T 细胞疗法,因为癌症患者直接接受自身天然存在或基因改造的抗肿瘤 T 细胞治疗。过继性 T 细胞疗法包括过继转移 TIL 或经过基因工程改造以表达 TCR 或嵌合抗原受体 (CAR) 的 T 细胞
五、总结
目前,关于来自计算分析的候选新抗原的丰度和 TIL 中新抗原特异性 T 细胞的明显低频率存在差异。可以合理地认为,<3% 目前预测的新抗原会在肿瘤部位引起强烈的 T 细胞反应,而肽免疫原性差和免疫抑制性肿瘤微环境是造成这一观察到的差异的主要原因。有效抗肿瘤反应的 T 细胞库要求尚不清楚。我们对新抗原的免疫原性特征和肿瘤相关免疫抑制环境的了解还有很大的改进空间。用于鉴定作为有效 T 细胞靶标的计算预测的新抗原的功能测定将非常有助于在这些路径上取得进展。
ESMO 专家工作小组的建议:
-
HLA 呈递不是 T 细胞识别 。 大多数使用计算分析来推断新抗原的研究都依赖于 MHC 呈递和结合亲和力来预测免疫原性。仅使用这些方法可能不清楚哪些新抗原会引发免疫反应。此时,应采用其他策略(如 T 细胞反应性测定)来验证或补充作为癌症疫苗潜在靶标的新表位的鉴定,直到开发出准确的 T 细胞识别预测因子。
-
I类HLA分型的计算方法 。有一些方法可以始终如一地准确预测 I 类 HLA 分型:Polysolver and Optitype
-
新抗原预测管道 。许多管道可提供结合亲和力预测、突变肽注释、野生型和突变肽比较,以及新抗原过滤和根据各种标准(例如结合、克隆性、表达等)排序。大部分都是基于netMHCpan和IEDB进行结合预测。正在开发新的管道以解决高通量测序带来的挑战并预测免疫原性新表位。
-
新抗原优先排序 (Neoantigen prioritisation)。除了预测的肽结合亲和力外,新抗原优先排序还可以考虑几个特征,包括突变 VAF、基因表达、克隆性、差异聚集性指数、肽-MHC 稳定性、肽异源性、肽长度和结合多个 HLA 等位基因的能力。目前尚不清楚如何将这些特征最好地组合成最佳选择方案,需要进一步研究以便在合理的基础上建立最佳工具和阈值。
-
基于新抗原的抗癌疫苗在不同癌症类型中的临床益处。 尚未确定选择哪些癌症类型和亚型将从新抗原疫苗方法中获得最大益处。首次人体临床试验主要针对肿瘤具有高 TMB 的患者,例如黑色素瘤、但也有低 TMB,例如 GBM。在 TMB 较低的患者中,可以利用其他类型的新抗原,例如来自融合基因的新抗原。 初步研究表明,在新抗原靶标较少的肿瘤中,有可能通过疫苗产生有效的免疫反应。目前,有多种针对多种实体瘤的临床试验(表 1),单独测试治疗性癌症疫苗或与标准治疗、检查点抑制剂或新型研究药物相结合。此类试验在早期治愈或晚期/转移性疾病环境中进行。
-
基于新抗原的疫苗与其他免疫疗法的结合。 将癌症疫苗与检查点抑制剂结合使用可能会使冷的肿瘤变热,或将热的肿瘤变热,从而使免疫系统能够更好地将癌细胞识别为外来细胞,并释放出强烈的 T 细胞攻击。基于每个患者自身肿瘤突变构成的个性化新抗原疫苗应该指导那些抗肿瘤免疫系统反应。最近的证据表明,癌症疫苗和免疫检查点具有协同作用,可以以互补的方式进行管理。临床试验正在研究不同的设计,以及是否应在检查点抑制剂之前或之后同时给予疫苗。多臂临床试验应该会在不久的将来给出答案。
参考资料
Neoantigen prediction and computational perspectives towards clinical benefit recommendations from the ESMO Precision Medicine Working Group 。 https://www.annalsofoncology.org/article/S0923-7534(20)39824-0/fulltext
