【7.2】帕博利珠单抗(pembrolizumab)注射液(Keytruda)临床报告
默沙东(MSD)的PD-1药物 帕博利珠单抗(pembrolizumab)注射液(Keytruda)
十四、临床研究 CLINICAL STUDIES
14.1 黑素瘤 Melanoma
14.1.1 Ipilimumab-Naive Melanoma
伊匹单抗( Ipilimuma , 商品名Yervoy)
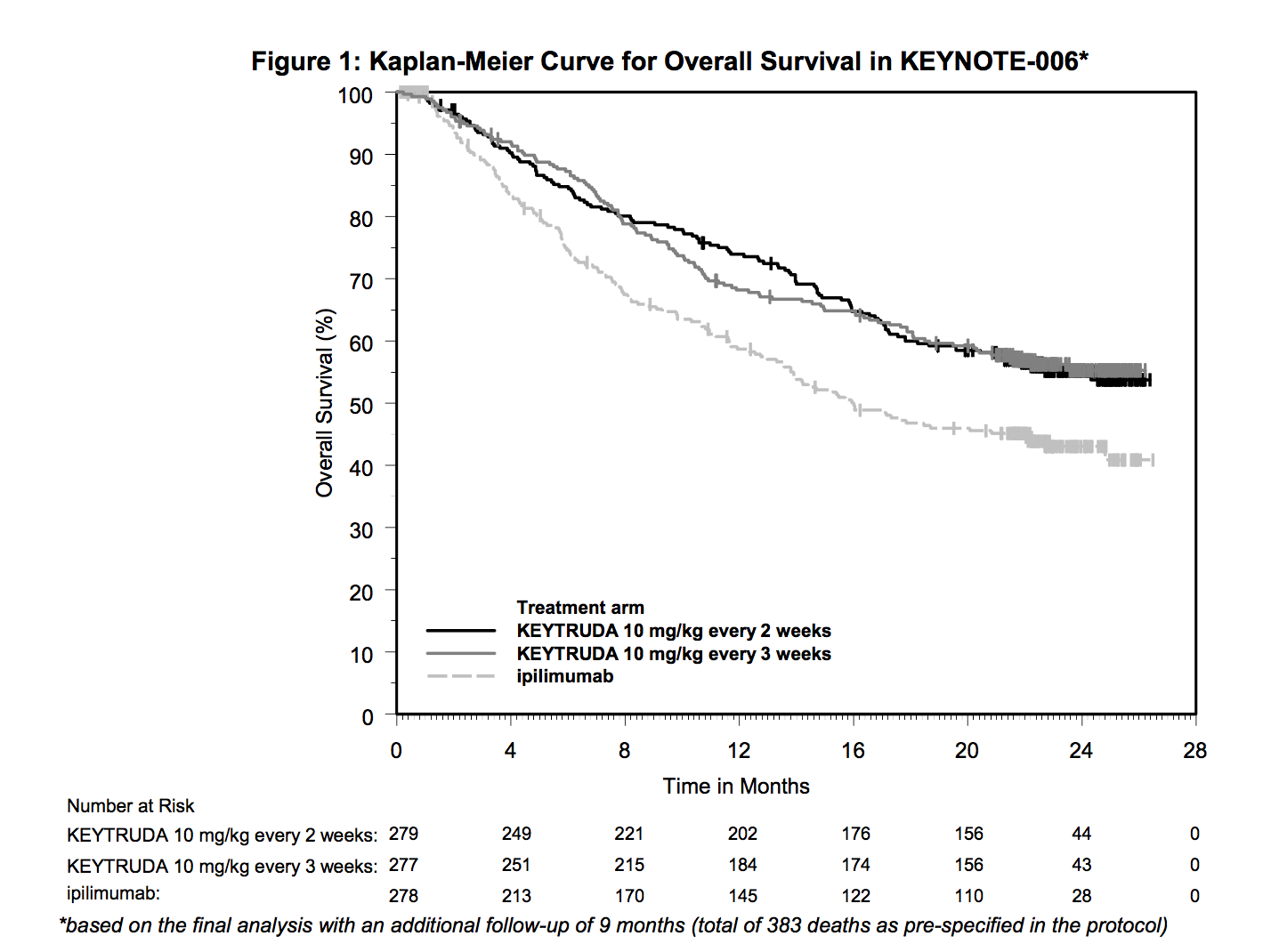
KEYTRUDA的安全性和有效性在研究KEYNOTE-006(NCT01866319)评估,该研究为随机(1:1:1),开放标签,多中心,主动对照试验。
患者随机接受KEYTRUDA,剂量为每2周10 mg / kg或每3周10 mg / kg静脉输注直至疾病进展或不可接受的毒性,或者每3周一次接受ipilimumab 3 mg / kg作为静脉输注 4剂,除非早期因疾病进展或不可接受的毒性而停药。疾病进展的患者可以接受额外剂量的治疗,除非疾病进展是有症状的,是快速进展的,需要紧急干预,发生性能状态下降,或者在重复成像后4至6周确诊。
随机化按治疗线(0对1),ECOG PS(0对1)和PD-L1表达(≥1%的肿瘤细胞[阳性]对<1%的肿瘤细胞[阴性])进行分层 根据仅研究用途(IUO)测定。关键资格标准是不可切除或转移性黑色素瘤; 没有先前的ipilimumab; 对于转移性黑素瘤,不超过一次的全身治疗。 患有BRAF V600E突变阳性黑素瘤的患者不需要接受先前的BRAF抑制剂治疗。 自身免疫性疾病患者; 需要免疫抑制的疾病; 以前对其他单克隆抗体的严重超敏反应; 和艾滋病毒,乙型肝炎或丙型肝炎感染,没有资格。肿瘤状态的评估在12周进行,然后每6周进行第48周,之后每12周进行一次。
主要疗效结果指标是总生存期(OS)和无进展生存期(PFS;使用盲法独立中心评价(BICR)评估,使用实体肿瘤中的反应评估标准[RECIST v1.1,修改为遵循最多10个目标 病变和每个器官最多5个目标病变])。 其他疗效结果指标是总体反应率(ORR)和反应持续时间。
共有834名患者被随机分组:
- 277名患者每3周一次服用10mg / kg KEYTRUDA
- 每2周服用279名KEYTRUDA 10mg / kg
- ipilimumab组服用278名患者。
研究人群特征为:中位年龄62岁(范围:18至89岁),60%男性,98%白人,66%没有先前的转移性疾病全身治疗,69%ECOG PS为0,80%患有PD -L1阳性黑素瘤,18%有PD-L1阴性黑素瘤,2%有未知的PD-L1状态使用IUO测定,65%有M1c期疾病,68%有正常LDH,36%有报告BRAF突变阳性黑素瘤 ,有9%有脑转移史。 在BRAF突变阳性黑色素瘤患者中,139例(46%)先前接受过BRAF抑制剂治疗。
该研究表明,与ipilimumab相比,随机分配到KEYTRUDA的患者的OS和PFS有统计学意义上的显着改善(表18和图1)。

在91名患者中,每3周随机分配到KEYTRUDA 10 mg / kg 有客观反应(objective response),反应持续时间为1.4+至8.1+个月。 在每2周随机分配到KEYTRUDA 10 mg /kg有客观反应(objective response)的94名患者中,反应持续时间为1.4+至8.2个月。
菜鸟疑惑
1.为什么这里会出现91 94 呢? 这两个数据可以不来自上面的表格么?

2.图下面的最后两列数据是什么意思? 这个数据不是上面的那张表的补充么?
14.1.2 Ipilimumab-Refractory Melanoma ( Ipilimumab难治疗的的黑素瘤)
KEYTRUDA的安全性和有效性在研究KEYNOTE-002(NCT01704287)中进行了评估,这是一项多中心,随机(1:1:1),主动对照试验。 患者随机接受两种剂量的KEYTRUDA中的一种,以盲法或研究者的选择化疗。
治疗组每3周静脉注射KEYTRUDA 2 mg / kg或10 mg / kg或研究者选择以下任何化疗方案:dacarbazine 1000 mg / m2静脉注射,每3周一次(26%),替莫唑胺200 mg / m2口服 每28天一次,每天一次,持续5天(25%),静脉注射卡铂AUC 6,每3周静脉注射紫杉醇225 mg / m2,共4个疗程,然后每3周注射卡铂AUC 5加紫杉醇175 mg / m2(25%),紫杉醇 每3周静脉注射175 mg / m2(16%),或每3周静脉注射卡铂AUC 5或6(8%)。
随机化按ECOG表现状态(0对1),LDH水平(正常与升高[≥110%ULN])和BRAF V600突变状态(野生型[WT]或V600E)分层。 该试验包括患有无法切除或转移性黑色素瘤并伴有疾病进展的患者; 对两种或多种剂量的ipilimumab(3 mg / kg或更高)无效,如果BRAF V600突变为阳性,则为BRAF或MEK抑制剂; 最后一剂ipilimumab后24周内的疾病进展
该试验排除了葡萄膜黑色素瘤和活动性脑转移患者。 患者接受KEYTRUDA直至不可接受的毒性; 有症状的疾病进展,快速进展,需要紧急干预,发生性能状态下降,或在重复成像后4至6周确诊; 撤回同意; 或医生决定停止对患者的治疗。
随机化后12周进行肿瘤状态评估,然后每6周至第48周进行一次,之后每12周进行一次。 对患有化疗进展的患者提供了KEYTRUD
主要疗效结果是无进展生存期(PFS),通过每个RECIST v1.1的BICR评估,修改为遵循最多10个目标病变和每个器官最多5个靶病变,以及总体存活(OS)。 其他疗效结果指标确认总体反应率(ORR)
。。。。
参考资料
https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/125514s035lbl.pdf
