【3.5.2】PD1相关
一、已上市的PD1
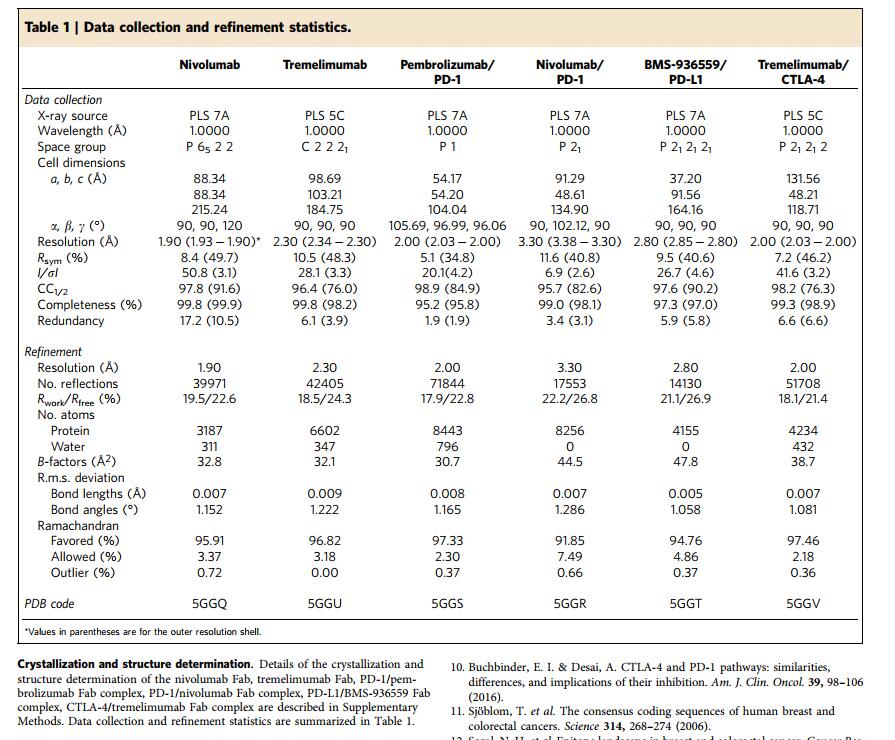
默沙东在起跑落后情况下的一系列“弯道超车”、三年半即在美国上市第一个PD-1抗体Keytruda
二、PD1的机理
现在常说的一种癌症免疫疗法,就是通过一些PD-1抑制剂活化T细胞,利用人体免疫系统自行治疗癌症,杀死癌细胞。PD-1(programmed death 1),称作程序性死亡受体1,是一种重要的免疫抑制分子,最初是从凋亡的小鼠T细胞杂交瘤得到的。以PD-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义,其配体PD-L1亦可作为靶点,相应的抗体、抑制剂也可以起到相同的作用。
而了解他们的作用机制,先得了解一下T细胞的激活机制。
T细胞的激活需要双重信号,即第一信号和第二信号:
- 第一信号来自MHC呈递抗原与TCR-CD3的结合
- 第二信号来自Ig家族配体受体的相互作用和TNF家族配体受体的相互作用。
第二信号分成共刺激信号和共抑制信号两类,分别行使正向、负向调节功能。经典的共刺激信号通路有B7.1/B7.2/B7H2-CD28、CD137L-CD137、CD70-CD27、CD40-CD40L;经典的共抑制信号通路有B7H1/B7DC-PD1、B7.1/B7.2/B7H2-CTLA4、HVEM-BTLA,本文讨论的就是B7H1/B7DC-PD1通路。
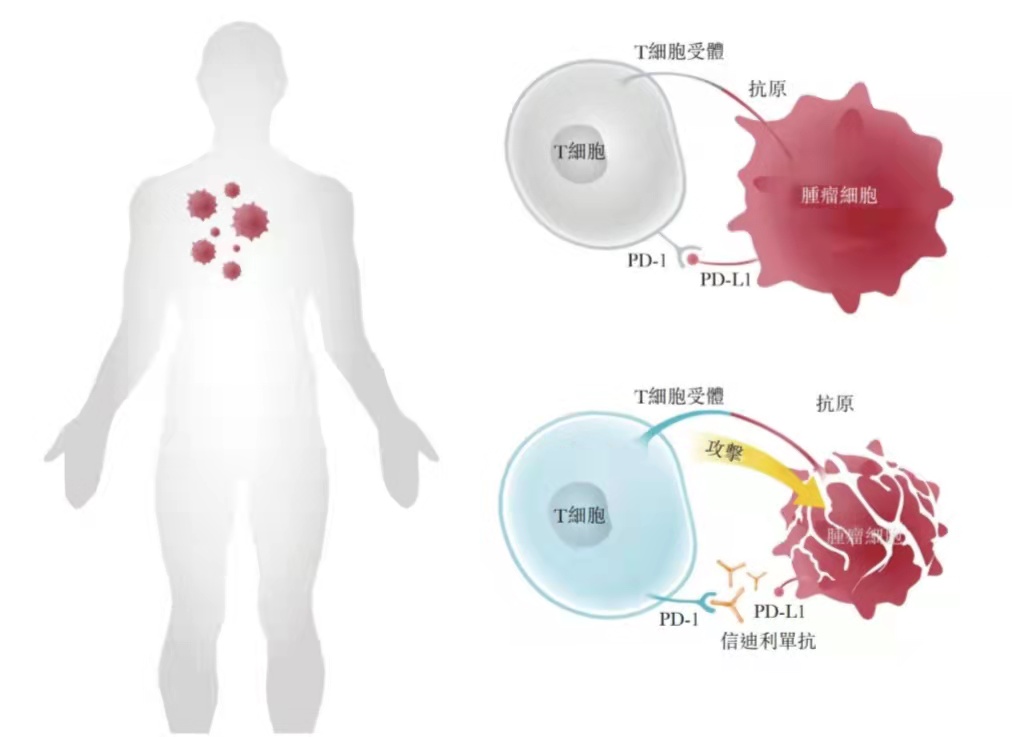
PD-1受体表达于T细胞表面和初级B细胞表面,在这些细胞的分化和凋亡中发挥作用。PD-1有两个配体,分别是PD-L1(B7-H1)和PD-L2(B7-DC) 。PD-L1蛋白广泛表达于活化T、B细胞和巨噬细胞。PD-L1与T细胞上的受体PD-1相互作用,会抑制T细胞的活化,引起T细胞凋亡,在免疫应答的负性调控方面发挥着重要作用。许多人类肿瘤组织中均可检测到PD-L1蛋白的表达,肿瘤部位的微环境可诱导肿瘤细胞上的PD-L1的表达,表达的PD-L1有利于肿瘤的发生和生长,诱导抗肿瘤T细胞的凋亡。
正常情况下,机体遇到外来病原体或抗原侵犯时,抗原呈递细胞(如巨噬细胞,树突状细胞等)捕获抗原,对抗原进行加工使之成为T细胞可以识别的抗原表位,与MHC分子结合并呈现于细胞外侧供T细胞识别。T细胞通过TCR与APCs的MHC分子结合,另外共刺激信号CD28受体与初始T细胞表面的B7.1(CD80)或B7.2(CD86)结合,T细胞接到正向调控信号,初始T细胞活化为效应T细胞,启动免疫应答。当有持续抗原刺激时,为了避免应答过度,活化T细胞表面表达PD1,与APCs细胞表面的PD-L1结合,向T细胞传递负向调控信号,T细胞增殖减少或凋亡。
但是在肿瘤组织中,需要刺激T细胞的免疫应答,PD1/PDL1通路抑制剂正好可以阻断PD1与 PDL1的结合,阻断负向调控信号,使T细胞恢复活性,从而增强免疫应答。而PD-1/PD-L1抑制剂就是目前肿瘤免疫治疗研究中最热门最受各家欢迎的对象。
关于CTLA-4 ,PD-1/PD-L1靶点的研究,揭开了癌症治疗的新时代,给无数的肿瘤患者带来了福音。
T细胞检查点阻断抑制剂:抗程序性死亡-1
程序性死亡-1 (PD-1) 是 T 细胞功能的负调节因子。阻断 PD-1 可以增加抗肿瘤 T 细胞免疫。
PD-1 是免疫球蛋白超家族的受体成员,在结构上与细胞毒性 T 淋巴细胞抗原 4 (CTLA-4) 和 CD28 相关,在活化的 T 和 B 细胞以及单核细胞上上调。与 PD-1 配体 (PD-1L) 结合可抑制 T 细胞增殖。 PD-1L 在 T 细胞和 B 细胞、巨噬细胞和 DC 以及实质细胞和肿瘤细胞上表达。
在小鼠中,PD-1 与耐受诱导有关,似乎可以“保护”它们免受 CTL 的免疫攻击。 PD-1 或 PD-L1 的阻断导致持久的肿瘤消退。在人类中,PD-1 的废除可以增加功能性细胞因子分泌 CTL 的数量,大概是通过增加增殖。在许多人类肿瘤上表达的 PD-L1 与 T 细胞浸润减少和预后较差有关。滨西等人。 (38) 表明,与那些表达很少或不表达 PD 配体的卵巢癌患者相比,肿瘤细胞上 PD-1L 水平较高的卵巢癌患者 T 细胞浸润较少,存活率较低。
PD-1L 通过免疫组织化学在食管癌、结肠癌、肺癌和卵巢癌以及黑色素瘤中表达。因此,这些肿瘤可能是抗 PD-1 初始测试的合适候选者,尤其是那些具有 T 细胞浸润的肿瘤。使用抗体阻断 PD-L1 是另一种可能有用的方法。然而,如果需要饱和所有肿瘤组织,靶向肿瘤可能比靶向 T 细胞更困难。
抗 PD-1 的预期用途是
- 与疫苗联合以增加活化 T 细胞的数量,
- 作为具有浸润性 T 细胞或新生或持续免疫反应的癌症的单一疗法
- 联合使用用抗 CTLA-4 治疗。
参考资料
-
Structural basis of checkpoint blockade by monoclonal antibodies in cancer immunotherapy
-
2008,Twelve immunotherapy drugs that could cure cancers 。 https://onlinelibrary.wiley.com/doi/10.1111/j.1600-065X.2008.00604.x
