【9.2.1】核酸的浓度、纯度的测定方法
核酸提取出来了之后,需要进行一个步骤——测浓度、纯度,实验室一般是使用的紫外分光光度法或荧光光度法来进行测定,下面对这核酸定量方法做一个整理。
一、紫外分光光度法
一般指紫外-可见分光光度法;是在190~800nm波长范围内测定物质的吸光度,用于鉴别、杂质检查和定量测定的方法。
紫外分光光度法原理 :单色光辐射穿过被测物质溶液时,在一定的浓度范围内被该物质吸收的量与该物质的浓度和液层的厚度(光路长度)成正比,因此通过光吸收的特点来对核酸进行定量。
核酸在波长260 nm处有最高吸收峰。吸收紫外光的性质是嘌呤环和嘧啶环的共轭双键系统所具有的,所以嘌呤和嘧啶以及一切含有它们的物质,不论是核苷、核苷酸或核酸都有吸收紫外光的特性。即在260nm的紫外波长下,1个吸光度值(A260nm=1)大约相当于50μg/ml的双链DNA、或相当于40μg/ml的单链DNA或RNA、或相当于33μg/ml的单链寡聚核苷酸,据此即可估算样品中核酸的浓度但紫外法不能区分DNA和RNA,只能用来鉴定核酸的纯度和含量。
蛋白质由于含有芳香氨基酸,因此也能吸收紫外光。通常蛋白质的吸收高峰在280nm波长处,在260nm处的吸收值公为核酸的十分之一或更低,故核酸样品中蛋白质含量较低时对核酸的紫外测定影响不大。
RNA的260nm与280nm吸收的比值在2.0以上;DNA 260nm与280nm吸收的比值则在1.8左右。当样品中蛋白质含量较高时比值即下降。
在TE缓冲液中,纯的DNA溶液260nm与280nm的比值应为1.8,纯的RNA溶液260nm与280nm的比值应为2.0,比值升高与降低均表示纯度不够。
260nm与280nm的比值是衡量蛋白质污染程度的一个良好指标,如果比值<1.8,说明有蛋白质污染或酚残留(酚的紫外吸收峰在270nm处,可用于区分蛋白质污染或酚污染)。如果比值>2.0,则可能是因为RNA的污染导致DNA制品260nm与280nm的比值升高。
需要注意的是,即使比值为1.8的DNA溶液也并不一定就是纯的DNA溶液,有可能同时存在蛋白质和RNA的污染,需要结合其他方法鉴定。
- A260nm :是核酸最高吸收峰的吸收波长,最佳测量值的范围为0.1至1.0。
- A280nm:蛋白最高吸收波长,比值可进行核酸样品纯度评估:纯的DNA的A260/A280比值为1.8,纯的RNA为2.0。如果比值低,表明存在蛋白或酚类物质的污染,需要纯化样品。
- A230nm :是碳水化合物最高吸收峰的吸收波长,比值可进行核酸样品纯度评估:纯的DNA和RNA的260/A230比值为2.0-2.5。若比值小于2.0标明样品被碳水化合物(糖类)、盐类或有机溶剂污染,需要纯化样品。
- A260/A280和A260/A230 :是核酸纯度的指示值。在pH7-8.5 下,A260/A280的比值,纯净的样品比值大于1.8(DNA)或者2.0(RNA)。如果比值低于1.8 或者2.0,表示存在蛋白质或者酚类物质的影响。A230表示样品中存在一些污染物,如碳水化合物、盐(胍盐)等,较纯净的核酸A260/A230的比值大于2.0 。
- A270nm:酚的最大吸收峰值。酚的残留会显著的增加230、260和280的数值,同时酚的吸收峰与核酸的吸收峰合并后,最大吸收峰向270方向偏移,胍盐对RNA样品吸收有显著影响,会在小于230nm处产生大的吸收峰。胍盐残留不会影响260和280的数值,对260/280的比值不会造成大的影响,当然也不影响RNA定量。但胍盐残留对260/230比值具有明显影响。
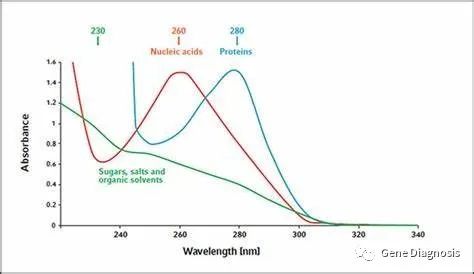
实验室最常用的NanoDrop就是基于以上原理;测试前选择正确的程序,测试样品的类型,首先测试空白液,然后再测试样品,注意输入样品稀释倍数。由于不同离子浓度,不同pH值都会对核酸的吸光值产生影响,导致检测误差。为了确保准确测量,要使用与悬浮或洗脱样品时相同的缓冲液。如建议实验10 mM Tris-HCl pH 8.0的缓冲液进行溶解测量。当测量RNA时,用水而不是用TE 缓冲液稀释RNA样品会造成A260/A280比值下降。原因是低离子强度和低pH溶液会增加280 nm处的光吸收值。当260/230<1时,只有两种情况。一是胍盐污染,二是蛋白污染。
二、荧光光度法
原理是利用荧光染料结合在DNA或RNA分子上发出荧光,再对荧光强度进行测定从而得到核酸的浓度。该方法的准确性比较高,而且因为DNA和RNA的检测分别使用不同的染料,因此能够区分样本中的不同分子,可以对DNA和RNA进行精准定量。
其检测过程需使用酶标仪或荧光计,以ThermoFisher的Qubit为例,测试过程中,需先使用标准品生成标准曲线,再对样本进行定量。大致过程为:将标准品和样本分别与检测工作液在专用反应管中混合后,室温孵育2min,再置于荧光计上读取数据。
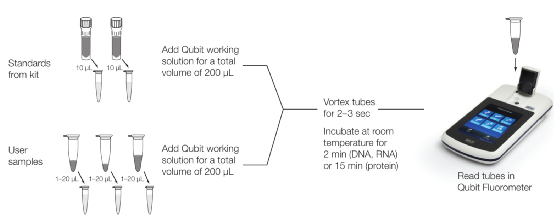
定量过程需要制作标准曲线,操作过程相对繁琐,样本定量浓度的准确性受标准品影响,不在定量范围内的过高或过低浓度样本,均无法定量。
荧光检测过程对环境因素较为敏感,易受温度、光度等干扰,同时需使用专用的耗材和试剂。
相比NanoDrop,Qubit的灵敏度和特异性均提高,可检测到pg级别。另外通过染料特异性结合,对dsDNA、ssDNA和RNA进行选择性区分测量,准确检测靶核酸分子浓度。
且从Qubit与NanoDrop的对比数据看,NanoDrop测量低浓度样本时,浓度偏差较大;在含有DNA和RNA的样品中,NanoDrop仅能测到总核酸量,而Qubit则可选择性区分定量DNA和RNA。
三、毛细管电泳方法
有些项目由于各种条件限制,抽提得到的RNA总量相应的也很少,有时无法使用Qubit定量,而使用Nanodrop定量的结果又不准确。这时候我们大多采用毛细管电泳,如安捷伦的Bioanalyzer 2100给出的浓度参考值。
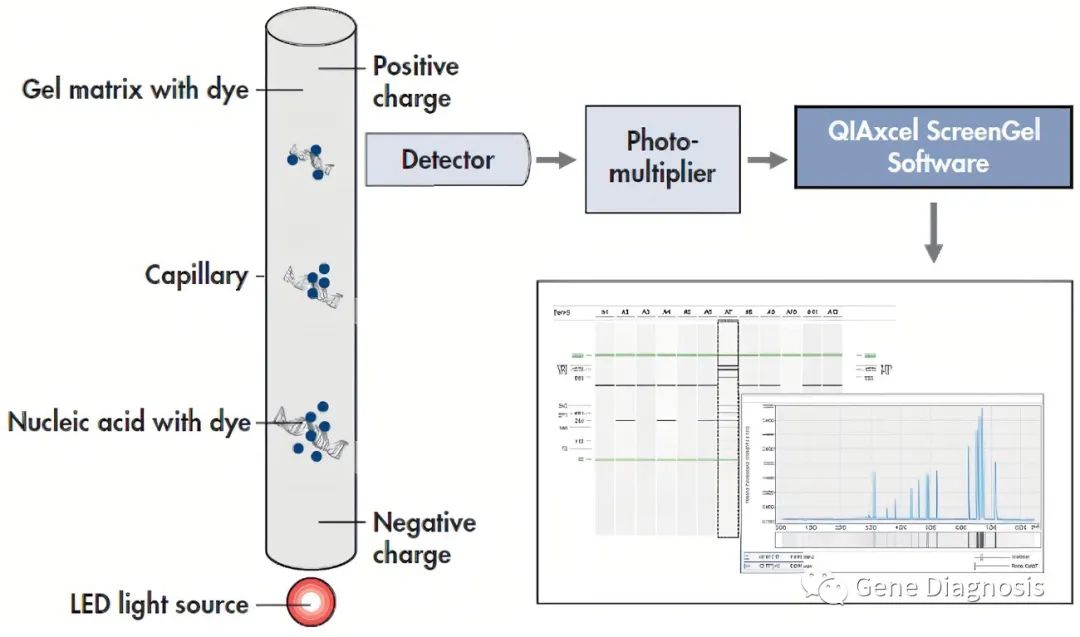
毛细管电泳对核酸进行定量是基于荧光光度法,它能够同时给出条带和浓度信息。利用已知片段大小的Ladder,生成迁移时间与片段大小的标准曲线,即可通过不同迁移时间来确定样品的片段大小。通过样品峰面积对已知浓度的Marker或Ladder面积的比值来对样品进行定量。如果样本浓度很低,检测系统给出的参考值的准确性也比较低。
四、定磷法
核酸是一类含磷化合物,磷酸基比例相对固定,其中RNA含磷量约为9.0%、DNA含磷量约为9.2%,因此通过定磷法确定磷含量后,便可推算出样品中的核酸含量。
(1)原理:核酸分子的有机磷在强酸条件下被消化为无机磷,进而与钼酸铵结合成黄色的磷钼酸铵络合物,该络合物在还原剂作用下立即转变为蓝色的钼蓝,在650~660nm波长处具有最大吸收值。在一定范围内,根据吸光值与磷含量的正比关系确定无机磷浓度,进而确定核酸浓度。该方法测定的核酸浓度范围一般为10~100ng/μL。
其优点是简单、快速;但易受蛋白与核苷酸的影响。
五、定糖法
(1)原理:核酸中的戊糖(核糖或脱氧核糖)在浓盐酸或浓硫酸作用下可脱水生成醛类化合物,该化合物进一步与某些成色剂反应形成有色化合物,在特定波长下具有相应吸收值,且在一定浓度范围内,溶液的吸收值与核酸浓度成正比,借此可对核酸进行定量。
该方法虽然灵敏,但是特异性较差,凡戊糖皆可反应,其他糖类及其衍生物、醛类和蛋白质等会干扰实验结果,操作过程较为繁琐,如今已较少采用。
六、荧光定量PCR法
通过在PCR反应体系中加入荧光染料或荧光探针,使得核酸扩增过程呈现出实时的荧光信号变化,且其扩增指数期对应的Ct值与起始模板浓度的对数存在线性反比关系,由此,结合已知浓度标准品建立的标准曲线,可对核酸进行定量。该方法是基于特异性的引物和探针来检测的,可用于确定靶核酸的拷贝数。可参考荧光定量PCR原理与各参数指标介绍;
七、数字PCR法
数字PCR是一种无需标准曲线的绝对定量方法,该方法将qPCR反应体系分隔在许多微小的反应单元中,然后进行PCR扩增,扩增后检测每个单元的信号为“有”或“无”,结泊松分布的原理进行统计,由此可直接计算靶核酸的数量。详细原理可参考数字PCR原理及对比;
参考资料
