【5.1】如何规范粪便移植
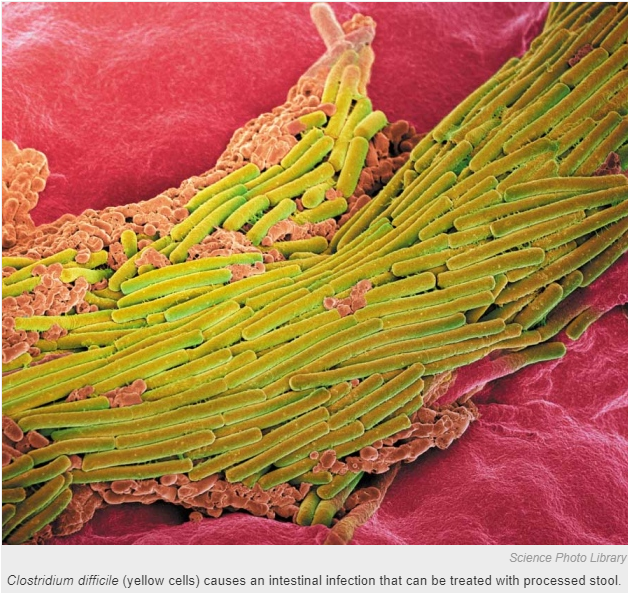
图1 艰难梭菌(黄色细胞)引起肠感染,可以用处理过的粪便治疗。
自第一个研究人类粪便医疗用途的随机对照试验出版以来,已经过去了一年多的时间。43名试验参与者反复出现艰难梭菌(Clostridium difficile )感染,导致危险,痛苦和持续性腹泻。对照组的患者仅接受抗生素治疗。试验组的那些患者接受了抗生素以及从过滤后的粪便中提取的液体,这些液体通过鼻管被输送到小肠上部。
这项小规模的试验被提前终止,因为粪便泥浆在解决症状方面的效率是单独使用抗生素的两倍以上。非随机研究从数百名复发性艰难梭菌感染患者中收集并采用相似程序治疗,其成功率通常约为90%(参考文献2)。
粪便微生物菌群移植(FMT,faecal microbiota transplantation )于1958年在科学文献中首次被描述为,它通过灌肠,结肠镜检查或其他方式将经过处理的粪便从健康个体运送到患病者的肠道。目的是通过重新建立健康的微生物群落,从肠道中清除病原微生物。在过去五年中,兴趣激增。同时,新的监管壁垒使FMT更加难以研究或实践。
2013年5月,美国食品药品监督管理局(FDA)发布了公开声明,称其已将人类粪便作为药物进行监管。此分类要求医生在执行FMT之前提交耗时的研究新药(IND)申请。FDA认为此要求将通过提供监督,标准化治疗并最终鼓励开发商业药品来使FMT更安全。
在当月由FDA和美国国立卫生研究院(NIH)主办的一次公开会议上,患者,医师和疾病控制与预防中心以及几个专业医学协会的代表对限制这些越来越普遍的患者获得医疗服务表示关注感染。六周后,FDA修改了立场。该机构暂时决定不对复发性艰难梭菌感染强制执行IND要求。
现在,这种富有同情心的例外使许多人能够获得急需的护理。但是,对于难辨梭状芽孢杆菌感染,FMT的长期状态尚未解决,监管政策使针对发炎性肠病或肥胖症等其他疾病的FMT探索研究变得复杂。
FMT的治疗潜力以及何时实现,将取决于FDA和其他机构如何调节粪便的使用。尽管将其视为药物对保护患者提出了严格的要求,但它限制了获得护理的机会。如FDA对血液所做的那样,将粪便重新分类为tissue product 或对其进行分类,将确保患者安全,确保广泛的访问范围并促进研究。
一、风险与收益
人类肠道微生物组已被描述为“虚拟器官” 。从炎症性肠病和肥胖症到哮喘和癌症的各种疾病都已与其组成有关,肠道细菌,具有生物活性的代谢产物和免疫系统之间存在关联。除了人类对FMT的研究证据之外,小鼠研究的实验证据表明,改变这种微生物生态系统会影响宿主的生理。
已经注册了六项以上的临床试验来研究FMT在炎症性肠病中的应用。但希望,操纵肠道微生物比其他治疗疾病艰难梭菌仍然投机。
很少有人类研究对患者进行前瞻性评估以评估FMT的不良结局。FMT后观察到短暂的腹部不适和腹胀,但几乎没有长期安全性数据。
此外,存在移植粪便微生物群可能传播艾滋病毒或肝炎等传染病的真实(尽管未实现)风险。在1970年代和1980年代,在引入严格的无偿献血法规之前,美国成千上万的血友病患者感染了受污染血液制品中的HIV。从理论上讲,FMT可能会改变微生物组,使人们更容易患肥胖或自身免疫性疾病等慢性疾病。(对于抗生素的使用也可以这样说,这也可能对微生物组造成未知,持久的干扰。)
强制性严格筛查可以减轻FMT的风险。但是,过于严格的规定可能会鼓励人们在医疗机构之外寻求治疗。可以自己动手进行粪便移植的说明。个人在YouTube上发布了具有数以万计的观看次数的视频,并撰写了书籍,提倡使用熟人或家庭成员的粪便进行家庭手术。有些人甚至向我们寻求有关使用宠物作为捐赠者的建议。一个FMT倡导网站上的一封公开信敦促医生认识到正在进行在家治疗,部分原因是医生没有提供这种治疗方法(请参阅go.nature.com/zrzbuk)。
当前的情况是监管不足和过度监管之一。FMT用于艰难梭菌感染的复发无需任何强制性筛查即可完成,而其他适应症的FMT在没有IND的情况下无法进行,这将使一些医学研究者望而却步。
FDA将药物部分定义为“旨在用于诊断,治愈,缓解,治疗或预防疾病的物品”。但是,粪便不同于常规药物,常规药物是在受控条件下使用一致的已知成分生产的。粪便是微生物,代谢物和人类细胞的可变,复杂的混合物。它不能以适用于常规药物的严格标准来表征。该材料也广泛可用-来自健康志愿者,而不是化工厂或受控细胞培养物。
FDA根据人体组织或类似的定制法规来调节血液,软骨,骨骼,皮肤和卵细胞。将这些产品移植到人中需要进行仔细的记录保存和筛查传染病。这些正是FMT应该采取的安全预防措施。根据美国现行法律,从体内排泄的产品或依赖非亲属的活细胞的产品均不属于此类,从而使粪便不合格。作为组织产品的精液和具有自己定制规则的血液也有例外。我们认为,应更改法规,以使粪便也可以作为组织而不是药物进行调节。通过严格的筛查可以降低风险,并且临床获益的潜力很大。
二、Stool banks 大便库
适当的监管将为通过类似于血库的粪便库提供经过仔细筛选和处理的材料铺平道路。FDA设定的严格安全要求将防止传染病,而强制性注册将跟踪不良事件。集中筛选和处理步骤将使治疗更便宜,更安全,变化更少,更方便。这也将减少对危险的家庭手术的需求。
作为这种方法的模型,我们(MBS和EJA)于2012年帮助成立了一家名为OpenBiome的粪便库,该库可提供艰难梭菌治疗的材料,目前已获得FDA的豁免。这个非营利组织的资金主要来自慈善捐款,但将来,这家和其他粪便银行可以通过医院的使用费来维持。在运营的前三个月中,OpenBiome向美国12家医院提供了100多种艰难梭菌治疗方法。至少有两家教学医院,包括波士顿的马萨诸塞州综合医院和乔治亚州的亚特兰大的埃默里大学医院,也为自己的患者开发了粪便库。
OpenBiome通过17种血液和粪便测定法筛选供体中的传染原;还评估了供体的慢性病,例如代谢综合征,自身免疫性疾病和消化系统疾病。每个捐赠者收集了许多样本,通常是几十个,从而将每次治疗的筛查成本降低至250美元,仅为一次性治疗成本的一小部分。样品经过均质,过滤和冷冻后可长期保存,为医生提供了标准化,方便的材料来源。可以轻松地缩放此模型,以满足艰难梭菌和其他疾病的临床试验对FMT的临床需求。
尽管诸如明尼苏达州罗斯维尔的Rebiotix和加利福尼亚州尔湾的Monarch Laboratories等一些公司希望将粪便衍生产品作为一种药物进行商业化,但这种分类威胁将FMT主要限制在拥有资源来资助大型临床试验的公司。粪便库将粪便作为组织分布,可以促进粪便进入,并允许对FMT的潜在临床用途进行更多调查。
有些疾病涉及肠道微生物组,但没有足够的证据证明需要进行FMT。为了阻止不当使用,组织库在释放艰难梭菌感染以外的其他疾病的材料之前,应获得诊所机构审查委员会的书面批准。
三、合成社区 Synthetic communities
在过去的十年中,我们对微生物组的了解已从鉴定物种转变为将疾病与疾病相关联。下一步是设计该系统以改善人体健康。按照目前的实践,FMT不使用细菌分离株的特定纯培养物。相反,它可以将未经鉴定的,处理最少的粪便带入患者体内。作为该领域的进展,我们期望微生物“活性成分”将被阐明,能够充分表征的培养物被用作第二代微生物疗法的。
从自然系统的移植中收集的知识可以为旨在治疗特定疾病的人工合成社区的设计提供信息。与粪便不同,这些衍生物将很容易作为药物进行调节,因为它们具有很高的特性,可连续生产的细菌混合物,并且不能从朋友处免费获得。诸如马萨诸塞州剑桥市的Seres Health和波士顿的Vedanta Biosciences等公司已经开始测试这种合成方法。
但是,使用合成社区的治疗尚需时日,并且越来越多的证据表明FMT现在可以有效治疗许多患者。将粪便作为人体组织进行调节可以立即帮助患者,并加快对精巧替代品的研究。
参考资料
- 2014 Policy: How to regulate faecal transplants. https://www.nature.com/news/policy-how-to-regulate-faecal-transplants-1.14720
