【5.8.1】差示扫描量热法(DSC)--一种评估蛋白质抗原的热稳定性和构象的方法
差示扫描量热法(Differential Scanning Calorimetry,DSC)是一种分析技术,可测量样品的摩尔热容随温度的变化。对于蛋白质样品,DSC谱可提供有关热稳定性的信息,并在某种程度上充当可用于评估结构构象的结构“指纹”。使用差示扫描量热仪测量热转变温度(熔融温度; T ,melting temperaturem)和破坏稳定蛋白质三级结构的相互作用所需的能量(焓; ∆H,enthalpy)。比较配方和生产批次,得出值的差异表明热稳定性和结构构象的差异。提供了说明DSC在工业环境中用于稳定性研究以及监视关键制造步骤的数据,以证明该协议的有效性。与评估蛋白质构象的热稳定性的其他方法相比,DSC具有成本效益,需要很少的样品制备步骤,并且还提供了蛋白质展开过程的完整热力学曲线。
一、介绍
差示扫描量热法(DSC)是一种实验方法,可直接测量在调节的温度变化过程中样品相对于参比样品吸收的热能的差异。该方法在差示扫描量热仪中进行,包括将热能同时引入到样品池和参比池中,同时随着时间相同地升高两个cell的温度。由于样品和参比物的成分不同,需要不同量的能量来升高细胞的温度。因此,测量补偿cells之间的温度差所需的过量能量,并将其与样品的特定热力学性质直接相关。
1960年代,Perkin Elmer的MJ O’Neil和E. Watson开发了第一台差示扫描量热仪,用于测量固体材料的热流。同时,佐治亚共和国物理研究所的PL Privalov和DR Monaseldze EL(前苏联)创建了一种独特的绝热量热计,可用于生化研究。随后,佐治亚州共和国物理研究所的Andronikashvili小组使用DSC 报告了生物分子的热容量(heat capacity ),例如纤维和球状蛋白质,DNA和RNA 。由Sturtevant领导的几支球队,Brandts和Privalov 专注于DSC的理论和实际应用的发展,以研究蛋白质展开的热力学细节。DSC在研究大型超分子结构(如噬菌体,叶绿体,磷脂液晶和肉类蛋白质)中的价值也已有报道。
DSC现在在药物研究和开发中变得很普遍,用于评估生物分子(尤其是蛋白质)的热稳定性。这主要归因于用于进行实验的仪器的灵敏度和自动化方面的进步。在此,DSC实验的最终结果,即摩尔热容随温度的变化,被用于估算以下热力学参数(热容变化(∆Cp),焓(∆H),熵(∆S),以及吉布斯自由能(∆G),请使用以下公式:
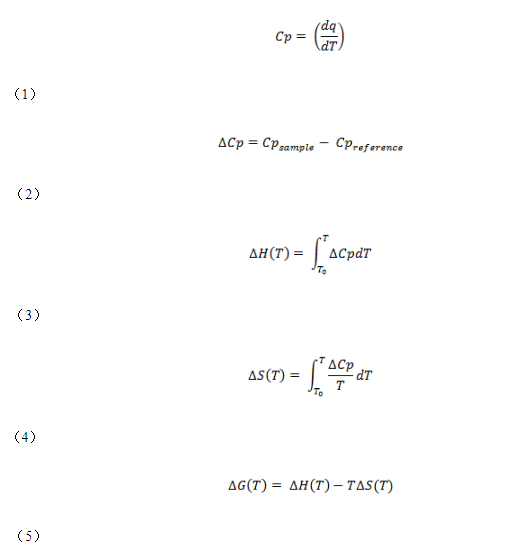

其中T m是转变的中点温度,R是理想气体常数(1.987 cal mol -1 K -1),Y是处于展开状态的蛋白质群体的分数。如果ΔH VH等于ΔH校准; 或ΔH VH /ΔH卡尔等于1,则该蛋白质经历了一个“全或无”的过渡(即,两状态转变)。然而,如果ΔH VH小于ΔH校准; 或ΔH VH /ΔH卡尔小于1时,蛋白质经历非两态转变。ΔHVH /ΔH 之比校准也对应于蛋白质结构的比例熔化作为热力学协作单位或结构域。
上面提到的热力学参数(例如ΔG和ΔH)提供了有关蛋白质热稳定性的有用信息,包括生物制剂。但是,在本出版物中将重点放在T m和ΔH上,因为它们是该协议的报告值。T m是过渡的中点温度,在该温度下,蛋白质的折叠状态和未折叠状态处于平衡状态(即ΔG= 0)。蛋白质的T m越高,其热稳定性就越高。ΔH对应于DSC实验结束时生成的热容-温度曲线图(也称为热分析图)的峰下面积。它是使蛋白质变性所需的能量,可使用以下公式估算蛋白质制剂中的活性成分(F a)(即样品中具有活性构象的蛋白质的比例):
Fa = ΔH/Q
其中,ΔH是蛋白质样品的实验得出的焓,Q是为特征明确的参考蛋白质或标准化蛋白质确定的焓。F a的估计对于监控产品的实时稳定性以及在ICH准则要求的应力条件下进行稳定性研究均具有重要意义。ΔH的比较还提供了关于蛋白质的三级结构构象的紧密性的信息。
该协议详细介绍了在工业环境中评估蛋白质热稳定性的程序,已被广泛用于疫苗的配制。它是使用自动差示扫描量热仪开发的,其蛋白质浓度低至300 µg / mL时可产生可重复的结果。
二、具体操作
略
三、结果说明
来自大多数DSC实验的原始数据以热通量与温度的关系图表示,因为量热计实际上测量的是流入样品溶液和缓冲液的热流率之差。因此,如果在实验期间两个单元(即样品单元和参考单元)都包含相同的溶液,则来自扫描的原始数据应为一条平线,没有可观察到的峰。观察到的任何峰都可归因于仪器错误(例如,细胞受损或污染),这就是为什么在样品分析之前进行缓冲液扫描是足够的系统适用性测试的原因。
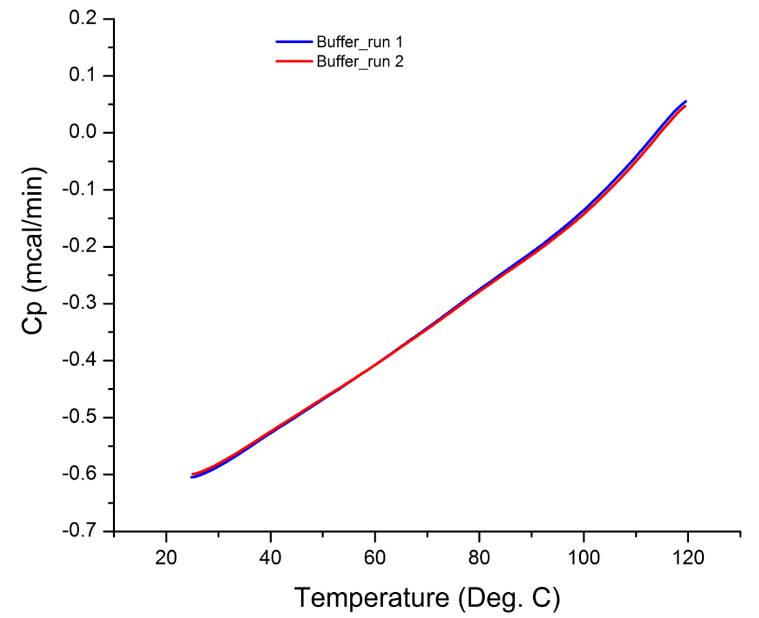
图1说明了典型的缓冲液扫描结果,表明量热仪在样品分析之前处于良好的工作状态。
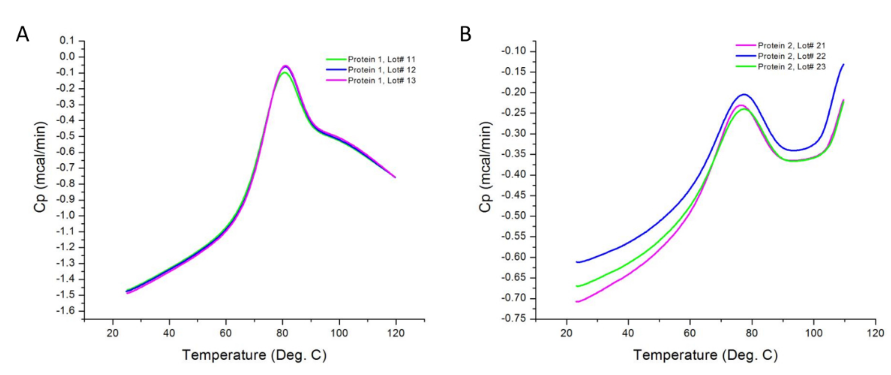
图2显示了在不同批次的两种蛋白质样品上进行的DSC实验的原始数据。如前所述,观察到的峰是样品及其各自缓冲液的热通量之差。样品浓度的差异可能会导致热量计记录的热容量发生变化;但是,这些差异在样品分析过程中已按照程序第4.2节进行了归一化。较高的浓度也可以显示出其他的热力学区域,在较低的浓度下不会促进过渡。另外,每个转变代表热力学结构域,其可以包括蛋白质的一个或多个结构域。在这种情况下,蛋白质1具有三个融化的结构域。
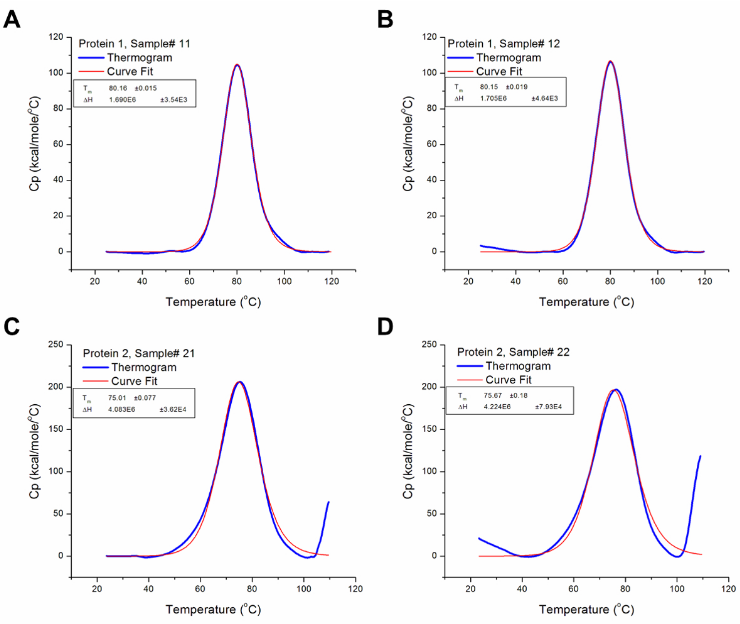
图3显示了对图2中所示的蛋白质1和2的原始数据进行分析后生成的结果,即在基线减法和迭代曲线拟合之后。生成的热分析图已针对扫描速度(通过分析软件中的预设算法自动执行)和浓度进行了标准化;因此,在可比较的热容量与温度曲线图中展示了实验结果。分析软件使用来自热容量与温度的关系图上的数据(例如T m和ΔCp),根据蛋白质解折叠的协同作用,使用上面给出的方程式的变化来得出其他热力学参数。
图3:分析的DSC数据。这些图很好地表示了已分析的DSC数据(即在减去基线和曲线拟合之后)。蓝线代表基线减去后的热谱图,而红线代表最适合热谱图的曲线。(A) 12号蛋白质1样品的T m和ΔH分别为80.16°C和1.69 x 10 6 cal / mol。(B)蛋白质1样品13的T m和ΔH分别为80.15°C和1.71 x 10 6 cal / mol。(C) 2号蛋白质样品21的T m和ΔH分别为75.01°C和4.08 x 10 6 cal / mol。(D) 2号蛋白质2样品的T m和ΔH分别为75.67°C和4.22 x 10 6 cal / mol。
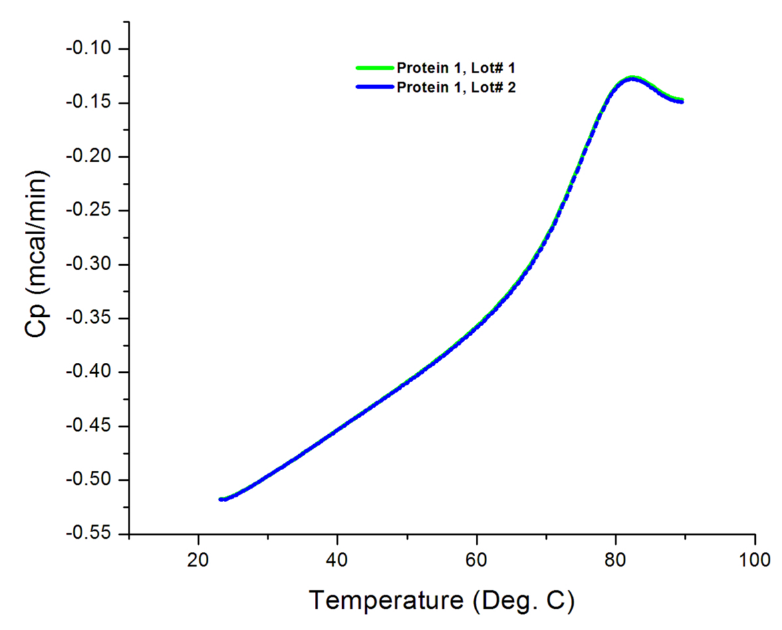
图4:不完整的热分析图。在不足的温度范围内收集的蛋白质1的原始数据。实验的最终温度设置为90°C,与图2A的实验设置为120°C相比,该温度不能适应蛋白质的整个转变过程
测试未知样品时,设置合适的温度范围至关重要。否则,可能会导致不完整的热分析图,如图4所示。尽管可以从这样的轮廓中得出T m,但是不能精确地确定ΔH。因此,必须在更大的温度范围内对样品进行重新测试,以完全捕获热转变。某些蛋白质在完全变性后也很容易形成聚集体,从而导致过渡后的热容量增加:如图2B所示,这通常表现为不完整的热谱图。但是,以更高的最终温度进行重新测试可以帮助确认在热分析图的该区域是否发生构象转变,或者仅仅是蛋白聚集体的吸热作用。
图5:显示化学解毒对蛋白质1的三级结构的影响的分析数据。(A)蛋白质1是天然构象的毒素,其T m在56.84°C,ΔH在2.57 x 10 5 cal / mol。 。(B)蛋白质1(即类毒素)的解毒形式的T m和ΔH值分别为81.01°C和1.89 x 10 6 cal / mol。因此,可以得出结论,解毒步骤为蛋白质1的结构构象引入了某种形式的变异,这赋予了其解毒形式更大的稳定性(更高的T m)
热稳定性是蛋白质和蛋白质基产品在行业中最重要的物理特性之一。在药品中,它用于确定生物制剂在不同条件下的稳定性,包括制剂缓冲液和环境因素(例如湿度和温度)。它还用于监视关键的制造步骤(例如,纯化和解毒),以确保生产批次之间的构象一致性。图5和6说明了使用DSC分别检查化学排毒和储存条件对两种不同蛋白质的稳定性和结构构象的影响。Tm和∆H的显着差异分别表明构象变化和蛋白质降解。此外,图6中第三个跃迁的丢失进一步说明了域的降解,这是通过使用具有多角度光散射的尺寸排阻色谱法(SEC-MALS)分析样品时分子量降低证实的(数据未显示)。

图6:显示存储条件对蛋白质3构象影响的分析数据。这些图说明了存储温度(2-8°C)对30周内蛋白质3稳定性和三级结构的影响。蛋白3和ΔH值,第三周 (A)和第38个星期(B)
表1:Tm和ΔH值蛋白3在第8周和第38周存储的在2 - 8℃。尽管两个时间点的T m值相似,但ΔH值的差异表明,在指定的储存条件下,蛋白3的三级结构在30周后已降解。
四、讨论
该程序已成功地整合到各种特性测试包中,包括稳定性和产品可比性研究。在实时稳定性研究中,DSC用于监测T m,并随着时间的推移估算生物制剂的F a以确定其保质期。关于产品可比性(comparability),它用于评估过程和设施变更的影响,以及关键制造步骤对生产批次结构形态的影响。通常,这涉及直接将生产批次的ΔH与已指定为理想产品的参考产品进行比较。此外,DSC已被证明是用于产品配方研究的有用分析工具。在不同的缓冲液中和在不同的浓度下,蛋白质的T m可以用来确定对蛋白质最稳定的制剂。
为确保该方法的可靠性及其结果的客观性,在同一研究(例如疫苗制剂研究)中,每次运行之间保持测试参数的一致性非常重要。但是,可以修改该程序以适应各种蛋白质的物理特性差异。可以进行的修改的示例是改变实验的扫描速率。以较快的扫描速率(例如120°C / h)检查在加热时易于形成聚集体的蛋白质,以避免聚集体对热转变曲线的影响以及堵塞量热计的毛细管。值得注意的是,扫描速率会影响DSC实验的结果。在某些蛋白质中,随着扫描速率的提高,观察到热转变峰变宽。然而,T m保持相当恒定。此外,样品制备的透析和脱气步骤对于获得准确的结果也非常关键。透析可确保样品和缓冲液组成的唯一区别是蛋白质;因此,样品吸收的所有多余热量都可以归因于蛋白质的热容量。脱气可确保精确的体积分析,因为热力学参数的推论假设展开事件是在恒定体积和压力下发生的。根据程序的第1.1节,假设的恒定压力部分由系统的氮气加压来解决。
与确定蛋白质构象稳定性的其他方法(例如圆二色性(CD)和荧光光谱法)相比,DSC在商业环境中具有许多优势,包括节省成本和时间。
- 首先,与CD和荧光光谱仪相比,差示扫描量热仪的绝热设计允许以更高的温度精度测量热稳定性。
- 其次,与CD不同,DSC数据的准确性不取决于蛋白质的螺旋度。但是,CD提供了有关二级结构展开的其他信息,这是DSC 的补充。
- 此外,DSC系统的加压可在较宽的温度范围内进行测试而不会使样品沸腾;因此,DSC可以测试多种蛋白质。
尽管DSC是确定生物制剂热稳定性的相对快速和直接的方法,但它并非没有局限性。
- 首先,基线减法步骤在原始数据分析中引入了某种形式的人为不一致的现象。因此,不同用户之间可能会观察到结果差异。
- 其次,差示扫描量热仪具有最小的浓度极限,这在批量生产规模上可能难以实现。
- 第三,不可逆热变性的ΔH不是绝对的。这意味着在类似情况下得出的ΔG(蛋白质稳定性指标)可能会产生误导。
- 此外,该方法最适合纯化的样品。杂质的存在可能导致T m的变化,如果与所研究的蛋白质发生相互作用,或者没有相互作用则出现新的热转变。
在任何情况下,热谱图上的这些额外特征都可能错误地归因于样品,从而影响结果的解释。尽管有这些限制,DSC仍然是一种可靠的方法,如果实施正确,它可以提供有关蛋白质展开过程的详细热力学信息。
总之,DSC作为疫苗产品及其中间体的构象读出工具具有相当大的优势。从大量相同产品的阵列中收集的两个参数T m和ΔH可以成为经验基线,可用于检查工艺变化,配方和储存条件对蛋白质和蛋白质的三级结构和稳定性的影响。
参考资料
- J Vis Exp. 2017; (121): 55262.Published online 2017 Mar 4. doi: 10.3791/55262. Differential Scanning Calorimetry — A Method for Assessing the Thermal Stability and Conformation of Protein Antigen
