【5.2.3.2】蛋白纯化的buffer
每一步纯化过程中,蛋白质的溶液环境对其稳定性和活性的保持都非常关键。蛋白质应该保存在一个良好的缓冲液环境中,要避免突然的pH值变化,以其防止对蛋白质折叠状态、溶解性和活性造成不可逆的影响。
一、考虑因素
当我们纯化蛋白时,最重要的就是要保持蛋白在纯化过程中不能失活,或者是尽量降低纯化过程对蛋白活性带来的损失。这就意味着蛋白在整个纯化过程中要始终保持可溶性和活性。
要保持蛋白的活性,我们在开始要检测蛋白的稳定性可以以下面几条为依据:
- 蛋白放室温过夜,检测稳定性和降解活性发生情况。
- 在pH 2-9每隔一个pH值检测pH稳定性(例如 2 3 4 5 6 7 8 9)。
- 耐盐性测试。用0-2M氯化钠每隔0.5M做盐稳定性测试
- 耐有机溶剂测试。用0=50%乙腈和甲醇,每隔10%做稳定性测试
- 温度稳定性测试。4-40℃之间,每隔10°做温度稳定性测试。
有了对我们目的蛋白一个稳定性的了解,我们还需要再设计一个防止蛋白降解和聚合的蛋白纯化缓冲体系。在设计缓冲buffer时应考虑以下几个因素:pH值、缓冲体系、盐离子浓度,特殊蛋白还要考虑加入还原剂和稳定剂。每一项都要根据我们目的蛋白的稳定性测试为依据进行优化。
1、pH值
为了模拟生物体内条件,我们实验经常设置7.4的pH,如果我们蛋白在这个值稳定就是最理想的情况,如果我们蛋白在这个pH之下不稳定,就需要根据我们稳定性测试结果找一个最接近蛋白等电点的又能使蛋白稳定的pH. 如不了解蛋白等电点可以上ProtParam提交蛋白序列查询其pI值。
2、缓冲体系
缓冲体系的一个重点就是要在选定的pH条件下具备缓冲能力即其解离常数pKa值应该在设定的pH上下一个pH值单位内,推荐浓度范围为20 mM -100mM。
注:所选缓冲体系确保不会对蛋白活性产生影响。一些对温度敏感的缓冲液体系需要在实验条件下调pH。
3、盐离子浓度
为了模拟生理条件以及维持蛋白可溶性,缓冲液中需要有NaCl的存在,一般用150mM的浓度。洗脱时一般需要高达500mM盐浓度进行洗脱,这就需要我们最后用脱盐柱将目的蛋白置换到盐浓度相对较低的缓冲液中。
4、添加适当的还原剂
氨基酸的氧化可以导致蛋白聚集,如果我们目的蛋白含有一些比较容易氧化的氨基酸残基,我们在缓冲液中要加入适量的巯基乙醇、DTT或TCEP等还原剂。浓度要远高于蛋白浓度,低温存储或者使用时加入。注:还原剂会影响柱料的载量,柱子用完需要多用无还原剂缓冲液冲洗再生。
5、添加适当的稳定剂
最后一个辅助的因素就是稳定剂,在实验之前可以在buffer中添加适当浓度的稳定剂提高蛋白的溶解度和稳定性。
二、缓冲液体系
缓冲液是一种含有共轭酸/碱对的水溶液。缓冲液的pH值范围根据其pKa值决定。该pKa值定义为50%的分子为酸式结构,50%为碱式结构时的pH值 (图1)。
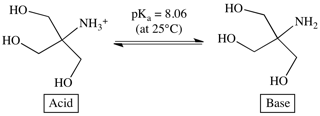
图 1. 含Tris碱及其酸式物的Tris缓冲液溶液
Tris 25°C的pKa值是8.06,表示当pH=8.06,50%的Tris是质子化(酸式结构),50%是去质子化(碱式结构)。
关于缓冲液的一个常规原则是,其pH值应保证在pKa值左右1个pH值单位范围内,从而保证其具有良好的缓冲能力。如此可以保证同时有足够的以酸式结构和碱式结构存在的分子在加入 H+ 或者 OH- 时可以将它们中和。这样,缓冲液就可以防止pH变化导致的蛋白质稳定性改变。
一种好的缓冲液必须具有以下特征 :
- 水溶性
- 化学稳定性
- 在所需pH范围内良好的缓冲能力
- 与分析和实验应用条件具有良好的兼容性
- 与其他溶质具有良好的兼容性
很多物质都可以用于生物缓冲液。最常使用的缓冲液成分通常具有接近中性的pKa值,可在生理pH值范围左右使用。表1列出了4种最常用的生物缓冲液、各自的pH值应用范围及各自可能对蛋白质纯化过程产生影响的优缺点。为保证足够的缓冲能力,这些缓冲液的浓度通常为25mM。
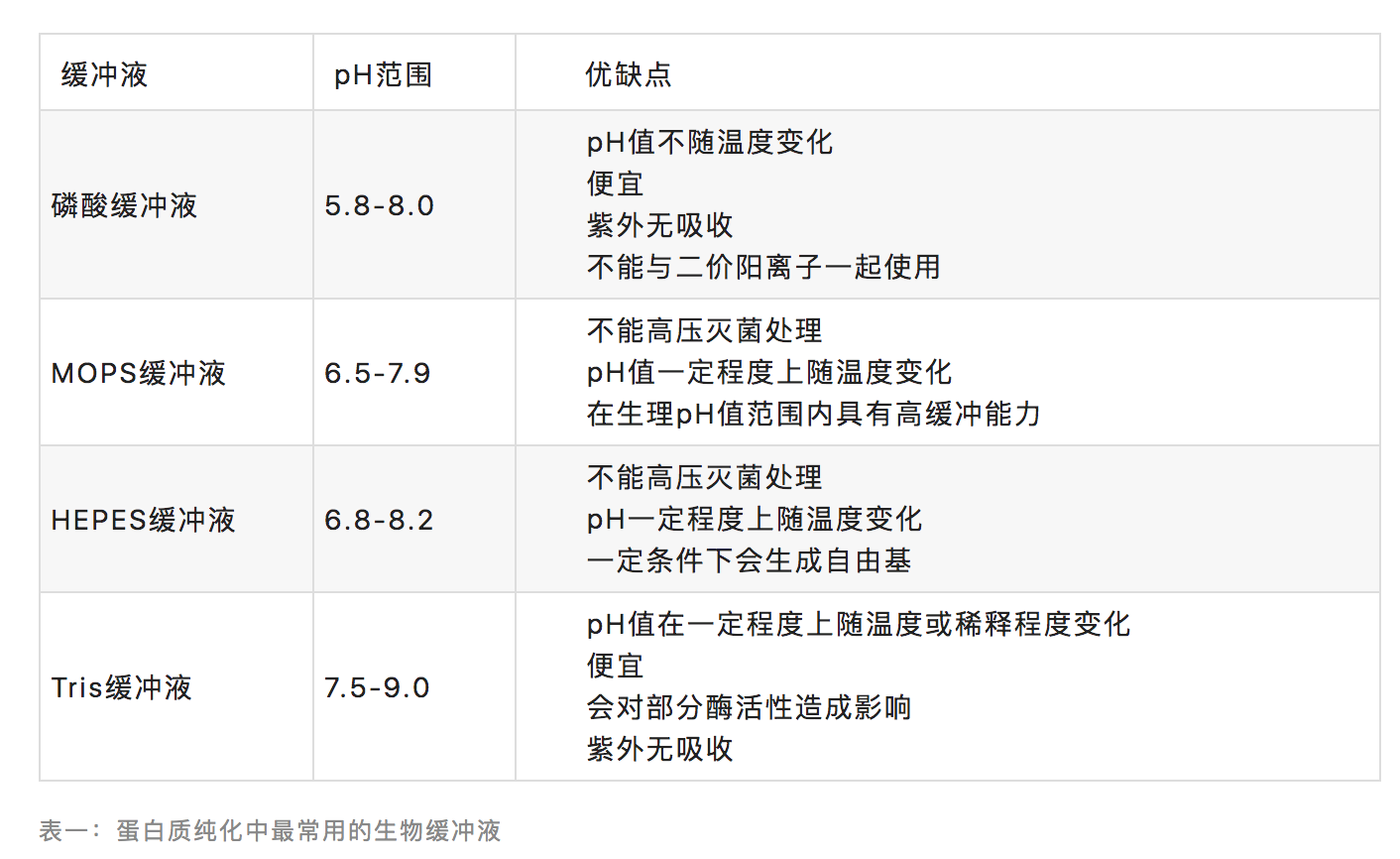 缓冲液在一定pH值范围内可保持它们的缓冲能力,部分缓冲液成分会对某些层析过程或者分析实验造成影响。
缓冲液在一定pH值范围内可保持它们的缓冲能力,部分缓冲液成分会对某些层析过程或者分析实验造成影响。
三、溶液添加剂
除了一个合适的缓冲液体系,蛋白质纯化过程中——从溶菌到保存——所使用的溶液通常还含有很多其他对蛋白质纯度、稳定性和活性方面均具有一定作用的成分。
溶菌缓冲液和纯化工艺的前期步骤中常常会添加蛋白酶抑制剂以防止目标蛋白质被内源性蛋白酶酶解。而纯化工艺的后期一般不用再添加这些蛋白酶抑制剂,因为此时几乎所有的蛋白酶都已经从目标蛋白质分离出去。蛋白质的保存缓冲液中通常要添加金属螯合剂,如EDTA或EGTA。这些金属螯合剂与 Mg2+结合以防止目标蛋白质被所含的金属蛋白酶分解。还有一些其他的添加剂,主要是用来保护蛋白质不被破坏和增强其溶解性。
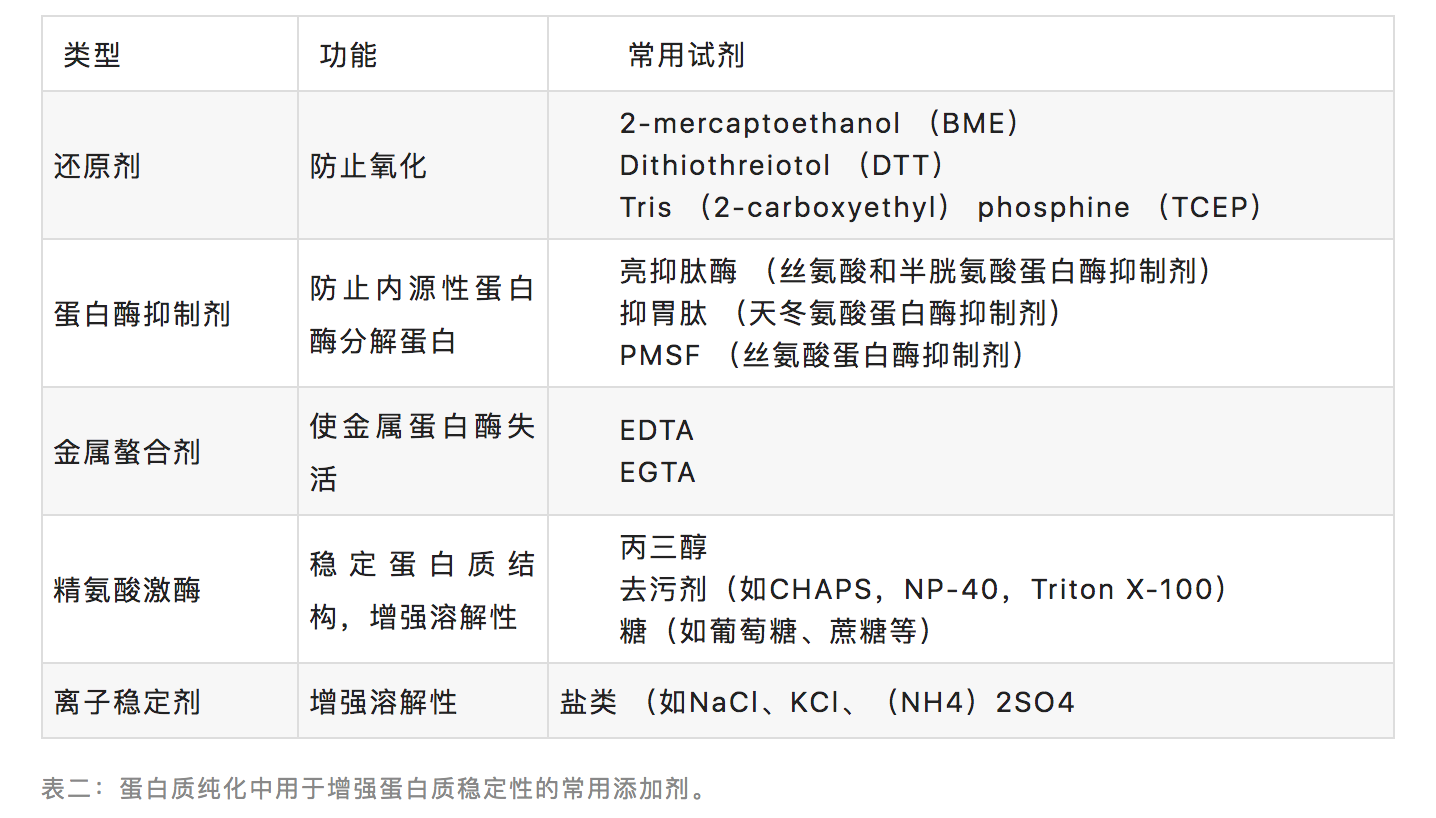
添加剂只在必要时才使用。可能需要多次尝试才能确定某些添加剂是否对一些特定蛋白质的纯化工艺有效。
四、下面是一些比较实用的添加剂:
- 惰性蛋白BSA:稳定蛋白(使用之前确保不会干扰实验结果)
- 聚乙二醇、甘油:增加缓冲液粘度,防止蛋白聚集
- 表面活性剂、离子化合物:减弱蛋白间的离子相互作用,助溶
通过以上几个方面可以建立使蛋白相对较稳定的缓冲体系,可以辅助大家更顺利的纯化出自己的目的蛋白。
还有推荐的:
- 10mM Acetic acid + 9%Sucrose, PH 5.2(推荐)
- 20mM histidine +150mM Nacl,pH6
- PBS+60mM Arg PH7.4(可调整)
我们PBS的配方如下: 137mM NaCl,2.7mM KCl,10mM Na2HPO4,2mM KH2PO4 。浓度是0.01mol/L PH:7.2-7.4
参考
