【9.1.2】哺乳动物细胞功能和命运中的mRNA帽调节

- mRNA帽是mRNA 5’末端的甲基化修饰。
- RNA 加工和翻译因子被募集到 mRNA 帽上。
- mRNA 帽保护转录物免于降解,并将 mRNA 定义为“自身”。
- mRNA 帽的形成受细胞信号通路的调控。
- mRNA 帽调节导致基因表达和细胞功能的变化。
在这篇综述中,我们探讨了 mRNA 帽形成的调节及其对哺乳动物细胞的影响。mRNA cap 是 RNA pol II 转录的 RNA 5' 端的高度甲基化修饰。它保护 RNA 免于降解,招募参与RNA 加工、输出和翻译起始的复合物,并将细胞 mRNA 标记为“自身”以避免被先天免疫系统识别。mRNA 帽可以被视为一个独特的标记,它选择 RNA pol II 转录本进行特定的加工和翻译。近年来,出现了由癌基因、发育途径和细胞周期诱导的 mRNA 帽形成调控的例子。这些信号通路 调节 mRNA 帽形成的速率和程度,导致基因表达、细胞生理学和细胞功能的变化。
1 . mRNA帽
RNA pol II 转录的 RNA 通常占哺乳动物细胞总 RNA 的 5% 以下。RNA pol II转录的RNA包括pre-mRNA(信使RNA)、pre-miRNA(微小RNA)、pre-lncRNA(长链非编码RNA)、snoRNA(小核仁RNA)和snRNA(小核RNA)。大多数细胞 RNA 是由 RNA pol I 和 III 转录的 rRNA(核糖体 RNA)和 tRNA(转移 RNA)。因此,RNA pol II 产物代表了一个功能不同的基团,必须与其他 RNA 种类分开加工、运输和翻译,就 mRNA 而言:这需要标记它们的身份。RNA pol II 产物在转录过程中通过添加甲基化鸟苷进行独特标记5’末端的帽结构。mRNA 帽阻止 5'-3' 外切核酸酶介导的降解,并招募特定的RNA 加工、输出和翻译因子 [ 1 , 2 ]。去除帽(去帽)会引发 mRNA 的降解 [ 3 ]。因此,上限在机制上参与 mRNA 生命周期的每个阶段。其他 RNA pol II 转录的 RNA 种类也有帽盖,但帽盖结构和功能各不相同。例如,pre-miRNA 在成熟过程中失去其帽,而 snRNA 和 snoRNA 帽可以进一步修饰为三甲基鸟苷 (TMG) 帽 [ 4 ]。在这篇综述中,我们将重点关注 mRNA 帽的调节和作用。
2 . mRNA帽修饰
在哺乳动物中,主要的帽结构是7-甲基联通过5’至5’三磷酸桥于第一转录核苷酸,其在甲基化核糖O-2位置(表示M7G(5')PPP(5')XM , X 是第一个转录的核苷酸) [ 2 , 5 ]图 1 。m7G(5')ppp(5')Xm 最初被认为存在于所有 mRNA 上,然而,由于生物化学、器官特异性和细胞特异性 N-7 帽鸟苷甲基化和 O-2 第一核苷酸水平的进步已观察到核糖甲基化 [ [6]、[7]、[8]、[9], [10] ]。这表明不同细胞谱系和/或响应特定信号通路对 mRNA 帽形成的差异调节。此外,第二个转录的核苷酸核糖 O-2 甲基化和第一个核苷酸腺苷 N-6 甲基化也很容易观察到 [ 11 , 12 ]。第一个核苷酸腺苷 N-6 甲基化是一种丰富的修饰,m7G(5')ppp(5')m6Am 占 HeLa 细胞中 m7G(5')ppp(5')Xm mRNA 帽的 20-30% [ 13 ]。由于诸如腺苷 N-6 甲基化之类的修饰是核苷酸特异性的,并且由于帽结合蛋白可能具有核苷酸偏好,因此转录起始位点通过确定第一个转录的核苷酸对帽结构的影响 [ 14 ]。在 RNA 的内部位置检测到的一系列修饰也可能存在于帽鸟苷和帽近端核苷酸上。然而,已被证明使帽和相邻核苷酸甲基化的酶对帽结构具有特异性,并且修饰内部残基的酶不太可能同时修饰帽 [ 1 , 4 ]。
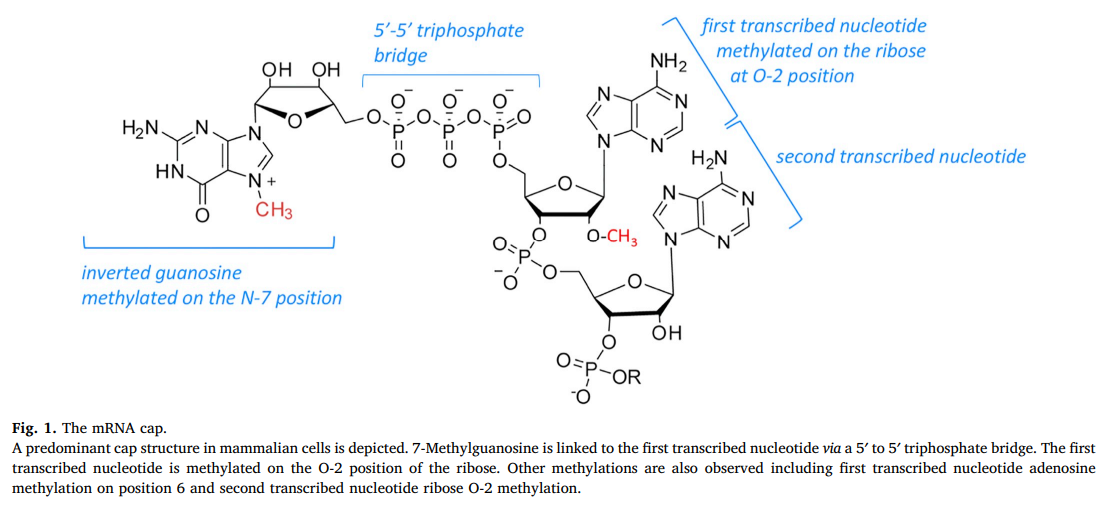
图1。mRNA 帽。 描绘了哺乳动物细胞中的 主要帽结构。7-甲基鸟苷通过5' 到 5' 三磷酸桥连接到第一个转录的核苷酸。第一个转录的核苷酸在核糖的 O-2 位置被甲基化。还观察到其他甲基化,包括第 6 位上的第一次转录核苷酸腺苷甲基化和第二次转录的核苷酸核糖 O-2 甲基化。
最近,一种不同类型的帽结构,烟酰胺腺嘌呤二核苷酸(NAD) 帽,最初在细菌和酵母中被发现,在哺乳动物细胞中被发现[ 8 , 15 ]。NAD 上限针对转录本进行降解 [ 8 ]。尽管在 HEK293T 细胞中携带 NAD 帽的 mRNA 的比例很低,但它很可能在其他细胞系或原代组织中升高和/或调节 [ 16]]。NAD 封顶的水平至少部分由 NAD 的细胞浓度决定。未来的挑战将是检测低丰度修饰并确定其功能意义。通过鉴定催化合成或去除的酶,可以极大地促进确定细胞中帽修饰的功能。
3 . mRNA帽的功能
mRNA帽的已知功能是由其与结合蛋白和复合物的相互作用介导的(图2)。帽修饰可能会影响帽对其各种辅助因子的亲和力[ [17]、[18]、[19] ]。
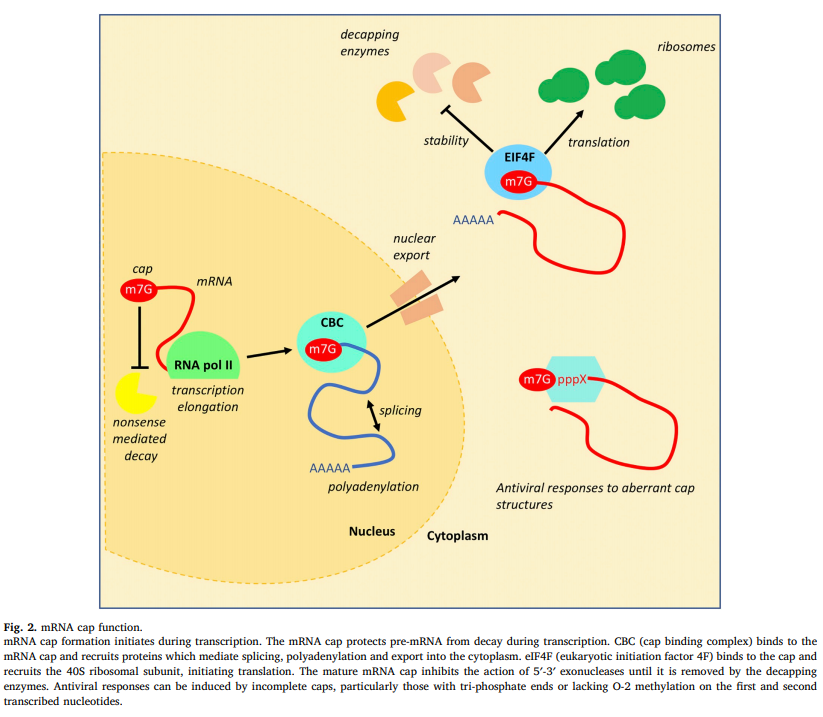
图2。mRNA帽功能。 mRNA 帽形成在转录过程中开始。mRNA 帽在转录过程中保护前体 mRNA 免于衰变。CBC(帽结合复合物)与 mRNA 帽结合并募集介导剪接、聚腺苷酸化和输出到细胞质中的蛋白质。eIF4F(真核起始因子 4F)与帽结合并招募 40S 核糖体亚基,启动翻译。成熟的 mRNA 帽会抑制 5'-3’核酸外切酶的作用,直到它被脱帽酶去除。抗病毒反应可以由不完整的帽引起,特别是那些具有三磷酸末端或在第一个和第二个转录核苷酸上缺乏 O-2甲基化的帽。
。。。。。 (省略一部分)
m7G Cap功能:
1.mRNA translation
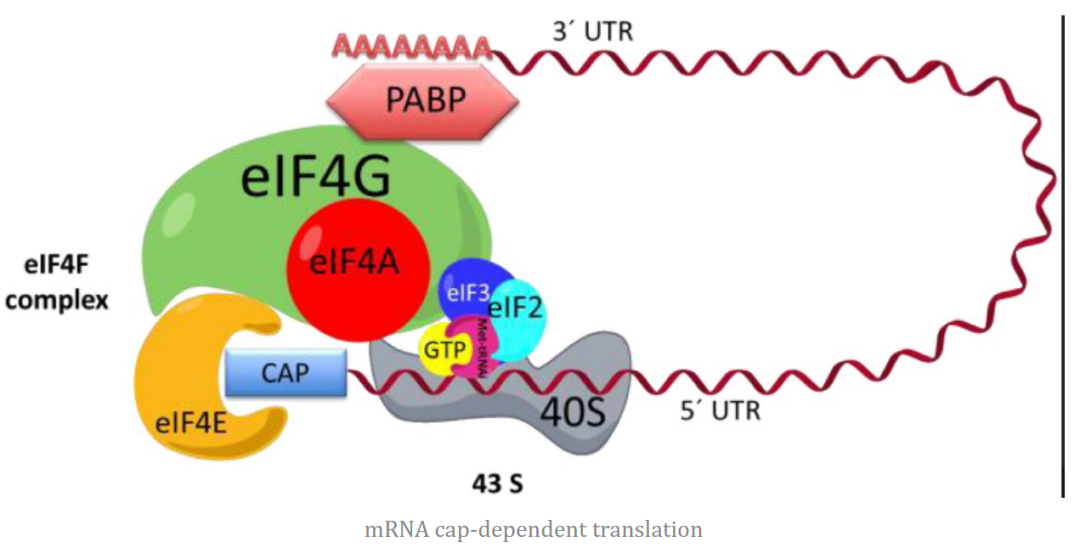
在真核细胞中,eIF4E(eukaryotic initiation factor 4E)紧密结合到mRNA 5’帽子结构上,与 eIF4G (支架蛋白)和eIF4A (解旋酶) ,形成 eIF4F复合物,参与蛋白质翻译的起始。上述过程称为cap-dependent translation,这是大多数真核mRNA起始蛋白翻译依靠的机制。
2.Nuclear export
有研究报道,在酵母细胞中,帽子结合复合物CBC(Cap-binding complex)可以结合到mRAN 5’末端帽子结构上,通过募集Npl3和Yra1,提升mRNA核输出。此外,CBC还可以促进Sus1 mRNA 剪接,而Sus1 通过TREX-2系统来参与mRNA核输出。由此可以看出,mature RNA从细胞核穿过核孔复合体进入到细胞质,mRNA 5’端帽子结构在此过程中发挥极其重要的作用。
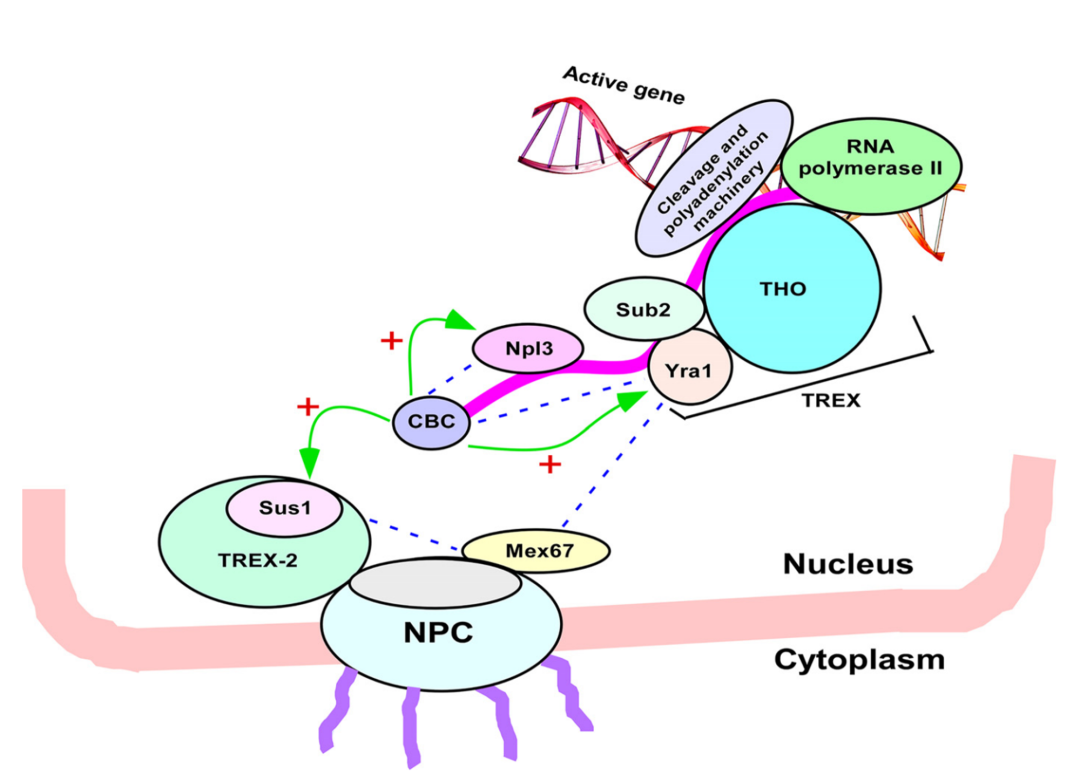
帽子结合复合物CBC调控mRNA出核过程
3.mRNA stability
mRNA 5’末端帽子能够被Dcp2(decapping enzymes)去除掉,释放出m7GDP和5' monophosphated RNA,Xrn1进而从头开始降解5' monophosphated RNA。有研究报道,在哺乳动物细胞中,DXO具有3种酶活性,pyrophosphohydrolase, decapping, and 5' to-3' exoribonuclease activities,偏好降解一些加帽不完全的mRNA初始转录本。因此,mRNA帽子结构和其稳定性密切相关。
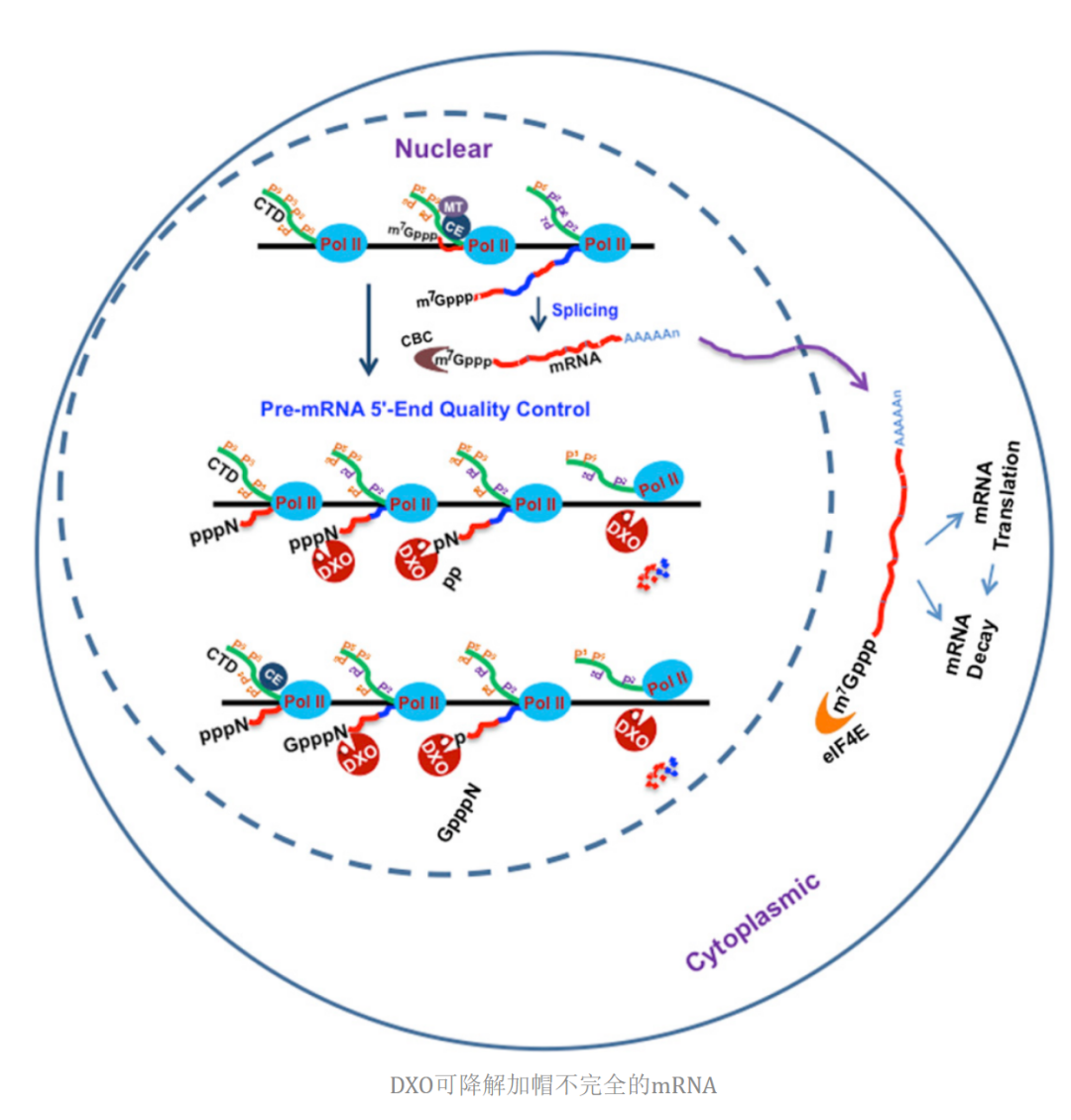
4 . mRNA 加帽酶
mRNA 帽形成由一系列酶催化 [ 1 , 4 ]。mRNA 帽形成的生化机制可能在所有发现它的物种中都相同,图 3。然而,所涉及的酶在不同物种中存在差异 [ 1 , 57 ]。此外,mRNA 加帽酶已经进化为接收调节信号,这可能导致它们的表达、定位和活性发生变化。特别是,在脊椎动物中,酵母中不存在额外的 mRNA 加帽酶、调节域和亚基,通过它们信号通路可以调节 mRNA 帽形成,从而调节基因表达。在这篇综述中,我们将讨论哺乳动物加帽酶的调节机制及其对基因调控、细胞功能和细胞命运的影响。

图3。mRNA帽合成。
描述了哺乳动物细胞中的主要加帽反应。观察到第一个和第二个转录核苷酸上的其他甲基化事件。酶符号、名称和功能为蓝色。SAM 是 S-腺苷甲硫氨酸。SAH 是 S-腺苷同型半胱氨酸。RNMT、CMTR1、CMTR2都可以作用于G(5')ppp(5')XpX;即不需要帽的事先甲基化。
5 . 哺乳动物mRNA帽调控的主要细胞机制
…
6 . mRNA帽研究的挑战
在 mRNA cap 发现的早期,鉴定并定义了三种结构,Cap 0 (G(5')ppp(5')X)、cap 1 (m7G(5')ppp(5')Xm) 和 cap 2 m7G( 5')ppp(5')XmXm(在核糖O-2 位置甲基化的第一个和第二个转录核苷酸)[ 99 ]。我们现在认识到 NAD 帽的存在,并且正在出现对第一个转录核苷酸的额外修饰。此外,我们在肝脏提取物中鉴定出大量的 G(5')ppp(5')X、G(5')ppp(5')Xm、G(5') 和 m7G(5')ppp(5')X (未公开数据)。在识别出新的低丰度帽修饰之后,挑战在于确定它们的功能。一些 mRNA 帽依赖性过程(例如翻译起始)可以很容易地重组体外。然而,在完整细胞中最可靠地研究其他 mRNA 帽依赖性过程(例如剪接、输出),因为它们需要完整的细胞成分和/或在与其他细胞过程耦合时最有效。因此,通过鉴定所涉及的酶及其在细胞中的缺失/修饰,可以加强对新修饰功能的研究。值得注意的是,并非前几个转录核苷酸的所有修饰都具有功能(或不是在每个转录本上)。非有害修饰可能没有要去除的选择压力。
mRNA 帽研究的另一个主要挑战是确定有多少转录的核苷酸是帽的组成部分。在锥虫和其他动质体中,帽被添加到 39个核苷酸的“剪接前导”转录本 [ 110 , 111 ]。“反式剪接”过程将这种剪接前导添加到从多顺反子转录的 mRNA 中。在这个剪接前导中,前四个转录的核苷酸被甲基化以产生帽 4 结构,m 7 G(5')ppp(5')m 6 2 AmpAmpCmpm 3 Um [ [112]、[113]、[114] ]。帽的镇压动质体中的甲基化导致反式剪接和翻译减少[[112]、[113]、[114]、[115]]。既然我们现在可以在哺乳动物中识别出第 3 和第 4 个转录核苷酸的修饰,那么这些都应该被视为帽结构的一部分吗?我们建议帽结构应该在功能基础上描述,因此问题将变成,转录的核苷酸影响与不同帽结合复合物的相互作用? 值得注意的是,帽结合复合物 CBC 在哺乳动物中是一个 100 kDa 的两个亚基复合物,而在锥虫中它是一个 5 个亚基、300 kDa 的复合物,它可以利用与扩展帽 4 结构的额外接触 [ 116 ]。
在这里,我们描述了 mRNA 帽修饰是如何合成的,所涉及的酶的活性如何受到调节,以及它们如何影响 mRNA 加工和基因表达。未来的研究可能会确定新的帽结构,表征体内帽形成的调节,并揭示帽多样性在控制哺乳动物细胞行为中的作用。
参考资料
