【9.8.2.2】N1-甲基假尿苷在新冠肺炎疫苗中的作用
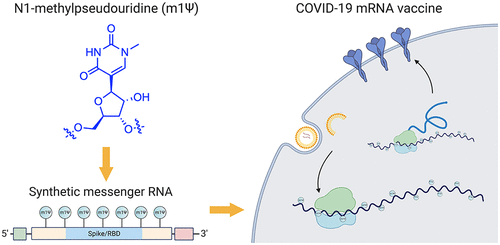
一、新冠肺炎MRNAVACCINES的主要结构
两种经批准的新冠肺炎mRNA疫苗由辉瑞生物科技公司(BNT162b2;商品名:Comirnaty;通用名:tozinameran)和Moderna(mRNA-1273)销售。前者的序列已经公开(图2)。辉瑞-BioNTech疫苗的有效载荷是由五个主要元件组成的4284核苷酸的RNA线性序列
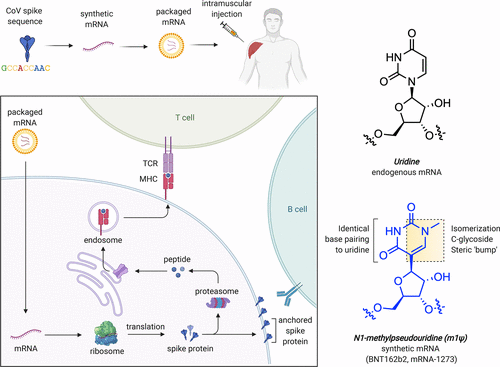
Figure 1. (a) mRNA-based COVID-19 vaccine strategy. (b) Structural features of uridine and m1Ψ. TCR = T-cell receptor. MHC = major histocompatibility complex.
- A 5′-cap (m7(3′OMeG)(5′)ppp(5′)(2′OMeA)pG, commonly referred to as trinucleotide “cap 1”) that helps recruit the ribosome and protect the RNA from degradation. (12)
- A 5′-untranslated region (UTR) derived from the human α-globin mRNA with an optimized Kozak sequence that helps drive high levels of translation from the correct start codon. (13)
- A codon-optimized coding sequence that specifies production of the transmembrane-anchored immunogenic SARS-CoV-2 spike glycoprotein.
- A 3′-UTR conisting of two sequences derived from the amino-terminal enhancer of split mRNA and the mitochondrial encoded 12S rRNA, which aids high levels of protein expression by stabilizing the RNA. (14)
- An unusual 3′-terminus consisting of two segmented poly(adenosine) tracts. The poly(adenosine) stretches increase mRNA stability, while the segmented structure helps reduce unwanted recombination during plasmid production. (15)
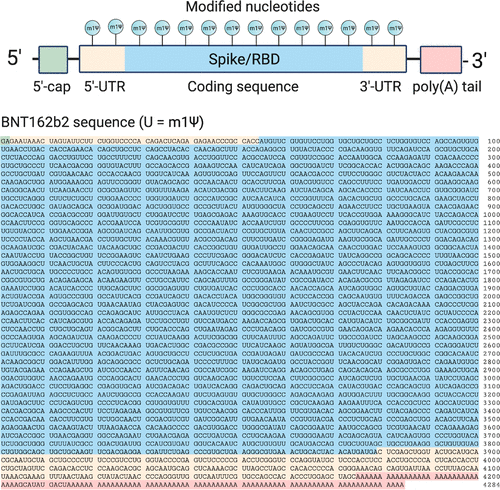
Figure 2. Top: Design elements found in synthetic mRNA therapeutics. Bottom: Sequence of the COVID-19 mRNA vaccine tozinameran (BNT162b2) from Pfizer/BioNTech. Green: 5′-cap. Yellow: 5′- and 3′-UTR sequences. Blue: SARS-CoV-2 spike glycoprotein coding sequence. Red: Segmented poly(A) tail.
二、1-甲基假尿苷加入到mRNA疫苗中
要评估上述设计,首先需要克服一个技术挑战:如何(大规模)生产线性序列远长于化学合成的合成信使核糖核酸,同时保持掺入修饰核碱基(如m1Ψ)的灵活性?答案是从大自然中汲取灵感,用酶的方法制造它们(图3)。这种方法利用了这样一个事实,即DNA(比RNA更容易合成)可以被缝合成大的合成片段。这些片段被用于构建质粒,其中新冠肺炎疫苗的编码被放置在重组T7 RNA聚合酶促进其转录为mRNA的序列的下游。通过将这些质粒与T7聚合酶和核苷酸三磷酸(NTP)孵育,可以产生高产率的mRNA。
几十年的研究已经将T7聚合物酶描述为一种非凡的酶,它可以产生超过20000个核苷酸的RNA而不会出错。T7聚合酶的另一个特征是它对非天然NTPs的耐受性。50多年前,Goldberg和Rabinowitz证明RNA聚合酶可以将假尿苷三磷酸结合到RNA中。在一项早期研究中(这让人非常感谢Sigma-Aldrich目录),从白血病、红细胞增多症或痛风患者捐献的20升尿液中分离出假尿苷,通过混合化学酶方法转化为放射性标记的三磷酸,并发现在体外转录过程中,当省略UTP时,可以取代RNA中的尿苷。对T7 RNA聚合酶的早期研究发现,它也允许不改变碱基配对的修饰NTP,此后,这种策略已应用于许多不同的酶。对这种酶促方法的一个警告是,它会用非天然残基取代天然核碱基;在BNT162b2的情况下,每个尿苷残基 在mRNA中被m1Ψ取代。这意味着要在动脉粥样硬化信使核糖核酸中有用,修饰的核碱基必须与其所有功能元件兼容,包括UTR和核糖体识别的编码序列。通过对修饰信使核糖核酸疫苗的主要序列及其产生方式的了解,我们可以继续研究它们的作用
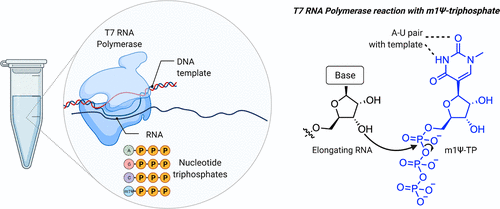
Figure 3. Production of m1Ψ mRNAs by in vitro transcription. Left: Components of in vitro transcription reaction. Right: Incorporation of m1Ψ-triphosphate into RNA is guided by m1Ψ’s ability to form a canonical base pair with adenine of the DNA template in the T7 RNA polymerase active site.
三、N1-甲基假尿苷降低mRNA免疫原性
早期研究表明,包埋在阳离子脂质囊泡中的合成信使核糖核酸可以转染到培养细胞中。当注射到小鼠肌肉中时,报告信使核糖核酸会在数周内产生可检测的蛋白质。然而,这些试剂作为疫苗和蛋白质替代疗法的应用面临的挑战是其免疫原性。细胞含有多种模式识别受体,其自然作用是通过诱导下游信号来识别病毒RNA并对其作出反应。其中包括内体受体TLR3、TLR7和TLR8,它们识别双链和单链RNA,以及胞质受体RIG-I和MDA-5,它们识别单链和5′-三磷酸修饰的RNA。虽然诱导免疫反应理论上是疫苗的积极属性,但不受控制的免疫激活可能导致过敏反应和过敏性休克。此外,在分子水平上,已知免疫信号的过度刺激会使蛋白质翻译沉默,其潜在结果是限制抗原表达和疫苗效力。Kariko及其同事的基础研究取得了突破,他们表明在人类RNA中天然发现了许多修饰,如假尿苷、硫尿苷,和5-甲基胞苷降低了其免疫刺激潜力。这激发了后续研究的灵感,表明这些相同的核碱基修饰可以增加合成mRNAs的蛋白质产量,并可应用于许多应用,包括诱导多能干细胞的产生。这一概念的进一步发展导致m1Ψ,在信使核糖核酸中,发现其在降低TLR3激活的同时增加蛋白质输出。3 m1Ψ和相关修饰降低合成信使核糖核酸免疫原性的能力至少归因于三种机制

Figure 4. (a) Activation of innate immune response by mRNA secondary structures (b) Structure of the single-stranded RNA sensor TLR7 in complex with a polyuridine (poly(U)) ligand (PDB ID: 5GMF). Replacing uridine with m1Ψ demonstrates the steric incompatibility of the modified nucleobase with TLR7 binding and immune activation.
-
反义RNA的合成减少:在高产条件下,T7 RNA聚合酶有时会利用其产生的RNA进行“自启动”,从而合成少量的双链反义mRNA(图4)。(40)通过色谱法去除这些双链RNA杂质并不能消除m1Ψ修饰的和未修饰的RNA之间观察到的免疫原性差异,但确实减少了这种差异。(41)其他研究也发现,使用碱基修饰的NTP产生无需纯化的非炎性mRNA。(34,42)这表明使用非天然NTP进行RNA合成可能不利于这种副产物。
-
改变与RNA二级结构的相互作用:除了反义杂质外,mRNA还可以形成二级结构,如发夹,这些二级结构可能被TLR3和RIG-I等免疫受体识别(图4)。(43)引入修饰的碱基有可能通过改变二级结构和蛋白质/双链RNA相互作用来减少这些识别事件。在相关的C-糖苷假尿苷中,异构化使核苷酸的结构平衡向C3′-内核糖糖和碱基的反定向移动,这种构象有利于螺旋性和堆叠。(44−46)与此一致,最近的一项研究使用化学探测试剂发现了含有m1Ψ和尿苷的RNA形成不同二级结构的证据。(47)还发现修饰的核苷酸会降低mRNA通过RIG-I传播免疫信号的能力,这表明它们影响蛋白质-RNA相互作用的能力。(48)
-
改变与单链RNA免疫受体的相互作用:在免疫细胞中,单链聚尿苷RNA是干扰素最有效的诱导剂之一,可被TLR7感知。(49,50)为了确定m1Ψ是否改变单链RNA的免疫识别,最近的一项研究评估了含有该物种的RNA激活炎症基因表达的能力。(41,47)为了确保任何差异不是由双链RNA引起的,作者采用了一种小鼠模型,在该模型中,对这些结构的免疫反应被沉默。即使在没有双链RNA传感的情况下,m1ΨRNA的炎症性也比那些含有经典尿苷的RNA小。这表明m1Ψ所呈现的氢键面和空间“凸起”的改变破坏了免疫传感器(如TLR7)与合成信使核糖核酸单链段的相互作用(图4c)。
四、 N1甲基假尿苷可改变mRNA翻译
信使核糖核酸药物的最终目的是表达一种治疗蛋白质。因此,m1Ψ和其他修饰的碱基已经被探索了它们促进信使核糖核酸通过核糖体翻译成蛋白质的能力。这些研究与上述研究自然交织在一起,因为免疫激活可以通过关闭核糖体和激活降解信使核糖核酸的核糖核酸酶来限制翻译。与此一致的是,在最初的报告中,发现含有m1Ψ的mRNA能够驱动高水平的蛋白质生产,这在一定程度上归因于其抑制TLR3激活的能力。(39)为了使翻译和免疫激活解耦,Svitkin及其同事分析了m1ΨmRNA在无细胞翻译系统中的翻译。(58)他们观察到m1Ψ的掺入增加了多聚体的大小和丰度,从而提出m1ΨmRNA的更快翻译起始和较慢延伸可能协同增加其半衰期,并诱导与核糖体的生产性相互作用。这些研究提供了m1Ψ可能直接影响mRNA翻译的第一个证据。
已知天然RNA修饰是依赖于上下文的。(59)这意味着它们可以对不同的RNA发挥不同的作用。这些效应也可能取决于它们在RNA中的位置(例如,UTR,编码序列)。(60,61)两项研究以高通量的方式检验了m1Ψ的上下文依赖性(图5)。(47,62)在第一项研究中,Sample等人使用多聚体的RNA测序来比较含有280000个不同的5′-UTR被装载到核糖体上尿苷和m1ΨmRNA的文库 。在所有测试的序列中,发现核糖体负载量与预测的平均自由能反相关。这与经典观点一致,即结构化的5′-UTR可以抑制翻译。(63)然而,这种对m1Ψ的抗偶联作用比尿苷更强,这表明通过稳定RNA结构,修饰的碱基实际上可能会降低这些情况下的蛋白质产量。(46,64)Mauger等人的第二项研究更详细地研究了m1Ψ、RNA结构和蛋白质产生之间的关系。他们评估了三种不同报告子的多个同义版本中的修饰(m1Ψ、假尿苷、甲氧尿苷)和未修饰(尿苷)mRNA,总计超过150个合成mRNA。在这个文库中,发现修饰和未修饰的信使核糖核酸表现出不同的密码子最优“指纹”。假设尿苷和m1Ψ被核糖体类似地解码,这表明除了密码子最优性之外的一个特征负责调节合成mRNA翻译。为了研究结构在这一过程中的潜在作用,作者使用了生物化学探测技术(SHAPE MaP)(65)来研究修饰和未修饰的mRNA。与5′-UTR的情况一样,发现m1Ψ稳定了结构。进一步的研究为一个模型提供了支持,在该模型中,编码序列中的二级结构(可以由m1Ψ强制执行)可以增加信使核糖核酸的功能半衰期,而不依赖于密码子的最优性。(47,62)
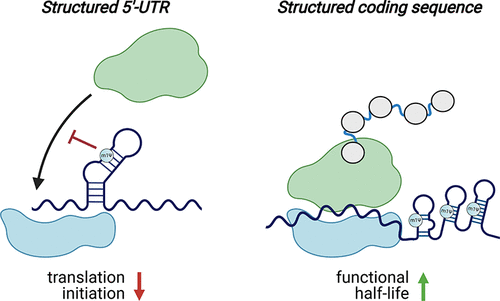
Figure 5. m1Ψ exerts context-dependent effects on translation. Left: m1Ψ-dependent enforcement of secondary structure in the 5′-UTR of synthetic mRNAs can inhibit translation initiation. Right: m1Ψ-dependent enforcement of secondary structure in the coding sequences of synthetic mRNAs can increase their functional half-life. Note: While m1Ψ is homogeneously incorporated throughout synthetic mRNA vaccines, in these illustrations, m1Ψ is only specified in duplexes to emphasize its potential to influence mRNA structure.
这些研究揭示的一个重要方面是m1Ψ并不是蛋白质生产的灵丹妙药。虽然对于大多数信使核糖核酸序列,m1Ψ的表现与尿苷一样好或更好,但在某些情况下表现更差。对假尿苷也进行了类似的观察,在一项研究中发现,假尿苷与5′-UTR区含有结构化病毒内部核糖体进入位点的信使核糖核酸的蛋白质输出不相容。(57)许多不同的含m1Ψ的mRNA的有效翻译表明,这种修饰诱导的二级结构不会激活免疫传感器。这可能反映了它们相对于经典TLR3激动剂(如poly(I:C))中发现的稳定双链体的小尺寸或更大的动力学,或者m1Ψ阻碍负责免疫激活的蛋白质-信使核糖核酸相互作用的内在能力。
五、结论
新冠肺炎疫情的冲击以前所未有的规模动员了生物医学研究界,并促成了人类历史上最快速的疫苗生产过程。这一成功也对科学传播提出了独特的挑战,即如何突出这些药物背后数十年的基础研究。在本展望中,我们向科学界的非专业观众描述了m1Ψ的开发和应用,m1ψ是新冠肺炎mRNA疫苗的化学成分。修饰的核碱基有助于将信使核糖核酸疫苗从免疫系统中屏蔽,限制其不希望的免疫刺激,并且在某些情况下,还可以通过细胞的蛋白质产生机制增强抗原的合成。这使得这些疫苗能够利用信使核糖核酸翻译的自然过程,而不会引发过敏反应等有害副作用。
鉴于目前对新出现的SARS-CoV-2变异体的关注,值得强调的是合成mRNA是如何被开发用于个性化癌症免疫治疗的。(66,67)在这种方法中,临床医生切除肿瘤,对其进行测序以识别编码突变,并利用这些信息设计高水平表达这些突变肽的定制信使核糖核酸,这有助于训练免疫系统选择性攻击肿瘤组织。(68)换句话说,构建合成信使核糖核酸平台的明确目的是快速解决新发现的突变。这预示着这些药物可能被重新配置以抗击新出现的病毒株,并表明这场大流行的一个意外遗产可能是加速合成mRNA在癌症治疗中的使用。
最后,我们对m1Ψ的综述强调了化学创新可能有助于扩大治疗性信使核糖核酸覆盖范围的未来领域。首先,尽管信使核糖核酸疫苗的模块化性质引起了相当大的热情,但对其活性有贡献的元素(包括帽、编码序列、密码子、UTR和修饰)的组合空间是巨大的,并且相对较少的RNA修饰已被系统地进行了比较评估。高通量方法对于帮助定义这一空间和开发优化的代理至关重要。(69)三磷酸核苷的有效途径(70)以及最近内源性信使核糖核酸修饰研究的复兴所产生的生物学见解也可能有助于新核碱基的探索。(71,72)新的mRNA疗法的产生也可能得益于具有改进的合成财产的RNA聚合酶的进化,例如扩大的碱基耐受性或减少反义转录物的产生。用于基因组测序的DNA聚合酶的成功工程说明了这一目标的可行性和潜在影响。
大约60年前,诗人弗兰克·奥哈拉(Frank O’Hara)在《紧急情况下的冥想》(Meditations in an Emergency)一书中写道,“我是万物所需要的,因为天空必须高于地球。/最近,他们的焦虑变得如此之大,我几乎没有时间睡觉。” am needed by things as the sky must be above the earth./And lately, so great has their anxiety become, I can spare myself little sleep 奥哈拉的这段话与我们当前的时代以及患者、家人和医护人员在这场疫情期间感受到的巨大压力产生了共鸣。核碱基m1Ψ,一种“紧急情况下的修饰”,提供了一个例子,说明沉思也可以导致干预,在危机时刻提供希望和休息。
参考资料
