【1.5.1】RNA病毒中的非规范翻译(non-canonical translation,IRESes)
病毒蛋白合成完全依赖于宿主细胞的翻译机制。然而,许多 RNA 病毒转录本与细胞 mRNA 具有显着的结构差异,这些差异排除了规范翻译起始,例如缺少 5' 帽结构或存在包含复制和/或包装信号的高度结构化的 5’UTR。此外,虽然绝大多数细胞 mRNA 显然是单顺反子,但 RNA 病毒必须经常从它们的 mRNA 中表达多种蛋白质。此外,RNA 病毒具有非常紧凑的基因组,并且处于强烈的选择压力下以优化可用序列空间的使用。总之,这些特征推动了 RNA 病毒中大量非规范翻译机制的进化,帮助它们应对这些挑战。这里,我们回顾了真核生物的 RNA 病毒利用的机制,重点是内部核糖体进入、泄漏扫描、非 AUG 启动、核糖体分流、重新启动、核糖体移码和终止密码子读取( internal ribosome entry, leaky scanning, non-AUG initiation, ribosome shunting, reinitiation, ribosomal frameshifting and stop-codon readthrough )。除了重温一些经典案例外,该评论还将重点介绍最近发现的不寻常翻译策略的例子。
一、前言
没有病毒编码自己的核糖体。事实上,有人提出细胞生命和病毒世界之间的区别可以简单地基于一个实体是编码核糖体还是衣壳(Raoult & Forterre,2008 年))。然而,虽然病毒似乎几乎完全依赖于它们的宿主来提供翻译机制的组件,但它们已经进化出大量的非规范机制,以允许根据其特定需求定制翻译。事实上,特别是在 RNA 病毒中,非规范翻译似乎更多是规则而不是例外,一些单独的病毒采用几种不同的机制。在这里,我们回顾了真核生物病毒使用的不同类型的非规范翻译机制,重点是 RNA 病毒,但也包括来自逆转录病毒的例子。重点是 RNA 病毒用于访问 mRNA 中多个 ORF 的不同翻译策略。这些策略包括内部核糖体进入、泄漏扫描、非 AUG 启动(ribosome entry, leaky scanning, non-AUG initiation, ribosome shunting, reinitiation, ribosomal frameshifting and stop-codon readthrough)(图1)。尽管之前已经针对类似主题撰写了几篇出色的评论,但最近测序速度的爆炸式增长在过去几年中已经看到了许多有趣的非规范翻译新示例。除了重温一些经典案例外,本评论还将讨论其中一些最近发现的例子。
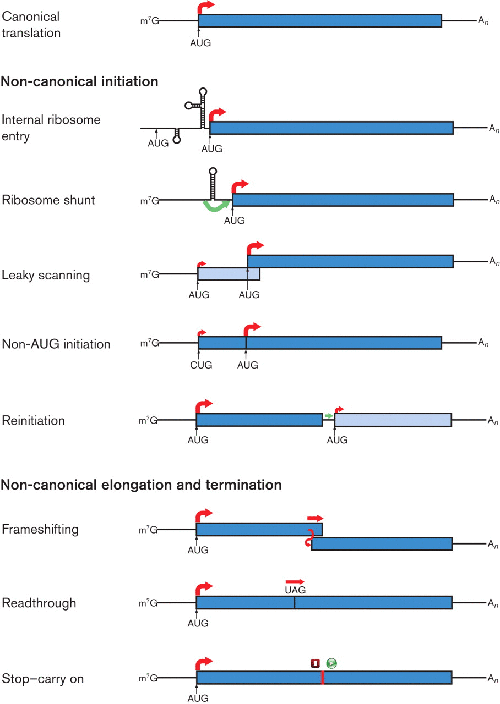
图1。 RNA 病毒使用的非规范翻译机制的例子。典型的真核 mRNA 翻译显示在顶部面板中。红色箭头表示蛋白质合成的开始(在 ORF 开始时)或 80S 核糖体继续翻译,较粗的箭头表示核糖体采用的主要路径(未按比例)。绿色箭头表示 40S 亚基可能以非规范方式运动。在合成两种不同的多肽时,ORF 以不同深浅的蓝色显示;在延伸期间的重新编码事件导致多肽的 C 端延伸时,两个 ORF 以相同颜色显示。在停止-继续机制中,终止和启动步骤都是非规范的,如红色方块和绿色圆圈所示。
二、真核生物中的规范翻译 canonical translation in eukaryotes
为了了解替代的翻译机制,首先回顾真核细胞 mRNA 翻译的标准过程是有益的,其中绝大多数具有 5' 帽结构 (m 7 G) 和 3' 聚 (A)尾巴。翻译可分为四个阶段:起始、延伸、终止和核糖体循环。
-
启动步骤(Jackson等人评论,2010) 在起始因子 (eIF) 4E 识别 5' 帽结构时开始,其募集 eIF4G(一种支架蛋白),进而与 eIF4A 和 eIF4B 以及聚(A)结合蛋白(PABP)结合。PABP 实际上结合在 mRNA 3' 末端的 poly(A) 尾部,它与 eIF4G 的相互作用导致 mRNA 环化(见下文)。由此产生的起始因子复合物募集 43S 预起始复合物,包括核糖体的 40S 亚基以及 eIF3、eIF1、eIF1A、eIF5 和三元复合物 eIF2-Met-tRNA i-GTP。这被认为主要是通过 eIF4G 和 eIF3 之间的相互作用。在募集到 5'-近端位置后,预启动复合物沿 mRNA 扫描,直到遇到第一个 AUG 密码子。扫描由解旋酶 eIF4A 及其辅因子 eIF4B 协助,它们解开 mRNA 5’UTR 中的 RNA 二级结构。起始因子 eIF1 和 eIF1A 是识别 AUG 密码子及其周围核苷酸上下文的关键。一旦 AUG 密码子被识别,eIF5 就会触发 eIF2 结合的 GTP 的水解,40S 亚基与 Met-tRNA i锁定为闭合构象在核糖体 P 位点,eIF1、eIF2-GDP 和 eIF5 被释放。然后,eIF5B 和 GTP 催化核糖体的 60S 亚基连接形成 80S 核糖体并释放 eIF5B 和 eIF1A。翻译进入延伸阶段,eIF3 及其相关的 eIF4G 被认为在此后不久被释放。
-
在延伸过程中,通过真核延伸因子 eEF1A 传递到 A 位点的同源氨酰化 tRNA 在核糖体 A 位点识别连续的三联密码子。当每个密码子在 A 位点被识别时,就会形成肽键,将新生的多肽链从 P 位点 tRNA 转移到 A 位点 tRNA。易位(Translocation),由 eEF2 催化,将 P 位脱酰化的 tRNA 传递到 E 位(从核糖体中释放出来),将 A 位肽酰-tRNA 传递到 P 位,因此也将 mRNA 移动通过核糖体和为下一轮延伸打开A位。
-
延伸一直持续到终止密码子(标准遗传密码中的 UAG、UGA 或 UAA)进入 A 位点。这些密码子被真核释放因子 eRF1 识别,它与 eRF3 和 GTP 一起,杰克逊等人。,2012 年)。
-
终止后的核糖体被 ATP 和 ABCE1 [ATP 结合盒 (ABC) 蛋白质家族的成员] 分成 40S 和 60S 亚基组分。P 位点脱酰 tRNA 和 40S 亚基从 mRNA 中的释放由 eIF3、eIF1 和 eIF1A 介导,然后认为它们仍与 40S 亚基相关。之前描述的 mRNA 环化被认为可以增强翻译,这可能是通过帮助核糖体再循环和/或通过将起始因子与信息相关联来实现的( Wells等人,1998 年; Jackson等人,2010 年)。
三、为什么非规范翻译在病毒中如此丰富?
RNA 病毒面临的主要挑战之一是规范真核翻译起始的 5' 端依赖性,这通常只允许从给定的 mRNA 合成单个蛋白质。RNA 病毒通常必须表达多种结构和酶蛋白才能完成其复制循环,并且它们已经进化出多种策略来满足这一要求。
- 有些与 5'-end-dependent 翻译兼容;例如,功能性单顺反子亚基因组 RNA(sgRNA;例如冠状病毒和长链病毒)的生产或使用大多数片段是单顺反子的分段基因组(例如呼肠孤病毒和正粘病毒)。
- 另一种常见的策略是编码长多聚蛋白,随后由病毒编码或宿主蛋白酶加工以生成病毒蛋白质组(例如 小核糖核酸病毒和黄病毒)。但是,使用这些机制会产生后果。具有分段基因组的病毒必须确保不同片段的正确包装,或者如果片段被随机或单独包装成单独的病毒粒子,则必须能够容忍特定传染性的降低。多蛋白表达可以被认为是一种利用宿主细胞可用资源的低效方式,因为成熟病毒蛋白的产生量相等,尽管酶蛋白的需求量通常比结构蛋白少得多。此外,虽然一些病毒蛋白可能由 sgRNA 表达,但可能在所有正链 RNA 病毒中,复制复合物的成分仍必须从基因组 RNA 翻译而来。
RNA 病毒也具有非常紧凑的基因组,最大的大约 30 kb(例如冠状病毒科和呼肠孤病毒科的一些成员))。因此,存在强大的选择压力来优化它们的编码能力,例如通过使用重叠的 ORF。非规范的翻译策略,如泄漏扫描、核糖体移码和替代启动,对于促进获得此类 ORF 至关重要。与典型的细胞 mRNA 相比,非规范的翻译机制也可能有助于克服许多病毒转录本中存在的显着结构差异所带来的挑战。例如,基因组 RNA 或 RNA 片段的 5’UTR 内的包装和/或复制信号可以抑制依赖扫描的翻译起始。核糖体分流或内部核糖体进入位点 (IRESes,internal ribosome entry sites) 可用于规避此类障碍。
应该指出的是,许多 RNA 病毒缺乏向其转录本添加 5' 帽和/或 poly(A) 尾的机制,并且已经进化出核糖体募集和/或 mRNA 环化的替代机制。类似地,一些病毒已经进化出蛋白质和/或 RNA 结构元件,进一步增强了病毒 mRNA 的翻译。
四、非规范启动 Non-canonical initiation
4.1 内部核糖体入口 Internal ribosome entry
IRESes 是高度组织化的复杂 RNA 结构,可将核糖体募集到 mRNA 的内部位置(Kieft综述,2008 年;Balvay等人,2009 年))。在病毒中,它们通常被用作促进翻译起始的一种方式,同时允许复制元件和/或包装信号容纳在 5’UTR 内。它们还可以使病毒 mRNA 的翻译继续进行,即使当宿主细胞翻译受到抑制时,例如通过病毒蛋白酶裂解 5'-帽依赖性翻译所需的起始因子。IRES 也可用于访问否则无法访问的内部 ORF。病毒 IRES 对起始因子的依赖程度和起始位点选择的精确度各不相同。在小核糖核酸病毒中,首次描述了 IRESes(Jang等人,1988 年;Pelletier & Sonenberg,1988 年)),已经确定了两个主要类别(I 型和 II 型),它们在结构和序列上是不同的,但通常需要大多数典型的活性起始因子,包括 eIF3、eIF4A 和 eIF4G 的 C 端结构域,除了 eIF2 –Met–tRNA i –GTP 三元复合物(由Belsham审查,2009; 其他类型的小核糖核酸病毒 IRES——例如在爱知病毒和甲型肝炎病毒中发现的那些——这里将不讨论)。
- 在那些携带 I 型 IRESes(脊髓灰质炎病毒和其他肠道病毒)的小核糖核酸病毒中,病毒多蛋白翻译的起始 AUG 位于 IRES 40S 亚基募集位点下游的一段距离,需要某种形式的扫描来定位它。
- 在心脏病毒(如泰勒氏鼠脑脊髓炎病毒)和口蹄疫病毒(如口蹄疫病毒)中发现的 II 型 IRES 中,起始 AUG 靠近核糖体入口点,几乎不需要扫描。相比之下,丙型肝炎病毒(黄病毒科)的 IRES需要较少的起始因子(eIF3、eIF5 和 eIF2-Met-tRNA i–GTP 三元复合物),直接招募 40S 亚基,并将起始 AUG 置于核糖体 P 位点,无需任何扫描(Lukavsky 综述,2009 年)。类似的 IRES 也在一些瘟病毒和 teschoviruses 中发现。在人类免疫缺陷病毒 (HIV)-1、HIV-2 和其他逆转录病毒中还描述了其他类型的 IRES(由Chamond等人综述,2010)、双旋病毒(见下文)和各种其他病毒。与此相关的是,在 eIF2 磷酸化的条件下(这会导致翻译的整体抑制,通常是对病毒感染的反应),只要 mRNA 中存在结构,就可以通过涉及细胞蛋白连接蛋白的 eIF2 独立途径进行起始将起始密码子直接定位在核糖体 P 位点(Skabkin等,2010)。这种机制已经在辛德毕斯甲病毒的 sgRNA 中得到证明,也可以发生在丙型肝炎病毒 IRES 上。
由于 I 型和 II 型小核糖核酸病毒 IRESes 不一定将核糖体直接置于特定的起始密码子上,因此它们有可能在 mRNA 的多个位点直接起始。在功能上利用第二个起始位点的一个例子发生在泰勒氏鼠脑脊髓炎病毒中,其中 156 个密码子的 ORF 在 +1 阅读框中与多蛋白 ORF 的 5' 端重叠(Kong & Roos,1991 年;van Eyll & Michiels, 2002 年)。编码 L* 蛋白的 ORF 是从位于多蛋白 AUG 起始密码子 13 nt 3' 的 AUG 密码子翻译而来的。在神经毒株中,L* AUG 密码子被 ACG 密码子取代,但仍会发生一定程度的翻译(van Eyll & Michiels,2002)。有人提出,IRES 将一部分具有扫描能力的核糖体放置在多蛋白起始密码子的 3' 端或以其他方式促进多蛋白 AUG 之外的泄漏扫描,可能会促进 L* 的翻译,尽管确切的机制尚不清楚。van Eyll 和 Michiels,2002 年)。类似定位但不相关的重叠编码序列(带有上游 ACG 起始子)似乎可能存在于 turdivirus 3(小核糖核酸病毒科,Paraturdivirus属)中。另一方面,在口蹄疫病毒中,两个框内 AUG 密码子被用作替代起始位点,以产生前导蛋白酶的不同同种型(Lab 和 Lb)(由Belsham审查,2005 年)。
另一种类型的 IRES 已在双旋病毒科 ( Dicistroviridae ) 家族成员的基因组中得到描述,该家族是感染节肢动物的正链单联病毒家族。不同寻常的是,双顺逆转录病毒具有两个不重叠的编码序列,其中每个的翻译都由不同的 IRES 指导。指导 3' ORF 编码结构蛋白翻译的基因间区域 IRES (IGR-IRES) 非常不寻常。与小核糖核酸病毒 IRESes(通常约为 450 nt)相比,它较短(通常约为 180 nt)且紧凑,但由于 RNA 假结而被优雅地折叠成可以部分模拟 E 位点和 P 位点 tRNAs 的结构,包括 P -位点密码子:反密码子双链体(图2)。IGR-IRES 与核糖体亚基结合并组装具有翻译能力的 80S 核糖体,其显着地可以在 A 位点的非 AUG 密码子上启动翻译(与常规起始中的 P 位点相反),无需任何 Met-tRNA i或任何典型的启动因素(Wilson等人,2000 年;Jang等人,2009 年))。在这种情况下,核糖体在 mRNA 上的精确放置和起始因子的缺乏似乎排除了任何形式的泄漏扫描。尽管如此,至少一组双顺反病毒(以色列急性蜜蜂麻痹和相关病毒)的成员表达来自短 ORF 的额外蛋白质,该蛋白质与 +1 阅读框中的结构多蛋白 ORF 的 5'-近端区域重叠(Ren等人。,2012)。这个 ORF 的翻译似乎是由 P 位点反密码子中额外的碱基配对相互作用指导的:IGR-IRES 的密码子模拟双链体,促进了一部分传入的 A 位点 tRNA 不与结构多蛋白起始密码子配对,而是将密码子偏移+1 nt(图2;Ren等。,2012 年)。除了双顺逆转录病毒外,许多其他病毒似乎采用了从不同的 IRESes 表达两种多蛋白的策略。犬小逆转录病毒似乎有两个小核糖核酸病毒样 IRESes,其 3' ORF 编码依赖于 RNA 的 RNA 聚合酶 (RdRp) 和其他非结构蛋白( Woo等人,2012 年),而其他几种未分类的双顺反子正链 RNA病毒可能具有类似双旋病毒的 IGR-IRES,尽管细节尚未确定,并且尚未明确排除替代翻译策略( Boros等人,2011 年)。
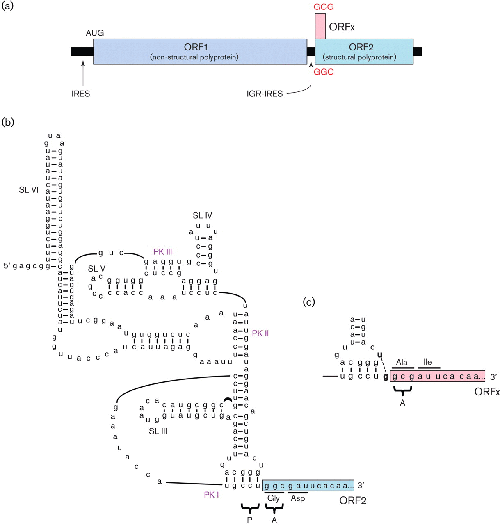
图 2。 以色列急性麻痹双旋病毒 IGR-IRES 指导两个重叠 ORF 的翻译。(a) 基因组图。不同的 IRESes 直接翻译非结构和结构多蛋白。IGR-IRES 还指导 ORFx 的翻译,在 +1 阅读框中与 ORF2 重叠。(b) IGR-IRES 的示意图,显示假结 (PK) I、II 和 III 和茎环 (SL) III、IV、V 和 VI。PK I 占据核糖体 P 位点,ORF2 的翻译起始于核糖体 A 位点的 GGC 密码子。(c) 在 PK I(UG;粗体)中形成额外的碱基对导致在 +1 框架 GCG 密码子处起始和 ORFx 的翻译。修改自 E. Jan ( Ren et al. , 2012 )友情提供的图
丙型肝炎病毒也有一个名为 core+1(或者 F 或 ARF)的 ORF,它与多蛋白 ORF 的 5'-近端区域重叠(Walewski等,2001;Vassilaki & Mavromara 综述,2009)。毫无疑问,core+1 ORF在体内表达,至少在某种程度上是这样,因为受感染的患者会产生针对 core+1 肽的抗体(Walewski等人,2001 年))。已经提出了许多不同的机制来解释 core+1 ORF 的表达,包括核糖体移码、转录滑移和 AUG 或非 AUG 密码子的独立起始。然而,尽管进行了广泛的研究,但这些机制中的哪些(如果有)被病毒利用,以及这些产品是否为病毒提供了任何功能益处,仍不清楚。
4.2 漏扫 Leaky scanning
在起始扫描模型中,40S 核糖体亚基结合靠近 5' 帽并线性扫描,直到遇到第一个 AUG 密码子(Kozak,2002)。然而,在某些情况下,很大一部分扫描核糖体未能在第一个 AUG 密码子处启动,而是继续扫描,直到它们到达更下游的替代起始密码子(Kozak综述,2002)。这个过程被称为渗漏扫描,可能允许表达单个蛋白质的多个 C 端重合亚型(框内替代起始位点)、由不同重叠 ORF 编码的不同蛋白质(不同阅读框中的替代起始位点)或不同的由非重叠顺序 ORF 编码的蛋白质。扫描的距离可能相当大——例如,在水稻 tungro 杆菌状 tungrovirus 中,核糖体扫描大约 895 nt 的区域以翻译三个连续 ORF 中的第三个(Fütterer等人,1997 年))。已经确定了其他几种情况,其中三个甚至四个不同的蛋白质从单个转录本翻译,通常涉及在非 AUG 密码子处起始(见下文),除了上下文不佳的 AUG 密码子(Turina等人,2000 年;Castaño等人。,2009年)。泄漏扫描可能是 RNA 病毒最常用于翻译功能性多顺反子信息的机制(表 1)。潜在起始密码子处的起始效率受其上下文调节,即紧接在起始密码子之前和紧接其后的核苷酸的身份。在哺乳动物中,最佳环境包括 +4 处的 G 和 -3 处的嘌呤(起始密码子本身对应于核苷酸 +1 至 +3),其中 -3 处 A 的存在是有效起始的最强单一指标(科扎克,1986 年)。 具有-3 处的A 或-3 处的G 和+4 处的G 的上下文可被视为“强”。尽管最佳环境似乎因分类群而异,但在许多动物、植物和真菌中普遍偏爱 -3 位置的 A(或 G)(Nakagawa等人,2008 年))。当消息上第一个 AUG 的上下文不是最理想的时,就有可能进行有效的泄漏扫描。
最早描述的例子之一是在哺乳动物正口病毒的 S1 段中发现的 ( Ernst & Shatkin, 1985 )。在这里,14 kDa 非结构蛋白 σ1s 的编码序列完全位于 49 kDa 附着蛋白 σ1 的编码序列内。σ1 AUG 起始密码子具有次优上下文 (cggAUGg),σ1s AUG 密码子在 +1 阅读框中位于 58 nt 3'。泄漏扫描的另一个早期例子发生在正布尼亚病毒的一小部分。在这里,NSs 蛋白是从约 100 个密码子的 ORF 翻译而来的,该 ORF 与 N(核衣壳)蛋白 ORF 的 5'-末端区域重叠(Fuller等,1983)。汉坦病毒中也存在类似的 N/NSs 排列(Vera-Otarola等,2012)。这种短的、重叠的 ORF,通常进化得相对较晚,比它们重叠的祖先 ORF 具有更有限的系统发育分布,并且编码的蛋白质往往具有辅助功能(Rancurel等,2009)。
除了围绕消息第一个 AUG 密码子的次优上下文之外,许多其他机制也可能促进泄漏扫描。如果 AUG 密码子非常接近转录本的 5' 端,那么它通常不能被有效识别,效率会随着 5’UTR 长度减少到 30 nt 以下,尤其是 12 nt 以下而降低(Sedman等人, 1990 年;科扎克,1991 年)。在鼠诺如病毒(杯状病毒科)中,与衣壳编码序列重叠的 ORF 的翻译似乎始于 sgRNA 的第三个 AUG 密码子(gugaAUGaggAUGagug AUG g 中的下划线;McFadden等人,2011 年)) 尽管存在两个上游 AUG 密码子,其中第二个处于良好的上下文中,A 位于 -3。在这种情况下,5' 前导序列(4 或 10 nt)的短小似乎很可能促进了前两个 AUG 密码子的泄漏扫描(尽管如此,它们也必须有效地用于表达衣壳蛋白)。应该注意的是,杯状病毒 RNA 缺少 5' 帽,而是具有与 5' 末端共价连接的病毒蛋白 (VPg,a viral protein)。VPg 与 eIF4E 和其他起始因子相互作用,但在鼠诺如病毒中,这些相互作用在翻译中的作用仍然不确定(Daughenbaugh等人,2006 年;Chaudhry等人,2006 年))。VPg 的存在可能促进了短前导上的 40S 绑定。
下游 AUG 密码子与前一个 AUG 密码子的接近度(例如在大约 10 nt 内)也可以提高泄漏扫描的效率。这已在 tymoviruses 和流感病毒 B 的第 6 段中得到证实(4 nt 分离;Williams & Lamb,1989;Matsuda & Dreher,2006),也可能与鼠科诺如病毒有关(见上文)。数据表明,扫描可能涉及交替的向前推力和向后松弛,因此下游 AUG 密码子有时可以捕获一部分扫描核糖体,否则可能会扫描回稍微上游的 AUG 密码子。[相反,下游 AUG 密码子的起始可能通过一种机制刺激上游 AUG 密码子的起始,该机制被认为依赖于在下游 AUG 密码子起始的核糖体后面堆积的扫描 40S 亚基,在上游起始的适当位置AUG 密码子 ( Dinesh-Kumar & Miller, 1993 )]
短上游 ORF 也可以促进泄漏扫描。翻译短 ORF 的核糖体有能力恢复扫描并在下游 ORF 上重新启动,但此类核糖体重新获取相关起始因子可能需要时间,并且可以有效地绕过一些介入的 AUG 密码子(另见标题为重新启动的部分) . 事实上,有许多泄漏扫描案例——包括 A 型流感病毒的 PB1-F2 蛋白——其中在编码功能性产物的 ORF 的起始密码子之间存在一个或多个 AUG 密码子(Chen等人,2001 年);怀斯等人,2009 年;拉辛和邓肯,2010 年)。预计此类 AUG 密码子会“吸收”一定比例的扫描核糖体——这取决于它们所处环境的强度——但是,如果 ORF 很短,这些核糖体可能仍然能够在主要的下游 ORF 上重新启动。因此,泄漏扫描的某些情况可能还包括重新启动的元素,也可能包括一定程度的分流或非线性扫描(Racine & Duncan,2010 年;参见核糖体分流部分)。扫描区域中的 RNA 结构,除了短插入 ORF 的位置、长度和氨基酸组成,都可能影响最终到达主要下游 ORF 的核糖体的比例。
4.3. 非 AUG 启动 Non-AUG initiation
真核蛋白质合成几乎完全开始(但参见上文对双顺逆转录病毒IGR-IRES 的讨论,另见Skabkin等人,2010 年),蛋氨酸由 Met-tRNA i带入核糖体,Met-tRNA i是一种不同于标准的 tRNA(延伸) Met-tRNA。然而,起始不一定发生在 AUG 密码子上。近同源密码子,如 CUG 和 ACG,在某些情况下也可以被 Met-tRNA i识别. 非 AUG 密码子的启动通常需要一个强大的背景(例如 -3 处的 A 或 G 和 +4 处的 G),并且当 RNA 结构(例如茎环)能够在起始密码子的大约 14 nt 3',因此当潜在的起始密码子位于核糖体的 P 位点时,它位于 mRNA 通道的入口(Kozak,1990;另见Clyde & Harris,2006)。已知密码子 CUG、GUG、ACG、AUU、AUA、AUC 和 UUG 允许可观的起始水平(例如 2-30%),其中 CUG 是许多系统中最有效的非 AUG 起始密码子(由Touriol等人审查)等,2003 年)。非 AUG 启动可能被细胞生物广泛用作调节机制。伊万诺夫等人。, 2008 年;英戈利亚等人。, 2011 ) 但目前尚不清楚这些监管方面是否与 RNA 病毒使用非 AUG 启动相关。
由于非 AUG 起始几乎总是相对低效,不可避免的结果是大部分核糖体将扫描经过非 AUG 起始位点,而是在下游 AUG 密码子或其他接近同源的非 AUG 密码子处启动。因此,RNA 病毒中非 AUG 起始的实例通常形成泄漏扫描机制的一部分,用于翻译蛋白质的多个 N 端延伸同种型,或来自替代阅读框的多个蛋白质(表 2)。描述的第一批非 AUG 起始病例之一发生在仙台呼吸道病毒(副粘病毒科)中。上游框内 ACG 密码子用于启动 C'(C 蛋白的 N 端延伸版本)的翻译(Curran 和 Kolakofsky,1988 年))。C' 和 C 由 ORF 编码,该 ORF 主要与 P(磷蛋白)编码序列的 5' 区域重叠,起始密码子的顺序为 C' (ACG)、P (AUG)、C (AUG)。P 的 AUG 起始密码子在 -3 处缺少嘌呤,因此所有三种蛋白质都可以通过渗漏扫描进行翻译。在相关病毒中,会产生人副流感病毒 1、C'、P 和 C 蛋白,但这里的 C' 翻译起始于 GUG 密码子,效率惊人(Boeck et al. , 1992)。鼠白血病伽马逆转录病毒的 Gag 多聚蛋白的 N 端延伸版本也已显示起始于上游框内非 AUG 密码子,在这种情况下为 CUG(Prats等人,1989 年))。N-末端延伸包括将产物引导至内质网的信号肽。虽然 AUG 启动的 Gag 是病毒粒子结构蛋白的前体,但 N 端延伸的版本并未整合到病毒粒子中,而是进行糖基化,展示在细胞表面并在病毒释放中发挥作用(Nitta等人, 2017 年)。,2010 年)。猫白血病伽马逆转录病毒的同源延伸起始于具有弱上下文的 AUG 密码子,因此可能允许泄漏扫描产生 N 端截短的同种型(Laprevotte等,1984)。

许多非 AUG 起始的例子来自植物病毒。在某些情况下,非 AUG 起始和渗漏扫描用于从单个转录本中表达三个甚至四个单独的蛋白质。一个经典案例,在水稻 tungro 杆菌状 tungrovirus(Caulimoviridae科)中,涉及三个连续的 ORF,其中第一个 ORF 的翻译起始于 AUU 密码子(由核糖体分流促进;见下文),第二个 ORF 起始于具有较差的 AUG 密码子上下文,前两个 ORF 不包含其他 AUG 密码子,尽管跨越大约 895 nt,因此也允许泄漏扫描到第三个 ORF ( Fütterer et al. , 1996 , 1997 )。第二个看起来越来越普遍的病例发生在一些家庭成员身上伞形病毒科。该家族中的许多病毒产生两种编码 3'-共末端 sgRNA——一种用于表达外壳蛋白,另一种用于从外壳蛋白 ORF 的 5' 或 3' 处的 ORF 表达额外的蛋白质。然而,Panicum花叶恐慌病毒仅产生一种编码 sgRNA,通过非 AUG 起始和渗漏扫描的组合表达四种蛋白质,包括两种类病毒运动蛋白(Turina等,2000;图 3) . 第一个运动蛋白 p8 在弱环境中具有一个 AUG 密码子;第二运动蛋白,p6.6(可能需要的数量较少;Li et al. , 1998),由 GUG 起始密码子表达;外壳蛋白和 p15(其编码序列与外壳蛋白编码序列重叠)由 AUG 密码子表达。不同寻常的是,GUG 起始密码子处于次优环境中(cuaGUGg;cf. aacCUGg 在 cocksfoot 轻度马赛克恐慌病毒中的相应位置)。玉米褪绿斑驳大粒病毒和天竺葵线型病毒(提议属Pelarspovirus)也缺乏用于外壳蛋白表达的单独 sgRNA,并且与恐慌病毒一样,这些病毒和几种相关病毒似乎也使用非 AUG 起始来表达第二运动蛋白(Castaño等人,2009 年;Scheets等人,2011 年)。
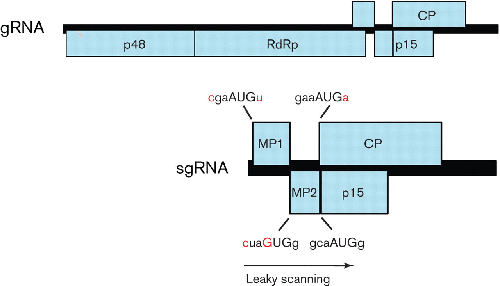
图 3。 Panicum花叶恐慌病毒的基因组图谱。MP1、MP2、CP 和 p15 都是通过泄漏扫描和非 AUG 起始的组合从单个 sgRNA 表达的。起始密码子以大写字母表示,与强起始上下文不同的核苷酸以红色表示
另一个保守但鲜为人知的非 AUG 起始案例似乎发生在反应性病毒(Alphaflexiviridae科)中。几乎所有植物病毒都编码一种或多种运动蛋白,这些蛋白有助于通过胞间连丝进行细胞间运动。对于许多植物病毒,这采用“三重基因块”的形式——一种进化上保守的模块,包含三种蛋白质,TGB1、TGB2 和 TGB3 ( Morozov & Solovyev, 2003 )。TGB 通常由 sgRNA 表达,但 TGB3(所需量远低于 TGB2)通常通过泄漏扫描从与 TGB2 相同的 sgRNA 中低效翻译(Verchot等人,1998 年;Morozov & Solovyev,2003 年))。虽然等位病毒显然含有 TGB3 编码序列,但它缺乏合适的 AUG 起始密码子(Kanyuka等,1992)。相反,在这些病毒中,TGB2 AUG 起始密码子始终具有弱上下文(-3 处的 C 或 U,+4 处的 A)从而促进泄漏扫描,并且 TGB3 翻译可能取决于非 AUG 起始。强上下文中的保守 CUG 密码子(-3 处的 A,+4 处的 G)提供了一个可能的起始位点。
4.4 核糖体分流 Ribosome shunting
虽然 IRESes 允许核糖体以 5' 端独立的方式进入信息内部,但分流允许核糖体以 5' 端依赖但至少部分独立于扫描的方式访问下游 ORF。研究最充分的例子之一出现在花椰菜病毒科的病毒中——一个感染植物的副逆转录病毒家族(Fütterer等人,1993 年;Thiébeauld等人综述,2007 年))。这些病毒从环状基因组 DNA 产生比基因组长度更长的前基因组 RNA (pgRNA)。pgRNA 作为逆转录的模板。一些成员具有从剪接或亚基因组 RNA 翻译而来的 3' ORF。然而,pgRNA一般是多顺反子-包含经由漏水扫描或者翻译几个连续的ORF(在属的成员Tungrovirus和Badnavirus ;见上文)或通过再引发(在属的成员花椰菜花叶病毒和Soymovirus ;见下文)。pgRNA 被加帽并具有长 5’UTR,预计其中大部分会折叠成大的茎环结构。一个短的 ORF 终止于茎环的上游(图 4)。翻译是 5' 帽依赖性的,并且扫描到并翻译短 ORF 的核糖体的 40S 亚基在终止时能够绕过茎环(包括例如约 480 nt,包括花椰菜花叶花椰菜病毒中的 8 个 AUG 密码子)并在茎环 3' 处的着陆点恢复扫描(Schmidt-Puchta等人,1997 年;Pooggin等人,2006 年))。据认为,这种能力取决于在短 ORF 翻译过程中保留某些起始因子的核糖体小亚基(另见题为“重新启动”的部分),但其他起始因子的(暂时)丢失促进了跨基部的不连续扫描茎环。短 ORF 的长度和位置,但不是其序列,对于分流很重要,并且必须翻译短 ORF 才能发生有效的分流(Hemmings-Mieszczak等人,2000 年;Pooggin等人,2006 年)。大茎环和 5' 相邻的短 ORF 预计存在于该家族的大多数测序成员中,这表明分流机制是该家族成员的共同特征。花椰菜病毒科(Pooggin等人,1999)。
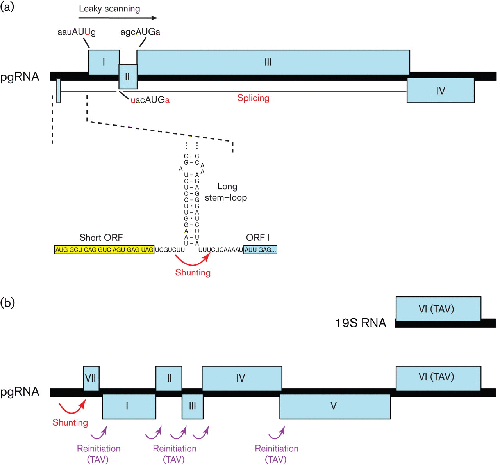
图4。
核糖体分流,再引发和漏扫描的家庭成员花椰菜病毒科. (a) 水稻 tungro bacilliform tungrovirus pgRNA 的 ORF I 的翻译是通过核糖体分流进行的。在这里,短的 5'-大多数 ORF(黄色)翻译后释放的 40S 复合物能够绕过 5’UTR(红色箭头)中的稳定茎环并继续扫描 mRNA。随后在 ORF I(非 AUG 密码子,AUU)、ORF II(弱上下文 AUG)或 ORF III(强上下文 AUG)的起始密码子处发生重新启动。ORF IV 由剪接的 mRNA 表达。(b) 在花椰菜花叶花椰菜病毒中,类似的分流机制用于访问最 5' 端的编码 ORF,VII。然而,下游 ORF I-V 是通过重新启动事件翻译的,这些事件由病毒重新启动因子、反式激活因子病毒纤溶蛋白 (TAV) 刺激,从 sgRNA 表达(见正文)。
还提出了分流和/或部分独立于扫描的机制来解释在仙台呼吸道病毒中观察到的 Y1 和 Y2 蛋白(C 的 N 端截短版本)的非规范翻译(de Breyne 等人,2004 年),σC禽正口病毒和纳尔逊湾正口病毒的 S1 段上的基因 ( Racine & Duncan, 2010 )、avihepadnaviruses 的 P (polymerase) 基因 ( Cao & Tavis, 2011 ) 和spumaviruses的gag基因 ( Schepetilnikov et al. , 2009 )。除了最后一个,这些分流病例似乎不涉及发生在花椰菜病毒科成员中的短 ORF 和 3'-相邻茎环构型。
4.5 新启动 Reinitiation
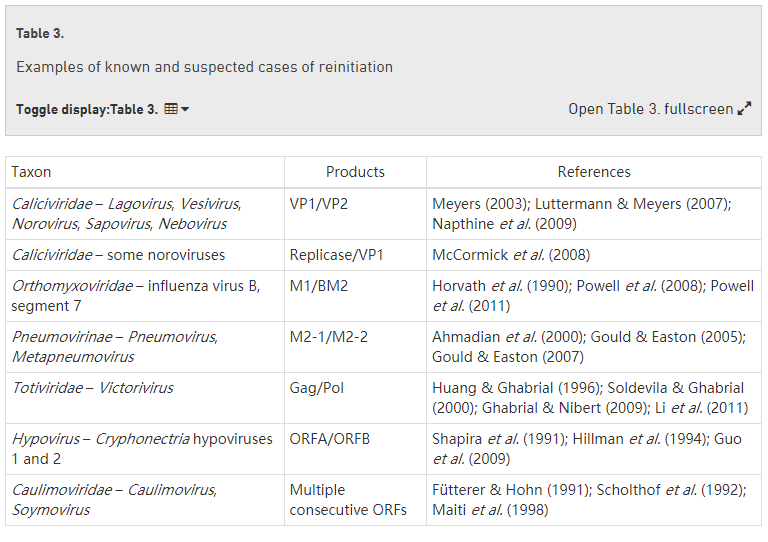
翻译终止后,核糖体的 40S 和 60S 亚基解离,通常,两个亚基都会留下信息。然而,在翻译一个非常短的 ORF(例如少于 30 个密码子)后,40S 亚基可能仍然与信息相关联,继续扫描,并在下游 AUG 密码子处重新启动翻译(Jackson等人综述,2012 年))。40S 亚基在翻译短 ORF 后保持与信息相关联的能力被认为取决于在翻译短 ORF 期间仍然附着在核糖体上的某些起始因子。在短 ORF 翻译后,核糖体的 40S 亚基不能立即重新启动,而是在扫描一段距离后变得有能力。这被认为对应于重新获得某些其他起始因子所需的时间,包括 eIF2-Met-tRNA i -GTP 三元复合物。这种短的 ORF 被认为被广泛用于细胞基因中,以调节下游蛋白质编码 ORF 的表达,以响应细胞环境(Morris & Geballe,2000 年;Ingolia等人,2011 年))。相比之下,长 ORF(例如编码功能性产物的 ORF)翻译后的重新启动要少得多,并且需要 mRNA 内的特殊信号或特定的反式作用蛋白因子(Thiébeauld等人评论,2007 年;Powell,2010 年;杰克逊等人,2012 年)。不同的病毒似乎使用了许多不同的机制(表 3)。
杯状病毒基因组通常包含至少三个编码蛋白质的 ORF:ORF1 由基因组 RNA 翻译并编码非结构蛋白,而 ORF2 和 ORF3 由单个 sgRNA 翻译并分别编码主要衣壳蛋白和一个小的碱性作为病毒粒子的次要成分的蛋白质(Herbert et al. , 1996)。在一些属(例如Lagovirus和札幌病毒),ORF2邻接于ORF1,使得一些衣壳蛋白也被从基因组RNA作为与非结构性多蛋白的融合平移,即使衣壳蛋白翻译的主要来源仍然是因组(图 5)。ORF3 位于 sgRNA 的 3' 末端,使其起始密码子非常靠近 ORF2 终止密码子(通常为 AUGnnUGA 或与 UAAUG 或 AUGA 重叠),并通过 ORF2 翻译后的重新启动进行翻译(Meyers,2003 年;Luttermann & Meyers,2007 年;Pöyry等人,2007 年;Napthine等人,2009 年)。在这里,重新启动取决于通常位于 ORF2 终止密码子上游 40-90 个核苷酸内的 RNA 序列基序。该序列区域被称为 TURBS(核糖体上游终止结合位点)并包含一个短序列基序(基序 1;UGGGA 和侧翼核苷酸),该基序与 18S rRNA 的螺旋 26(40S 的 RNA 组分)的环区域互补。亚基)。已显示基序 1 和 18S rRNA 之间的相互作用是在酵母系统中有效重新启动所必需的,其中 18S rRNA 可能会发生突变(Luttermann & Meyers,2009)。TURBS 也被证明可以结合 eIF3 ( Pöyry et al. , 2007)。据认为,终止 ORF2 翻译的核糖体的一部分 40S 亚基通过与 TURBS 的相互作用与 eIF3 连接到 mRNA 上,并且在募集 eIF2-Met-tRNA i -GTP 三元复合物后,这些亚基可能随后启动翻译ORF3的(图5)。值得注意的是,与在非常短的 ORF 后重新启动相比,不需要 eIF4G(Pöyry等人,2007 年)。B 型流感病毒似乎也使用类似的重新启动机制来翻译 BM2 蛋白(Horvath等人,1990)。在这里,M1 和 BM2 编码序列与序列 UAAUG 和上游 TURBS 重叠,包括终止密码子上游约 45 nt 并结合适当定位的 UGGGA 基序,再次对重新启动至关重要(Powell等,2011)。突变分析表明,增加 TURBS 和终止密码子之间的距离会降低重新启动效率,这可能是由于终止后 40S 亚基的束缚减少,但重新启动仍然优先发生在相对于 TURBS 的自然位置(Pöyry等人,2016)。 , 2007 ; Powell等人, 2011)。在某些情况下,如果天然重新启动位点发生突变,则在天然重新启动位点下游一定距离处的起始密码子可能会以降低的效率被利用(Powell等,2011)。也可以使用非 AUG 起始密码子,尽管 AUG 密码子在可用时是优选的(Luttermann & Meyers,2007;Pöyry等,2007)。
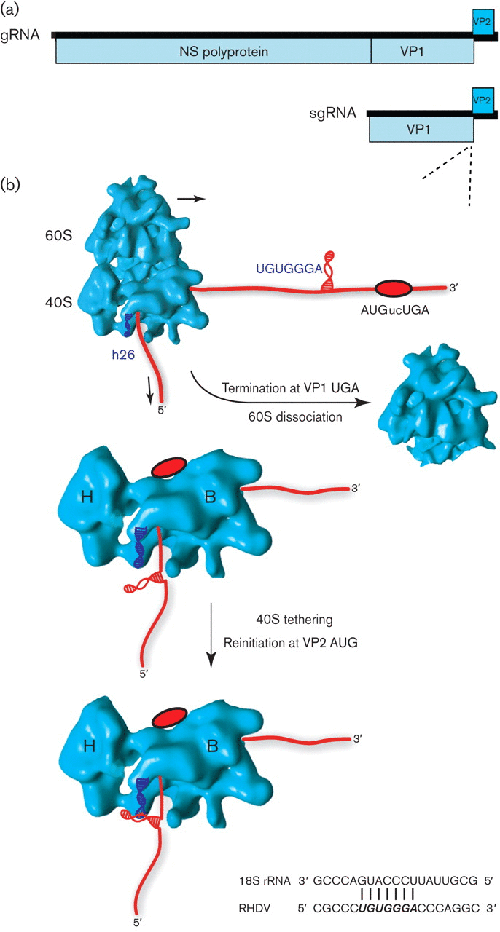
图5 5。 杯状病毒中终止-重新启动的建议模型。( a )杯状病毒兔出血性疾病兔病毒(RHDV)的基因组图谱。VP2 的表达是通过病毒 sgRNA 翻译过程中的终止-重新启动来实现的。(b) 当核糖体接近终止-重新启动位点(红色椭圆形;RHDV 中的 AUGucUGA)时,预测位于 RNA 二级结构中的含有 TURBS 基序 1(UGUGGGA)的 RNA 段被翻译并可能被重构。在终止过程中,二级结构位于核糖体的 mRNA 出口通道中[位于 40S 亚基的头部 (H) 和主体 (B) 之间] 并靠近溶剂可及的 18S 螺旋 26 (h26) rRNA(表示为蓝色螺旋)。基序 1 和 h26 中互补残基之间的碱基配对发生(显示在底部),相互作用可能被 eIF3(未显示)稳定,也已知与 TURBS 和 18S rRNA 接触。总之,这些相互作用将核糖体与病毒 RNA 联系起来,防止其解离,为起始因子的募集和随后在下游 VP2 ORF 上的重新起始留出时间。
有趣的是,尽管产生了用于 ORF2 表达的 sgRNA,但一些诺如病毒也能够通过从基因组 RNA 翻译 ORF1 后重新启动来翻译 ORF2(McCormick等,2008)。同样,这种重新启动取决于上游 TURBS。由于 ORF2 与 ORF1 相邻(见上文),某些其他杯状病毒也能够从基因组 RNA 中表达衣壳蛋白,因此假设衣壳蛋白可能在病毒感染早期在 sgRNA 产生之前发挥其他作用(麦考密克)等人,2008 年)。
肺病毒和偏肺病毒也使用终止-重新启动机制从单个转录本中表达它们的 M2-1 和 M2-2 蛋白(Ahmadian等人,2000 年;Gould & Easton,2007 年)。与杯状病毒一样,重新启动取决于终止密码子上游的序列,但涉及更大的序列区域(例如,在呼吸道合胞体肺炎病毒中实现 80% 的野生型重新启动效率需要大约 250 nt)和 TURBS -样序列尚未确定。有趣的是,重新启动 AUG 密码子可以在终止密码子上游的某个距离处(例如,在呼吸道合胞肺炎病毒中高达 29 nt,尽管也使用了两个更接近终止密码子的其他 AUG 密码子;艾哈迈迪安等。, 2000 )。在Totiviridae家族Victorivirus属的成员中,衣壳 (Gag) 编码序列翻译后的重新启动用于从单个基因组 RNA 翻译聚合酶 (Pol)——所需的数量要少得多( Li et al.,2011 年)。这两个 ORF 通常与 AUGA 或有时与 AUGnnUAG 或 UAGnnAUG 重叠。同样,上游序列——例如在维多利亚长毛孢菌 190S中至少 32nt——已被证明对重新启动很重要( Li et al. , 2011)。
虽然重新起始在上述病毒是由RNA序列部分或全部介导的终止密码子的正上游,一个非常不同的重新起始机制用于下列属的成员花椰菜花叶病毒和Soymovirus在家庭花椰菜病毒科(见标题为核糖体分流)。这里,重新起始是由病毒蛋白“反式激活viroplasmin”或TAV(介导Fütterer&霍恩,1991 ; Scholthof等人,1992 ;通过审查Thiébeauld等人,2007年)。在花椰菜花叶花椰菜病毒中,TAV 由 ORF VI 编码,该 ORF VI 由亚基因组 19S 转录物翻译而来,而其他几个连续的 ORF 则通过 TAV 介导的重新启动从 pgRNA 翻译而来(图 4)。TAV 介导的重新启动似乎不需要 RNA 转录物中的任何特定序列元素 ( Fütterer & Hohn, 1991 )。通过与宿主蛋白 TOR 和 RISP 的相互作用,TAV 被认为在上游 ORF 的翻译过程中将 eIF3 束缚在伸长的核糖体上,从而有助于下游 ORF 的重新启动(Schepetilnikov等,2011)。
五、非规范延伸和终止 Non-canonical elongation and termination
在延伸过程中起作用或通过终止信号的改变读数起作用的非规范翻译机制被称为重新编码机制(由Atkins & Gesteland审查,2010)。这些分为四个主要类别:
- 核糖体移码,其中一部分核糖体通过向前或向后移动 1 或 2 nt 被引导到不同的阅读框架中;
- 绕过,其中一部分核糖体跳过大量核苷酸并继续翻译;
- 终止密码子重新定义和通读,其中一部分核糖体未能在终止密码子处终止,而是插入标准氨基酸(通读)或非标准氨基酸,如硒代半胱氨酸或吡咯赖氨酸(重新定义);
- 停止 -继续 – 一种机制,通过防止在特定位点形成肽键来指导肽链的共翻译分离。然而,程序绕过和硒代半胱氨酸/吡咯赖氨酸插入未被感染真核生物的 RNA 病毒所利用。
5.1 核糖体移码 Ribosomal frameshifting
程序化-1 (Programmed −1)核糖体移码首先被描述为从重叠的gag和pol ORFs表达Rous 肉瘤α-逆转录病毒的Gag-Pol 多蛋白的机制( Jacks & Varmus, 1985 ; Jacks et al. , 1988 )。此后,许多其他病毒中都记录了相关信号(见表 4),包括临床上重要的慢病毒 HIV-1 和 HIV-2、人类 T 细胞嗜淋巴细胞逆转录病毒 1 和 2 型,以及导致严重急性呼吸系统综合症 (SARS-CoV) 的冠状病毒。移码在原核生物和真核生物的常规细胞基因以及其他复制元件(例如插入序列和转座子)中也越来越多地得到认可(Giedroc & Cornish综述,2009 年;Brierley等人,2010 年))。真核系统中 -1 移码的 mRNA 信号包含两个元素:具有一致 X_XXY_YYZ 的光滑序列(下划线单独的零框架密码子;XXX 代表任何三个相同的核苷酸,YYY 代表 AAA 或 UUU,Z 代表 A、C 或 U)其中核糖体改变框架,以及下游刺激性 RNA 结构(图 6;由Giedroc & Cornish审查,2009 年;Brierley等人,2010 年)。有效的移码还需要滑序列和刺激性 RNA 之间的适当间距(通常为 5-9 nt)。


图 6。 病毒 mRNA 中的程序化核糖体移码。在四个例子中的每一个中,基因组都用 ORF 图表示,移码位点的位置用虚线表示。在 SARS 冠状病毒 (a)、日本脑炎黄病毒 (c) 和大麦黄矮黄体病毒 (d) 中,RNA 假结(包括黄体病毒中的长程相互作用)刺激了移码。在 HIV-1 (b) 中,移码是由双茎螺旋刺激的,尽管上茎对移码效率做出了主要贡献。在每种情况下,滑移位点序列都带有下划线。请注意,在 (c) 中,未加工的移码产物产生截短的多聚蛋白,这与移码促进多聚蛋白延伸的其他示例不同。剪接和亚基因组 RNA 未显示,多蛋白裂解产物仅在特别相关的地方显示。“RT”表示终止密码子通读位点。
核糖体结合的肽基和氨酰基 tRNA 在光滑序列上的“串联滑动”发生在遇到刺激性 RNA 时,tRNA 与零框架密码子 (XXY_YYZ) 分离并重新-在 -1 帧 (XXX_YYY) 中配对,从而允许除摆动位置外的完美重新配对(杰克斯等人,1988 年)。作为密码子:P 位点的反密码子双链体没有像 A 位点那样严格监控(Ogle等人,2001 年)),可以容忍与经典 XXX 滑点位点的某些偏差,包括马动脉炎动脉病毒中的 GUU、昆虫特异性黄病毒中的 GGA 和脑心肌炎心脏病毒中的 GGU。刺激性 RNA 通常采用茎环或 RNA 假结的形式,并且在大多数情况下是离散的局部元件。然而,一些 3' 刺激结构有一个额外的长程碱基配对组件,可以提供翻译和复制之间的调节链接(例如大麦黄矮病毒;巴里和米勒,2002)。刺激性 RNA 如何促进移码仍然不确定,但越来越多的证据表明核糖体的内在解旋活动 ( Qu et al. , 2011)),刺激性 RNA 表现出对解旋的抵抗力,可能是通过呈现一种不寻常的拓扑结构 ( Plant & Dinman, 2005 ; Namy et al. , 2006 )。已提出未能适当解开刺激性 RNA 会诱导 mRNA 中的张力,导致密码子解偶联:反密码子复合物和 -1 框架中 tRNA 的重新排列(Plant & Dinman,2005 年;Namy等人,2006 年) .
许多正链RNA病毒、大多数逆转录病毒和dsRNA病毒的Totiviridae家族的一些成员利用-1移码来表达它们的RdRp或逆转录酶(表4)。事实上,在Betaretrovirus和Deltaretrovirus属成员的情况下,蛋白酶基因 ( pro) 被编码为单独的 ORF,表达 Gag-Pro-Pol 多蛋白需要两个移码。使用移码作为表达策略有许多潜在的优势。例如,在逆转录病毒和全病毒中,它允许病毒产生确定的 Gag : Gag-Pol 比率,该比率可能针对病毒粒子组装进行优化,并允许将复制酶轻松靶向病毒粒子核心。它还避免了为表达病毒聚合酶而产生单独的 mRNA 的需要。类似地,在许多正链 RNA 病毒中,移码可能会以相对于复制复合体其他成分的固定比例产生聚合酶(Ahlquist综述,2006)。事实上,人为改变移码效率已被证明在几种情况下会减弱(Dulude等人,2006 年;Plant等人,2010 年),尽管在 HIV-1 中,有证据表明对移码的适度刺激实际上可以增加传染性(宫内等人,2006 年)。
移码也用于表达与聚合酶无关的蛋白质。在Acyrthosiphon pisum病毒(一种与小核糖核酸病毒科病毒有远亲关系的未分类病毒中,在长多蛋白编码 ORF1 末端的 -1 移码提供了对 3'-末端 ORF2 的访问(van der Wilk等人,1997 年))。在这里,ORF1 的 3' 端编码主要病毒体蛋白 (34K),而转码融合产生次要病毒体蛋白 (66K)。在甲病毒、黄病毒的日本脑炎血清群和心脏病毒中,-1 移码提供了对与长多蛋白编码 ORF 内部区域重叠的短 ORF 的访问,以生成 N 端与多蛋白切割产物之一重合的转框蛋白(Firth等人,2008 年;Melian等人,2010 年;Loughran等人,2011 年)。在日本脑炎血清组中,移码在 NS1 蛋白上添加了一个 52 aa 的转码 C 端延伸以产生 NS1' 蛋白。在甲病毒中,移码产生 8 kDa 蛋白质,该蛋白质与 6K 蛋白质共享大约三分之二的 N 端,但具有亲水性而不是疏水性 C 端区域。在心性脑心肌炎病毒中,移码产生 128 或 129 个氨基酸的蛋白质 2B*,其中只有 N 端的 11-12 个氨基酸由零帧编码。
在一些分类群中,+1(或-2)移码似乎被用来表达病毒聚合酶。然而,在病毒中,这些机制的研究远不如 -1 串联滑移,并且仍然知之甚少,部分原因是所研究的移码效率通常似乎非常低。在成员修道院病毒科-一个家庭的大正链植物感染RNA病毒-的病毒RdRp由ORF2,这是相对于ORF1的1帧中,而许多3’的ORF是从sgRNAs翻译编码。由于产生 sgRNA 需要 RdRp,有人提出 ORF2 通过在 ORF1 末端或接近末端的 +1 移码进行翻译(Agranovsky等人,1994 年))。事实上,现在有许多高度不同的基因组序列可用,从比较序列分析中可以清楚地看出,涉及 AUG 启动的机制通常不能介导 ORF2 翻译。然而,确切的移码机制仍然是个谜。在许多长链病毒中,移码被认为发生在 ORF1 终止密码子处的高度保守的 GUU_stop_C 基序上,并且可能涉及从 GUU 到 UUU 的 +1 nt P 位点滑移,在 A 位点有解码缓慢的终止密码子。然而,在柑橘长链状病毒中,移码似乎发生在 ORF1 终止密码子上游(ORF1 终止密码子上游至少 25 个密码子的保守重叠区域和 ORF1 框同义位点的高度保守证明了这一点),卡拉舍夫等人。, 1995 年;但与Çevik, 2001 相比)。
虽然Totiviridae科的许多成员利用 -1 串联滑动来表达 Gag-Pol 融合,或重新启动以分别表达 Gag 和 Pol,但一些成员显然使用 +1 或 -2 移码。阴道毛滴虫病毒1(属Trichomonasvirus)是特别有趣。此处,ORF2 相对于 ORF1 位于 +1 框内,核苷酸序列分析表明移码最有可能发生在保守的 CC_CUU_UUU 序列上(Su & Tai, 1996 ; Goodman et al. , 2011)。值得注意的是,尽管相应的 ORF1 框架 xCC 密码子是不同分离株中的 GCC、UCC 或 ACC,但 5' CC 是保守的,这表明移码是 -2 nt 而不是 +1 nt。相比之下,在阴道毛滴虫病毒 2、3 和 4 中,ORF2 相对于 ORF1 位于 -1 框架中,并且预测 -1 移码发生在 G_GGC_CCY 七核苷酸上——该序列由于 C_CCY A 位点四核苷酸,通常不与有效的移码相关联,但对于这些病毒显然需要的低水平移码来说,这可能已经足够了。
该Amalgamaviridae -最近提出的家庭的单份双链RNA病毒(马丁等人,2011),除了利什曼原虫RNA病毒-1(属Leishmaniavirus,家庭整体病毒科;金等人,2005年),以及未分类正链RNA病毒慢性蜜蜂麻痹病毒和西奈湖病毒 1 和 2(Olivier等人,2008 年)似乎也需要 +1 滑动来表达它们的 RdRp,尽管转移位点尚未明确定位,也没有排除替代机制。
最近,在Potyviridae(最大的 RNA 植物病毒家族)的所有成员中,一个与多蛋白 ORF 的 P3 编码区重叠的短保守 ORF被证明被翻译并且对病毒感染性至关重要(Chung等人,2008 年);Wen & Hajimorad,2010 年;Wei等人,2010 年;有关早期见解,另见Gibbs & Keese,1995 年;Choi等人,2001 年)。在芜菁花叶病毒中,ORF(称为pipo) 表示为大约 25 kDa 产物的一部分,据信该产物对应于 PIPO 与 P3 的 N 端区域(即 P3N-PIPO)的融合。移码机制尚未确定,但目前的证据表明它发生在翻译水平而不是转录水平,并且很可能涉及pipo ORF 5’末端的高度保守的 GAA_AAA_A 基序(Chung等人,2008 年))。值得注意的是,GAA_AAA_A 基序相对于规范的 X_XXY_YYZ -1 串联滑移位点位于不同的框架中,表明是 +2 而不是 -1 偏移。
5.2 终止密码子通读 Stop-codon readthrough
翻译终止通常是一个高效的过程,但受存在的终止密码子(UAA、UAG 或 UGA)及其侧翼核苷酸的性质影响,尤其是紧邻的 3' 碱基(Bertram等人综述,2001 年)。一些终止密码子上下文明显“泄露”(例如 UGAC;McCaughan等人,1995 年),即它们允许以 0.3 到 5% 的频率“通读”(Bertram等人,2001 年))。在通读中,终止密码子由近同源或抑制性 tRNA 解码,翻译继续到下一个终止密码子。通读在几个病毒和细胞基因的表达中被利用,在那里它被称为程序通读(programmed readthrough, Beier & Grimm, 2001 ; Namy & Rousset, 2010 综述)。通读允许以定义的频率产生 C 端延伸的多肽。在病毒中,它通常用于表达聚合酶,但另一个常见用途是将延伸结构域附加到一定比例的外壳蛋白上。例如,在黄体病毒中,外壳蛋白基因末端的通读会产生蚜虫传播所需的蛋白质(Brault et al. , 1995)。类似地,在 benyviruses 和 pomoviruses 中,外壳蛋白延伸是通过它们的 plasmodiophorid 载体进行传播所必需的(由Adams等人,2001 年综述)。
位于抑制终止密码子 5' 和 3' 的元素会影响通读效率。终止密码子前两个位置的腺苷已被证明可以刺激通读(尽管是在酵母细胞环境中),并且是许多病毒通读案例的共同特征——尤其是在烟草病毒、杆状病毒和黄体病毒中 ( Beier & Grimm, 2001;托克等人,2004 年)。下游刺激物通常分为两类:被认为在一级序列水平起作用的 3'-相邻核苷酸,以及通常涉及 RNA 二级结构的更远侧元件。紧邻 3'-相邻核苷酸的作用可能对终止密码子的身份具有特异性(Bonetti等。, 1995 ),这可能与释放因子和与终止密码子结合的潜在近同源 tRNA 之间的竞争有关。相比之下,通常从终止密码子的 8 nt 3' 开始的 3' RNA 结构是不同类型通读的常见(但不普遍)特征。这种结构促进通读的确切机制目前尚不清楚,但可能包括通过 mRNA-蛋白质或 mRNA-rRNA 相互作用直接调节核糖体活性;通过位阻干扰释放因子功能;或者,类似于移码刺激性 RNA,通过为核糖体相关解旋酶解旋提供屏障( Qu等人,2011 年); 尽管至少一些通读刺激结构本身不会引起显着的核糖体暂停;萘普生等。,2012 年)。
在真核生物感染病毒中刺激通读的各种 3' 基序被分为三大类(拜尔和格林,2001 年;图 7;表 5)。I型基序的例子是烟草花叶病毒和其他烟草病毒。在这里,复制酶基因中 UAG 密码子的通读受到终止密码子后面的六个核苷酸的刺激,有效通读的共有基序是 UAG_CAR_YYA(Skuzeski等人,1991 年); R = 嘌呤,Y = 嘧啶)。许多其他植物病毒利用相同的基序;例如在 benyviruses 和 pomoviruses 中,通读生成病毒外壳蛋白的扩展版本。尽管 CARYYA 刺激的通读的自然情况通常涉及 UAG 密码子,但 CARYYA 也可以刺激 UGA 和 UAA 密码子的通读(Skuzeski等,1991)。II 型基序最初被定义为通常包含一个 UGA 终止密码子,后跟一个 CGG 或 CUA 三联体(Beier & Grimm,2001)。后来有人提出,此类中的大多数通读实例还涉及 3' RNA 结构组件——通常包含一个扩展的茎环结构,从终止密码子的 8 nt 3' 开始(Firth等人, 2017 年)。, 2011 年;萘普生等。,2012 年)。II 型通读发生在许多甲病毒的复制酶基因中(尽管并非所有甲病毒在其复制酶基因中都有一个内部终止密码子)、tobraviruses、pecluviruses、furoviruses 和 pomoviruses 的复制酶基因,furoviruses 的外壳蛋白延伸基因,以及结肠病毒的 VP9/VP9' 基因。

图 7。 病毒 mRNA 中的程序终止密码子通读。在四个例子中的每一个中,基因组都用 ORF 图表示,通读位点的位置用虚线表示。在烟草花叶烟草病毒 (a) 中,仅需要重新编码的 UAG 的短局部序列上下文 3' 才能有效通读。在委内瑞拉马脑炎甲病毒 (b)、康乃馨意大利环斑病毒 (c) 和鼠白血病伽马逆转录病毒 (d) 中,3' 刺激物是 RNA 二级结构:(b) 中的扩展茎环,(d) 中的 RNA 假结) 和 (c) 中的长距离碱基配对。剪接和亚基因组 RNA 未显示,多蛋白裂解产物仅在特别相关的地方显示。“FS”表示核糖体移码位点。
III 型通读基序包含更多样化的类别,但通常涉及 UAG 终止密码子、3'-相邻的 G 或富含嘌呤的八核苷酸,以及某种形式的 3' RNA 结构。在鼠白血病病毒和其他伽马逆转录病毒中,复制酶基因中 UAG 密码子的有效读取需要紧凑的 3'-相邻假结结构,并且在终止密码子和假结之间的 8 nt“间隔”区域中具有某些核苷酸的特性很重要 ( Alam et al. , 1999 ; Houck-Loomis et al. , 2011)。在黄体病毒和杆状病毒中,UAG 密码子的有效通读依赖于 3'-相邻序列,但位于终止密码子 3' 附近约 700-750 nt 的元素也很重要,并且 3' 之间的长距离 RNA 碱基配对-近端和 3'-远端元件已被认为是一种可能的机制(Brown等,1996)。在Tombusviridae家族的成员中,例如康乃馨意大利环斑墓地病毒和芜菁皱纹病毒,有效的通读依赖于大的 3'-近端 RNA 茎环结构,除了该结构与附近元素之间的长距离 RNA 碱基配对。基因组的 3' 端,3.5 kb(Cimino等人,2011 年))。类似的长距离相互作用已被预测到Tombusviridae家族中的其他属,包括坏死病毒、金黄色葡萄球菌和Panicovirus,并且有人提出长距离相互作用可能通过将翻译(RdRp)与复制联系起来而发挥调节作用。Cimino等人,2011 年)。
5.3 停止——继续 Stop–carry on
停止-继续是由氨基酸基序 D(V/I)ExNPGP 介导的,它与在核糖体出口隧道内(总共约 30 个氨基酸)的保守程度较低但功能上很重要的上游氨基酸一起阻止形成甘氨酸和最终脯氨酸之间的肽键(Donnelly等人,2001 年;Doronina等人,2008 年;Brown & Ryan评论,2010 年)。尽管如此,翻译仍可继续进行(脯氨酸作为下游产品的 N 端氨基酸),效率高达接近 100%。人们认为核糖体内新生肽的结构阻止 Pro-tRNA 在 A 位点结合,而是允许 eRF1 结合,并与 eRF3 一起释放新生肽,随后 Pro-tRNA 能够结合并进行翻译。因此,停止-继续提供了一种替代蛋白水解切割的机制,用于从单个 ORF 产生多种蛋白质产物。停止-携带盒存在于多种 RNA 病毒中,并且可能不止一次独立进化(或获得)。最著名的事件之一是在该家族几个属成员的 2A 和 2B 蛋白之间的连接处小核糖核酸病毒科,包括口疮病毒、心脏病毒、erboviruses 和 teschoviruses。在录像带上的止动进位也可发生于类群(部分的)构件Iflavirus,二顺反子病毒科,四病毒科,轮状病毒,Cypovirus和整体病毒科,用具有上盒的多个停止进一些病毒(卢克等人,2008)。
六、非规范翻译的替代方案
尽管这篇综述集中于病毒用来应对其紧凑基因组和非典型 mRNA 强加的独特约束的不寻常翻译机制,但许多 RNA 病毒已经进化出各种非翻译机制,在某些方面取得了类似的结果。如前所述,许多病毒利用 sgRNA、分段基因组和翻译后切割的多聚蛋白来表达其复制周期所需的多种蛋白质。此外,逆转录病毒,除了一小部分 RNA 病毒,包括正粘病毒(例如流感病毒)和博纳病毒,进入宿主细胞核,在那里它们利用宿主细胞剪接机制产生替代转录本。
转录滑移(transcriptional slippage)- -一个有趣的并行可核糖体移和一个完全不同的机制之间绘制由几个单份负链RNA病毒(为了利用Mononegavirales目),在亚家族特别是病毒副粘,其包括麻疹病毒(属麻疹病毒),腮腺炎病毒(属腮腺炎)和parainfluenzaviruses(属呼吸道病毒)。在这些病毒中,程序性聚合酶滑移或口吃发生在特定位点(3'-U n C m -5',在 mRNA 中转录为An G m;n + m ≥8) 在磷蛋白 mRNA 的转录过程中,导致在一定比例的转录物中有效插入一个或多个额外的 G(Kolakofsky等人综述,2005 年)。因此,mRNA 的翻译导致产生不同的 N 端重合、C 端不同的蛋白质,其相对比例由口吃位点的物种特异性细节决定。埃博拉病毒(丝状病毒科,单核病毒目;Sanchez等人,1996 年;Volchkova等人,2011 年)的糖蛋白基因中也使用了转录滑动。
翻译密码子(codon redefinition)重新定义(包括终止密码子通读)和程序化 RNA 编辑之间可能存在类似的平行关系。脊椎动物中最常见的 RNA 编辑形式是通过 ADAR 将腺苷编辑为肌苷(腺苷脱氨酶作用于 RNA;Wulff 和 Nishikura 评论,2010)。肌苷被翻译装置读取为鸟苷;因此,例如,模板化的 UAG 终止密码子随后可以在一定比例的 mRNA 转录本中编辑为 UIG,并翻译为色氨酸。丁型肝炎病毒利用这种机制的一个细微变化——一种在核内复制的亚病毒 RNA 卫星,依赖于乙型肝炎病毒的包膜蛋白,并且在不寻常的情况下依赖于细胞(通常依赖于 DNA 的)RNA 聚合酶 II 进行复制和转录。已知三角型肝炎病毒基因组仅编码一种蛋白质,称为 δAg(δ 抗原),该蛋白质以 24 kDa 和 27 kDa 两种形式进行翻译,这两种形式都是必不可少的(Taylor, 2006综述))。病毒粒子组装所需的较大形式具有 19-20 个 aa 的 C 端延伸,并且在感染后期在编码有义反基因组的 ADAR 编辑时产生。编辑被复制到新的基因组有义 RNA 并导致在转录的 mRNA 中用 UGG 色氨酸密码子替换 UAG 终止密码子(Polson等,1996)。
七、结束语
总之,很明显,RNA 病毒提供了大量令人着迷的基因表达非标准机制的例子。传统上,病毒研究主要集中在那些与人类最相关的物种上——即人类病毒和具有重要商业价值的动植物病毒,以及利什曼原虫和滴虫等人类寄生虫的病毒,以及一些模式生物的病毒,例如作为酵母和果蝇. 然而,近年来,新测序数据的获取速度呈爆炸式增长,随着测序更多地转向环境样本,有机会从更多样化的宿主(例如各种真菌、昆虫和原生生物)中采集病毒样本。 )。一些这样的病毒与已知病毒高度不同,除了先前确定的机制的许多新变体之外,还可能提供新的翻译机制的例子。对于具有不寻常成分的生物体(或细胞器)的病毒尤其如此,例如不寻常的核糖体或不寻常的 tRNA 类型和丰度。
新翻译元件的发现越来越多地由序列数据库的生物信息学分析驱动,但新的数据资源(例如全蛋白质组质谱和全转录组核糖体分析;Ingolia等人,2011 年)) 将发挥越来越重要的作用。尽管非规范翻译在 DNA 病毒和细胞基因中似乎不那么重要,但仍有许多这样的例子,从 5' 前导序列中相当常见的短 ORF 到释放因子 2 中高度保守和功能关键的移码位点,以及抗酶基因。RNA 病毒中新型非规范翻译的识别和表征将通过构建生物学可行机制的目录来帮助细胞基因组注释,并生成“搜索模式”,该模式可用作细胞和细胞的自动注释管道的一部分。病毒基因组。在这篇综述中,我们包含了一些实验细节仍然不确定的例子(例如,假设滴虫病毒中的 -2 移码和多病毒病毒中的 +2 移码),因为我们相信病毒基因组的注释者意识到这种可能性是有用的。
规范翻译规则的例外可以被编程或附带。后者可能被认为是翻译噪音,并且可能出现在一小部分翻译核糖体的所有基因中。然而,它们不受强纯化选择的影响,因此通常不会在显着的进化距离上在系统发育上得到保存。另一方面,程序化异常通常(尽管并非总是如此)涉及很大比例的翻译核糖体,并且往往会受到强烈的纯化选择和系统发育保护。毫不奇怪,在效率、功能和进化守恒的维度上存在连续性,并且非规范翻译的给定案例是程序化的还是偶然的并不总是显而易见的。
对非规范翻译的研究可以为分子生物学研究和生物技术开发极其有价值的工具。一个典型的例子是使用 stop-carry on 盒从单个转录本中等摩尔共表达多种蛋白质。非经典的翻译机制(特别是 HIV 中的移码)也被提议作为抗病毒药物的潜在靶点。如果可以证明给定的机制不用于宿主基因表达,这将特别有吸引力。最后,通过更深入地了解翻译机制可以从规范的 cap-dependent 扫描启动和三元组解码中被颠覆的程度,以及实现这种颠覆的机制,
参考资料
- Non-canonical translation in RNA viruses. https://www.microbiologyresearch.org/content/journal/jgv/10.1099/vir.0.042499-0
