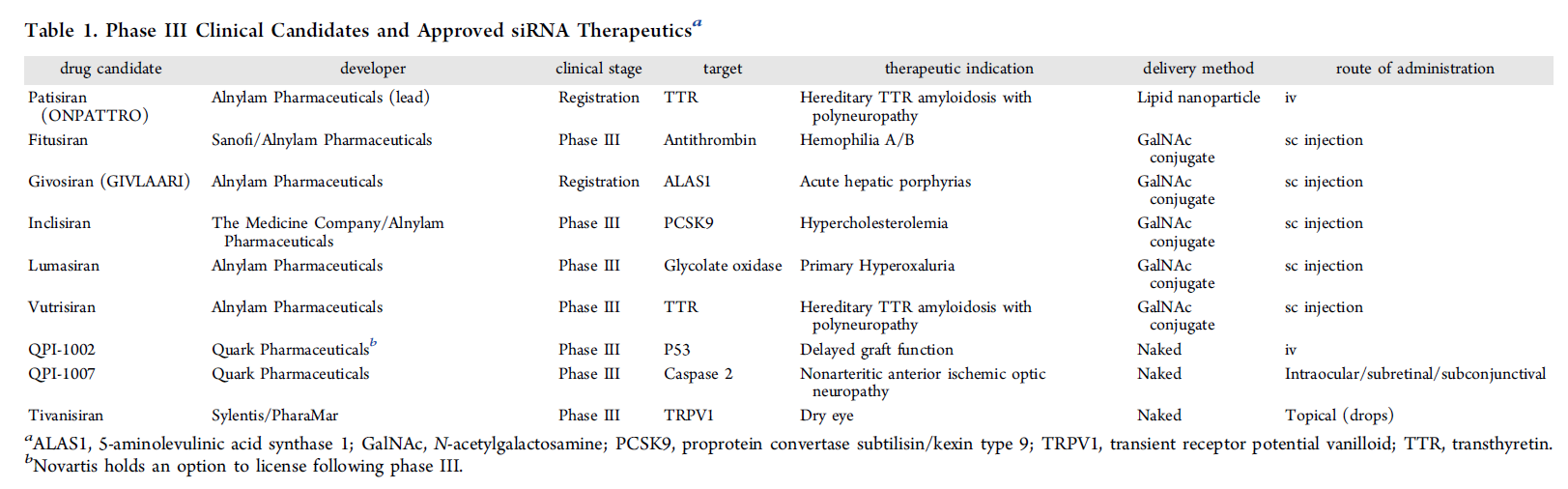
【8.1】 siRNA 设计原则和药物开发中生物转化和处置
治疗性 siRNA 是一种合成的双链 RNA (dsRNA) 分子,可通过 RNA 干扰 (RNAi) 诱导 RNA 降解。1990 年代阐明了真核生物中高度保守的 RNAi 过程的机制。(1)从一开始,RNAi 就承诺通过连接遗传密码和靶向治疗来彻底改变个性化医疗,将新的治疗方法变为现实,以对抗以前无法治愈的疾病。尽管在过去十年中存在早期开发障碍,但这种新型药物模式已获得关注。(2−4)现在有两种 siRNA 被批准用于人类使用,更多 siRNA 处于临床后期阶段(表1)。(5-9) 然而,随着每一种有前途的新兴药物方式,新的转化挑战出现了。
二、药物开发中的治疗策略和 SAR
2.1. 治疗策略和目标选择
一般的 siRNA 治疗策略是用合成反义 (AS,synthetic antisense) 序列加载 RISC,以下调具有临床相关性的特定靶标 RNA。治疗靶点包括 mRNA、pre-mRNA、长链非编码 RNA (lncRNA) 以及病毒和细菌 RNA。(10−13)与 ASO 类似,RNA 目标选择是通过识别病理情况来指导的;例如,当表达过多的蛋白质或 RNA、存在扩增的 RNA 重复、存在剪接病或一个或两个等位基因中的基因突变导致产生功能失调的 RNA 或蛋白质时。(14−17)
siRNA 治疗发展面临的主要挑战之一是向相关细胞类型的细胞溶质区室中的作用部位提供药理学相关剂量。对于灌注良好的靶组织,siRNA 在静脉 (iv) 输注或皮下 (sc) 注射后通过全身血流递送。细胞特异性递送取决于灌注水平、血浆蛋白结合、与肾脏和肝脏消除途径的竞争以及通过受体介导或体操驱动途径的被动或主动摄取。鉴于肝细胞的高血流量和丰富的肝脏特异性去唾液酸糖蛋白受体 (ASGPR),肝细胞在概念验证工作中受到青睐。(18,19)ASGPR 配体N-乙酰半乳糖胺 (GalNAc) 通常与 siRNA 共价结合用于肝脏递送。(6,20−22)图1提供了配体缀合的siRNA的sc递送示意图。siRNA 的肝外递送仍然是一个持续的挑战。(23−26) siRNA 通过内体途径进入细胞,必须先逃逸,然后再分流进入溶酶体进行降解。(27) 尽管已发表的定量数据有限,但普遍认为只有一小部分内化药物被释放到细胞质中。(28-30)

鉴于 siRNA 通过催化机制发挥作用,并在低频、低剂量方案下显示出持续的药理作用(patisiran 和 givosiran 的推荐剂量为每 3 周(iv)0.3 mg/kg 和每月一次 2.5 mg/kg( sc),分别(31,32)),理想的内源性 RNA 靶标位于周转率缓慢的细胞类型中,以最大限度地减少稀释细胞分裂。半衰期长的细胞包括肝细胞、胰岛 β 胰岛细胞和神经元细胞。(33) 因此,尽管人们对此非常感兴趣,但 siRNA 是否能有效治疗快速分裂的肿瘤细胞还有待观察。(34) 最后,还必须考虑目标 RNA 和相应蛋白质的合成和降解率。
2.2. 作用机制
siRNA 前药通过将 AS 选择性加载到 argonaute (AGO) 中进行生物活化,argonaute (AGO) 是 RNA 诱导的沉默复合物 (RISC) 的效应蛋白。RNAi 可以通过 AGO2 介导的目标 RNA 降解或 AGO“停滞”发生,通过空间上阻断对翻译机制的访问。(35) 前一种机制被认为是 RISC 最具药理学相关性的形式。(36) AGO2 介导的链选择受 dsRNA 末端的相对热力学稳定性控制。(37)SS 去除是由 AGO2 介导的磷酸二酯 (PO) 键的位点特异性水解驱动的,直接穿过 AS 的核苷酸 10-11(5'→3' 方向),导致 RISC 激活的 AS。RISC 激活可能与靶标 RNA 识别和结合有关。AS 引导的 AGO2 切割目标 RNA 是通过 RNase H 样水解机制发生的。如图2所示,这个过程可能是催化性的,AS 激活的 RISC 会经历多轮目标 RNA 降解。(35,38) 目标 RNA 特异性是通过与 AS 的完全或部分 Watson-Crick 碱基对互补来实现的。(39)
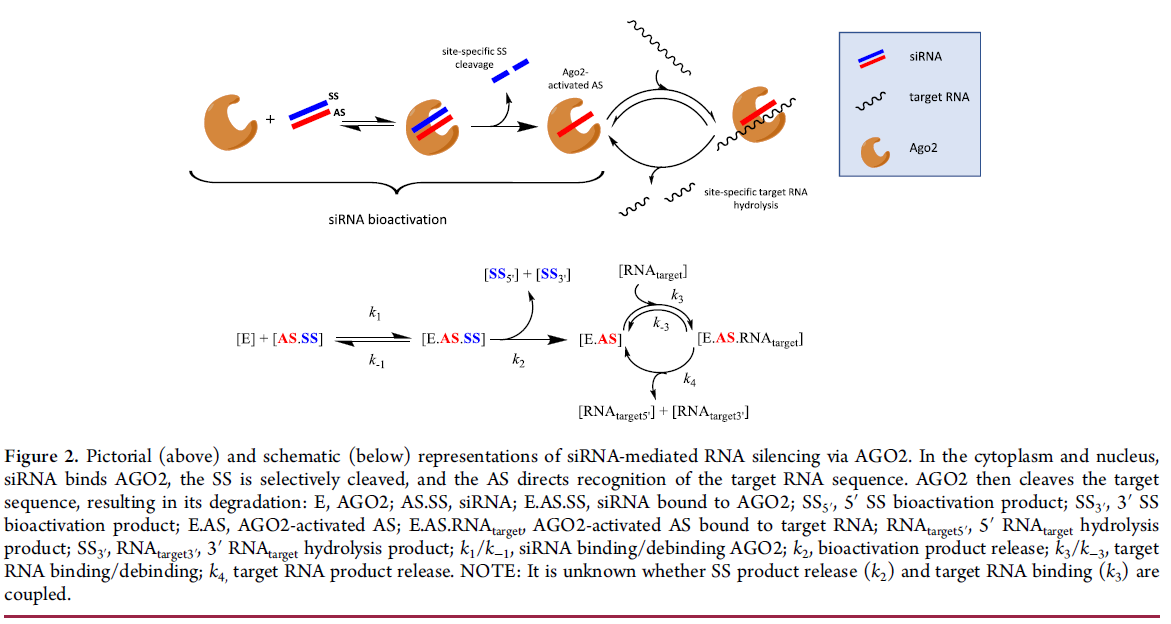
与 SM 疗法相反,SM 疗法通常通过一阶、结合介导的过程、siRNA 和越来越多的其他新兴治疗方式(如 ASO 和蛋白水解靶向嵌合体(PROTAC)通过更高阶的事件驱动过程起作用)。(40) 当试图理解 PK 和 PD 之间的关系时,这是一个需要考虑的重要概念,因为游离药物假设的线性应用并不适用。
2.3. siRNA设计原则
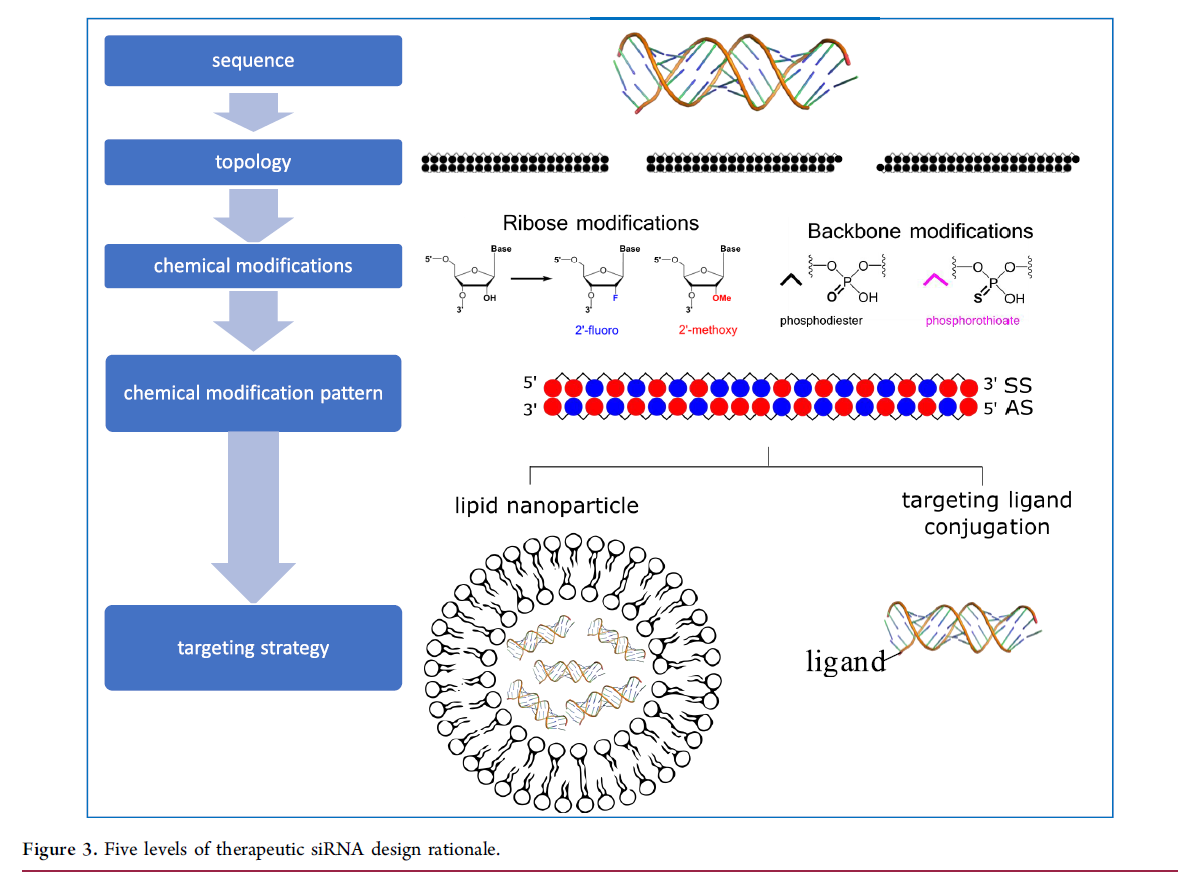
siRNA SAR 的复杂性质需要对新兴设计原则进行概述,以便为所形成的生物转化产物的母体结构和背景提供基本原理。治疗性 siRNA 包含多个级别的设计复杂性,每个级别都需要一套独特的设计原则来实现体内功效。这些级别包括核碱基序列、dsRNA 拓扑、核糖和骨架化学修饰、化学修饰模式和组织靶向;这些在图3 中进行了描述。
2.3.1. 序列
siRNA 目标特异性由 AS 链上核碱基的线性序列决定。除了目标之外,AS 还与 SS 互补,这对于稳定性和 pre-RISC 加载至关重要。(41,42)对于给定的靶标,使用先进的算法选择具有双链稳定性、靶向非结构化 RNA、最小化种子介导的脱靶效应的 siRNA 序列;与相关的临床前物种有交叉反应;并展示 RNAi 能力的最佳范围和持续时间。(43−48) 序列还可以在启动免疫反应中发挥作用。(49)
2.3.2. 双链RNA拓扑
AGO2 接受 dsRNA 底物并具有内部分子标尺,要求每条链的长度为 20-23 个碱基。(50,51)尽管有这些限制,但仍存在几种 siRNA 拓扑结构,包括单或双钝器,其中末端是一端或两端的 dsRNA。或者,siRNA 可以具有不对称末端,在 SS 或 AS 的一端或两端具有约 1-5 个 ssRNA 核苷酸突出端。(52)Ionis 还报道了 ssRNA 可以促进 RNAi;然而,还需要做更多的工作来了解这种方法的临床相关性。(53,54)
2.3.3. 化学修饰
虽然 AS 碱基序列赋予目标特异性,但治疗性 siRNA 的成功在很大程度上是由寡核苷酸化学中的“后序列”进展推动的。事实上,siRNA候选药物大部分(即patisiran)或完全(即givosiran)缺乏未修饰的核糖核苷酸。随着支持 siRNA 稳定性、靶点特异性、安全性和有效性的指导原则成为焦点,这种与内源性 dsRNA 的背离已经出现。 siRNA 设计中使用的主要化学修饰是硫代磷酸酯 (PS) 的骨架取代代替 PO 和 2'-核糖修饰用O-甲基 (2'-OMe) 或 2'-脱氧-2’代替水解敏感的羟基部分-氟 (2'-F)。PS 增加 siRNA 对核酸外切酶的稳定性,并可能增强蛋白质结合以延长循环半衰期(55)和 2'-OMe 和 2'-F 有助于双链稳定性(T m 2'-F > 2'-OMe > 2'-OH)、靶标 RNA 亲和力和靶标活性。(56−59)尽管 PS 是手性的,但大多数合成和/或纯化方案并不针对立体化学纯的 siRNA。对于 ASO,立体化学纯制剂会改变 PK-PD 特性,导致持续时间增加,而组织积累没有相应增加。(60)虽然在体内尚未报道 siRNA 中的立体 PS 修饰,但它们的掺入增强了哺乳动物细胞中的稳定性。(61)
2.3.4. 化学改性模式
尽管 siRNA 设计中使用的化学修饰的特性很重要,但这些部分沿 siRNA 分子长度的空间模式也很关键。例如,对 AS 种子区域(位置 2-8)中核苷酸的特定化学修饰可减少脱靶效应。(62−64) 在每条链的 5' 和 3' 末端核苷酸上用 PS 代替 PO 可赋予对核酸外切酶活性的抗性,并可能增强摄取和生物分布。(65,66) 减少非末端位置的总 PS 含量的努力减轻了一些在完全硫代磷酸化 ASO 中更常见的非特异性蛋白质结合依赖性毒性。(67)
2.3.5. 靶向和配方
凭借其高度聚阴离子的三维表面,由于负细胞表面的电荷排斥和被动扩散的大小限制,siRNA 不会进行快速的细胞自由摄取。各种递送策略促进主动或被动细胞摄取,其中两种不同的方法(与靶向部分的共价结合和 LNP 制剂)成为领跑者;关于这个主题已经写了几篇综合评论。(68−70)
共价结合涉及配体与 siRNA 的直接连接,通常在 SS(sense strand) 的一个末端。GalNAc 结合是受体介导的主动摄取研究最全面的例子。(71) 与胆固醇、二十二烷酸 (DCA) 和磷脂酰胆碱-二十二碳六烯酸 (DHA) 等各种脂质的结合已被证明通过假定的被动体操介导机制在组织间的分布有差异。(72) 其他正在研究的共价连接靶向部分包括肽和单克隆抗体或抗体片段。(73−75) 从可制造性的角度来看,共价结合的优点是比 LNP 更简单,但它受到靶向配体与 siRNA 可实现的化学计量比的限制。
LNP 配方是一种将 siRNA 靶向特定细胞的替代方法。LNP 是一个包罗万象的术语,用于描述 siRNA 和其他分子的混合物,它们组织成大致球形的纳米级颗粒。LNP 根据其成分的组成,通过主动或被动方式促进吸收。LNP 制剂正在迅速发展,但它们通常包含一种或多种阳离子脂质和类脂质、磷脂、聚乙二醇 (PEG) 脂质和胆固醇。(76) LNPs 已被证明通过组成型和诱导型途径进入细胞,包括网格蛋白介导的内吞作用和微胞饮作用。(28)
三、siRNA 的配置和生物转化(Biotransformation and Disposition)
。。。。。
参考资料
- https://pubs.acs.org/doi/full/10.1021/acs.jmedchem.9b01839 . 2020, Emerging siRNA Design Principles and Consequences for Biotransformation and Disposition in Drug Development
