【3.1.1.2】COVID-19的mRNA 疫苗
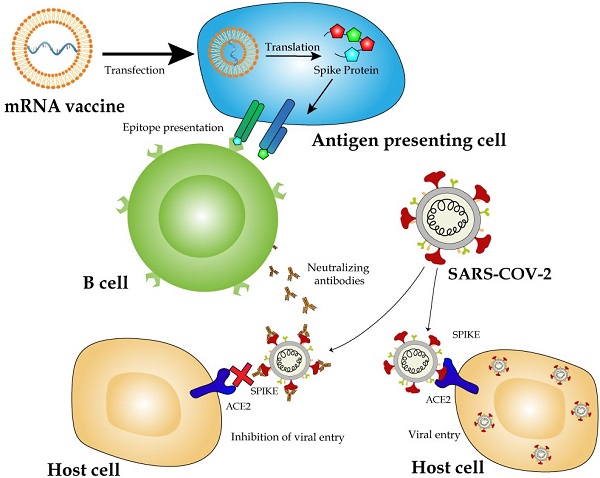
一、mRNA疫苗相对于其他疫苗平台的优缺点
与其他疫苗平台相比,mRNA疫苗具有独特的优势,包括多功能性、高效传递、利用宿主的蛋白质翻译机制和较短的开发时间
- mRNA疫苗的第一个优势是制造简单且速度快。mRNA疫苗的核心原理是传递编码靶抗原或免疫原的转录本。一旦获得编码免疫原的序列,就可以立即在同一平台上进行 RNA 合成,并且该过程可以轻松扩展和无细胞,在 mRNA 配制和制造过程中需要最小的平台变化 [ 36]。
- 其次,mRNA 疫苗在转染后通过从 mRNA 快速翻译来表达靶蛋白(抗原)。mRNA 疫苗比基于 DNA 的疫苗具有更高的生物安全性,因为抗原的翻译发生在细胞质而不是细胞核中,因此与基于 DNA 的疫苗相比,mRNA 整合到基因组中的可能性要小得多。此外,mRNA 是比 DNA 更安全的载体,因为 mRNA 携带要翻译的短序列,是一种瞬时分子,并且不与宿主基因组相互作用。
- 第三,基于蛋白质的疫苗通常由细菌生产,而 mRNA 疫苗由宿主翻译机器翻译,因此可能形成一种抗原,该抗原模拟从病毒基因组表达的蛋白质结构,包括翻译后修饰。
缺点:
- 然而,mRNA疫苗的储存和运输需要超低温,而基于蛋白质的疫苗可以在不太严格的条件下储存和运输。经测试,领先的 COVID-19 mRNA 疫苗在室温下可保持稳定长达 24 小时 [ 37 ]。因此,将数以百万计的mRNA疫苗储存和转移到温暖的国家和地区是一个巨大的技术障碍和经济负担。然而,随着脂质纳米颗粒技术的发展,mRNA 疫苗的稳定性可以在不太严格的条件下维持 [ 38 ]
二、mRNA疫苗设计的优化
2.1 mRNA疫苗的5'-加帽
内源性 mRNA 分子经过转录后修饰,包括 5'-加帽和多聚腺苷酸化,以确保 mRNA 的稳定性和有效的翻译。自然地,7-甲基鸟苷帽 (m7G) 通过 5' 到 5' 连接添加到 mRNA 链的第一个核苷酸。第一个核苷酸的核糖的 2'-OH 进一步甲基化形成 m7GpppNm,也称为 cap1。5'-加帽对于保护 mRNA 免受外切酶活性、促进前 mRNA 剪接以及作为异二聚体翻译起始复合物 eIF4F 的结合位点至关重要[ 46-49 ]。最近的研究表明 5'-帽结构是宿主可以区分自身与非自身 mRNA 分子的主要决定因素 [ 50 - 53]。迄今为止,在 IVT 期间报告的大多数 mRNA 疫苗的 5' 端都添加了一个 m7GpppNm 帽
2.2 优化 5'- 和 3'- 非翻译区和多聚腺苷酸尾的长度
5'-非翻译区 (UTR) [ 58 ] 中的调节元件和 3'-UTR [ 59 ]的长度增加了蛋白质翻译。此外,多聚腺苷酸化 (polyA) 尾部可稳定 mRNA 并增加蛋白质翻译。最近的几份报告表明,polyA 尾的长度与翻译效率密切相关 [ 60 ]
2.3 IVT 期间的核苷修饰
证明了通过修饰 mRNA 分子中的核苷来抑制 Toll 样受体 (TLR) 的 RNA 识别 [ 61 , 62 ]。将 m5C、m6A、m5U、s2U 或假尿苷结合到 mRNA 分子中,通过逃避 TLR-3、-7 和 -8 的激活来消除免疫反应 [ 61 ]。对于所有报道的七种疫苗,假尿苷被掺入mRNA疫苗中以代替尿苷。此外,在 RNA 分子中用假尿苷、m6A 和 s2U 取代可抑制 RNase L 对 RNA 的降解 [ 63 ]。因此,核苷修饰不仅增强了 RNA 的稳定性,而且降低了先天免疫反应。

设计 mRNA 疫苗的示意图。mRNA分子在体外合成,具有cap1结构(m7GpppNm),用假尿苷取代尿苷,并使用人类优选的密码子,优化了UTR和polyA尾序列。这些修饰导致 RNA 稳定性和翻译效率的增加以及免疫原性的降低。
2.4 IVT的纯化
一旦将 mRNA 疫苗引入人体细胞,IVT 过程中的污染性杂质会极大地影响其安全性。即使是残留量的双链 RNA 和 DNA-RNA 杂合分子也可以触发先天免疫反应,因为它们可以被细胞传感器模式识别受体识别。对于目前正在进行临床试验的所有七种 mRNA 疫苗,已使用各种纯化技术去除 IVT 反应中的残留杂质。先前的一项研究表明,mRNA 的纯化降低了 I 型干扰素的表达并增加了蛋白质翻译 [ 64 ]。如表2 所示,各种纯化技术,如 Oligo dT 柱、LiCl 沉淀和硅胶柱已被用于去除体外合成 mRNA 中的污染物 [ 45 ]。
2.4 密码子优化
密码子优化考虑了几个参数,这会影响翻译效率、蛋白质折叠和 mRNA 丰度。
- 一个例子是序列中的GC内容。尽管富含 GC 的序列可能对 mRNA 的二级结构形成存在问题,但富含 GC 的序列的翻译效率可以比 GC 较差的序列高 100 倍 [ 65 ]。
- 翻译延伸率在很大程度上取决于同源 tRNA 物种的可用性和密码子使用的优化,以避免与稀有 tRNA 物种匹配的序列并合并与更丰富的 tRNA 物种匹配的序列 [ 66]。此外,密码子优化对于 mRNA 稳定性至关重要,因为密码子依赖性翻译延伸率已被认为是 mRNA 稳定性的主要决定因素 [ 67 ]。从机制上讲,使用次优密码子减少 mRNA 的翻译延伸会导致募集 DEAD-box RNA 解旋酶 Dhh1p,从而触发 mRNA 衰变 [ 68 ]。另外两种密码子优化方法涉及使用具有人类偏好和最大适应指数的密码子 [ 69 , 70 ]。
- 可以探索其他生物信息学方法以进一步增强 mRNA 的稳定性,例如,通过设计二级结构和预测基于深度学习的表达水平 [ 71, 72 ]。
三、 mRNA疫苗的递送途径和工作机制
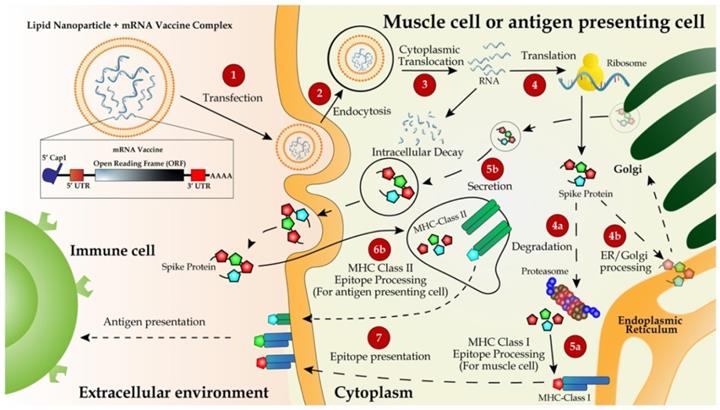
mRNA疫苗的递送和工作机制。mRNA 疫苗,含有 S 蛋白的编码区,两侧是优化的 5'-和 3'-UTR 和 polyA 尾,通过 IVT 合成,然后用 5'-cap 类似物进行 5'-加帽,并用 LNP 封装用于 IM注射(步骤 1)。疫苗通过内吞作用被递送到肌肉细胞或抗原呈递细胞(如树突细胞或巨噬细胞)中(步骤 2)。mRNA 分子从 LNP 中卸载并翻译成核糖体中的 S 蛋白(步骤 3)。新合成的 S 蛋白分泌到细胞外空间,通过内吞作用内化到抗原呈递细胞中,并作为 MHC II 类抗原呈递复合物的一部分(步骤 5b、6b 和 7)将抗原呈递给包括 T 和 B 在内的免疫细胞细胞 [ 132]。蛋白体部分降解的 S 肽被整合到 MHC I 类复合物中,然后被转运到质膜并作为抗原呈递给免疫细胞(步骤 4a、4b、5a 和 7)。
四、mRNA疫苗的细胞命运
2.1 RNA降解
mRNA 疫苗在疫苗开发阶段风靡一时,主要是由于其快速发展和设计的多功能性。然而,如上所述,mRNA 作为疫苗有两个显着的内在局限性:
- mRNA 分子的不稳定性和
- 先天免疫反应的激活。
尽管通常难以估计特定信使 RNA 在体内的降解率,但研究估计,大多数内源性 mRNA 转录物会迅速降解,通常在 10-15 分钟内 [ 92 , 93]。
两种途径降解 mRNA:
- 5'-甲基鸟苷脱帽后由 Xrn1p 介导的 5' 到 3' 核酸外切酶反应;
- 在去除 polyA 尾后,由称为外泌体的核多蛋白复合物介导的 3' 到 5' 消化,这不需要去除 5'-帽 [ 93 , 94 ]。
注射入肌肉后,合成的 mRNA 可能会被细胞外和细胞内 RNases 快速降解 RNA。由于细胞质中 mRNA 的半衰期与蛋白质表达直接相关,因此最大限度地提高 mRNA 的稳定性至关重要。5'-帽保护 mRNA 免受 5' 到 3' Xrn1p 介导的核酸外切酶的作用,并增强与真核翻译起始因子 4E (eIF4E) 的结合 [ 95]。相反,最近的一项发现表明 eIF4E 促进 mRNA 的 5'-加帽,暗示 5'-帽和翻译起始之间的密切串扰[ 96 ]。
陈等人。,表明 mRNA 衰变的速率与翻译起始的动力学成反比 [ 93 ]。因此,提高 mRNA 稳定性的一种方法是通过优化密码子使用和 UTR 序列来提高翻译效率,这适用于 mRNA 疫苗。值得注意的是,Zhang等人最近报道的一种 mRNA 疫苗 ARCoV。,可以在室温下储存至少一周,而不会影响疫苗的稳定性,这主要是由于针对核糖核酸酶的专有保护性纳米颗粒[ 86 ]。鉴于 mRNA 分子的不稳定性质,这是 mRNA 疫苗的一个重要里程碑。
2.2 疫苗中外源 mRNA 和杂质对免疫反应的潜在激活
先天免疫系统已经进化到通过有效的病原体相关分子模式 (PAMP) 防御病毒基因组和复制中间体。PAMP 通过大多数细胞类型中的模式识别受体 (PRR) 感知 dsRNA,随后激活促炎细胞因子和 I 型干扰素 (IFN) [ 97 ] 的表达。Poly (I:C) 长期以来一直用作 TLR3 激动剂来模拟病毒感染,并用作实验性疫苗的免疫刺激佐剂 [ 98 ]。与病原体的其他抗原特征(例如鞭毛蛋白或 LPS)不同,mRNA 对宿主和病原体都是常见的,因此它需要细胞机制来区分非自身 mRNA 和自身。外源引入的 mRNA 具有固有的免疫刺激性 [ 45]。因此,区分非自身mRNA和自身mRNA的原则是基于mRNA的结构区分、亚细胞定位和可用性。例如,dsRNA、3'-三磷酸 RNA、部分降解或损坏的 RNA 和 A 到 I 编辑水平代表了非自身 mRNA 的结构特征,这些特征通过 PRR [ 99 ] 激活先天免疫反应。

mRNA 疫苗体外转录 (IVT)过程中的 RNA 杂质可能触发先天免疫反应,主要是通过激活促炎基因和 I 型干扰素(图3)。主要是,作为 IVT 反应副产物的 dsRNA 和 DNA-RNA 分子与 PRR 的特定成员发生差异相互作用并诱导 PRR 相关的免疫反应。内体介导的 TLR 家族对长短 dsRNA 和 ssRNA 的感知和通过视黄酸诱导基因 I (RIG-I) 感知的胞质 dsRNA 是迄今为止最具特征的两种途径。
首先,潜在免疫刺激分子的主要来源是 dsRNA,源自 IVT 反应,其中 T7 聚合酶从无启动子的 DNA 模板转录反义 RNA,通过与有义链碱基配对形成 dsRNA [ 100 ]。dsRNA 在内体中被 TLR3 识别 [ 101 ]。或者,dsRNA 通过干扰素基因的 cGMP-AMP 合酶模拟物 (cGAS-STING) 的另一种途径诱导抗病毒反应 [ 102 ]。其次,IVT 期间产生的 DNA-RNA 杂合分子触发 TLR9 介导的 PAMP 感知以及随后在树突状细胞中激活促炎细胞因子和 I 型 IFN [ 103]。最后,病毒或外源引入的单链 mRNA (ssRNA) 分子在递送到宿主细胞后本身就是 PAMP,它还可以通过内体传感器 TLR7 和 -8 触发 I 型 IFN 产生 [ 104 , 105 ]。
此外,不同大小的部分降解的 dsRNA 可以被两种细胞溶质传感器差异识别为 dsRNA PAMP:黑色素瘤分化相关基因 5 (MDA5) 和 RIG-I [ 106 ]。为了减少潜在的先天免疫反应,IVT 后纯化已通过高效液相色谱法 (HPLC) 广泛实施,可防止 I 型 IFN 产生的激活 [ 107 ] 和快速蛋白质液相色谱法 (FPLC),可增强蛋白质的产生在原代人树突状细胞中高达 1,000 倍 [ 107 ]。
独立于针对病毒和外源 mRNA [ 108 ] 的先天细胞免疫反应,dsRNA 还触发 dsRNA 依赖性蛋白激酶 PKR 的激活,进而磷酸化 eIF2α,减少蛋白质合成 [ 109 ]。因此,dsRNA 的污染既可以触发 I 型 IFN 激活,也可以关闭蛋白质合成。此外,dsRNA 激活 IFN 诱导的 2'-5'-寡腺苷酸合成酶/RNase L 的表达,从而促进 RNA 降解 [ 24 ]。此外,mRNA 疫苗中的杂质也可以通过 TLR3 引发免疫反应 [ 110 ]。
适当纯化 IVT 合成的 mRNA 对于避免针对外源 mRNA 的细胞免疫反应和最大化蛋白质产量至关重要。此外,化学修饰的核苷(如假尿苷和 1-甲基假尿苷)的掺入使 mRNA 分子能够逃脱 TLR7 和 -8 以及其他先天免疫传感器的识别 [ 62 , 111 ]。令人惊讶的是,mRNA 分子中的假尿苷通过降低 PKR 活性来提高 ssRNA 的翻译效率 [ 112 ]。此外,假尿苷修饰的 mRNA 可以通过逃避先天免疫监视和增加蛋白质产量在原代树突细胞甚至小鼠中进行翻译 [ 62 ]。
参考资料
- mRNA vaccines for COVID-19: what, why and how。 https://www.ijbs.com/v17p1446.htm
