【8.5.1】遗传衣壳修饰允许有效重新靶向腺相关病毒2型
人类细小病毒腺相关病毒2型(AAV2)具有许多特征,使其作为基因治疗载体具有吸引力。然而,AAV2的广泛宿主范围可能代表了体内某些应用的限制,因为重组AAV载体(rAAV, recombinant AAV vector)介导的基因转移对于感兴趣的组织不是特异性的。该宿主范围由AAV2衣壳与特定细胞受体和/或共受体的结合决定。通过将配体肽遗传导入病毒衣壳,可以改变AAV2的向性,从而将AAV2的结合重定向至其他细胞受体。我们通过将14个氨基酸的靶向肽L14插入到6个不同的AAV2衣壳蛋白的推定环中,通过与已知的犬细小病毒的三维结构进行比较来鉴定,产生了6个AAV2衣壳突变体。所有突变体都被有效包装。三个突变体在衣壳表面上表达L14,一个有效感染野生型AAV2抗性细胞系,其表达由L14识别的整联蛋白受体。结果表明AAV2帽可耐受非病毒配体序列的插入。这可能为人类体细胞基因治疗的靶向AAV2载体的设计开辟了新的前景。
一、前言
为了特异性地修饰AAV2的天然趋向性,对病毒衣壳的三维结构的详细分析将是非常有用的。然而,AAV2的三维结构是未知的。此外,先前对AAV2突变体的遗传分析未确定介导AAV2与其天然受体结合的衣壳区。因此,我们基于以下假设开发了AAV2衣壳三维结构的假设模型:
- AAV2在结构上与其他细小病毒同源;
- 它的向性由非保守氨基酸决定;
- 允许AAV2重新靶向的多肽插入的区域应该是亲水的和柔韧的。
(也就是说通过在没有结构的情况下,序列比对预测其结构,然后再非保守,亲水的Loop区域来实现突变)
为了得到AAV2衣壳蛋白的一些结构信息,我们使用SOPM算法分析了已知的犬细小病毒(CPV)蛋白的三维结构,并将AAV2和CPV衣壳蛋白氨基酸序列与CLUSTALW比对。使用这种方法,我们鉴定了AAV2衣壳蛋白中的6个位点,残基261,381,447,534,573和587(图1),预计它们可以接受配体多肽的插入而不破坏对于该基因必需的病毒生命周期功能。
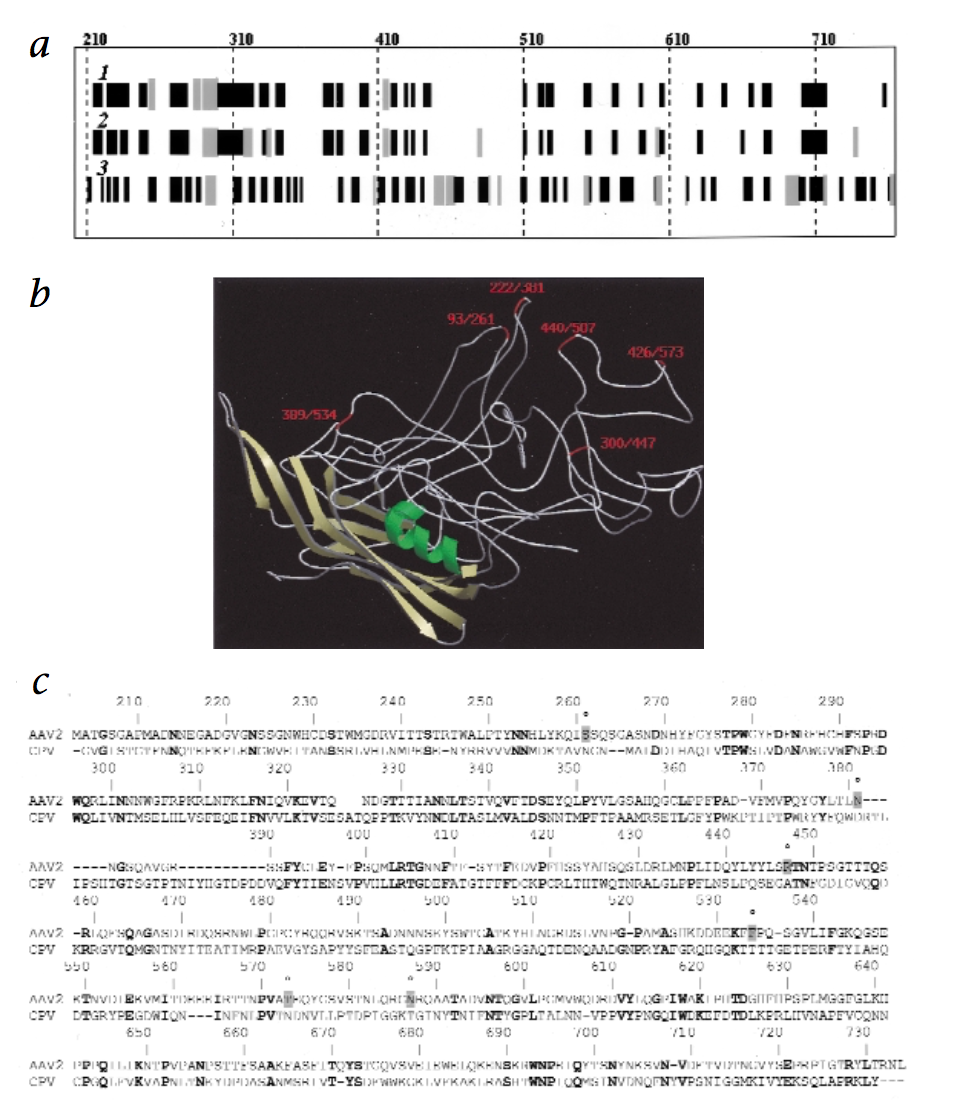
图1 AAV2衣壳蛋白中配体肽的插入位点的描述。 氨基酸从AAV2 VP1衣壳蛋白的起始密码子编号。 a,观察到CPV VP2衣壳蛋白的二级结构(第1行); 通过SOPM方法预测的CPV VP2(第2行)和AAV2 VP3(第3行)衣壳蛋白的二级结构。 黑色方框:β-折叠; 灰色方框:α-螺旋。 b,CPV VP2衣壳蛋白的拓扑结构。 红色,插入L14配体肽后氨基酸残基的位置; 数字,CPV的VP2中的位置/ AAV2的衣壳蛋白中的位置。 c,使用CLUSTAL W程序比对来自AAV2(VP3)和CPV(VP2)的衣壳蛋白的氨基酸序列。 在CPV和AAV2中同源的大胆氨基酸; ,氨基酸L14插入位点的N-末端。
为了重新靶向AAV2,我们将14-氨基酸肽L14(QAGTFALRGDNPQG)插入到这六个位点的cap基因中。 我们选择L14,它具有层粘连蛋白片段P1的RGD基序,因为它是几种细胞整联蛋白受体的靶标,也可以作为病毒受体; L14的特定二级结构不需要识别接收器; L14已成功用于重新靶向禽逆转录病毒。
我们首先分析了六种AAV2衣壳突变体(I-261,I-381,I-447,I-534,I-573和I-587)的包装病毒基因组的能力。 在HeLa细胞的包装过程中,突变体和野生型AAV2在双链体单体和二聚体复制形式的AAV2的产生中没有定量或定性差异(数据未显示)。 而且,每种突变体都可以有效地包装(表1)。 我们通过电子显微镜确认了颗粒浓度(数据未显示)。
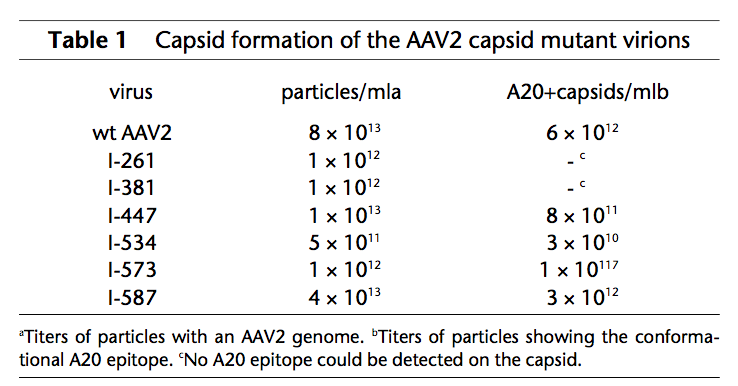
为了确定衣壳突变体的结构是否与野生型AAV2的结构相似,我们使用A20单克隆抗体进行了ELISA(酶联免疫吸附测定),其特异性地与完全组装的AAV2衣壳反应。 A20与衣壳突变体I-447,I-534,I-573和I-587反应,但不与突变体I-261和I-381反应, 表明衣壳组装体和A20表位在六种突变体中的四种中都是保守的(表1)。
我们接下来确定L14肽是否会暴露在衣壳突变体的表面。为此,我们使用针对L14的多克隆抗体进行了两种不同的ELISA(图2a)。在第一个直接ELISA中,将病毒颗粒直接连接到微量滴定板上,测量衣壳与抗L14抗体的反应性。在该测定中,所有六种衣壳突变体都与针对L14的抗体反应(图2a)。为了排除信号在病毒制剂中识别游离突变衣壳蛋白的可能性,我们进行了第二次间接ELISA,其中AAV2衣壳突变体通过A20单克隆抗体选择性地与板结合,然后加入针对L14的抗体。 在该测定中(图2a),突变体I-447,I-573和I-587显示出与针对L14的抗体的反应性类似于直接ELISA中所见的那些。突变体I-261和I-381在该测定中不能反应,因为它们未被A20包被(表1)。在间接ELISA中突变体I-534不与抗L14的抗体反应,表明在直接ELISA中获得的该突变体的信号反映了游离突变体衣壳蛋白的检测。这些结果表明六种突变体中的至少三种(I-447,I-573和I-587)在衣壳表面上呈现L14肽。
……
总之,我们的研究代表了我们所知的第一个成功的尝试,即对于将AAV2的病毒向性重新靶向通常对AAV2感染具有抗性的细胞的帽蛋白的插入突变。 这表明靶向AAV2载体的遗传受体是可能的,并且为人体细胞基因治疗的靶向AAV2载体的设计开辟了新的途径,特别是对于体内方案。
二、方法
2.1 衣壳蛋白结构分析
所有蛋白质序列分析均在NPS @(Network Protein Sequence @nalysis,URL: http://pbil.ibcp.fr/NPSA )的万维网上进行。通过使用Smith和Waterman算法扫描NRL-3D数据库,发现了与AAV2相关的CPV VP2衣壳蛋白(蛋白质数据库,2CAS)。观察到的CPV VP2衣壳蛋白的二级结构,是通过在得到的晶体学数据原子坐标2CAS文件上使用经典DSSP算法(图1a,第1行)。通过SOPM方法(图1a,第2行)确定相同蛋白质的预测的二级结构。观察到的和预测的二级结构的比较产生了约84%的预测准确度水平(472个正确预测的残基超过563个残基),表明SOPM算法为该蛋白质家族提供了非常精确的结果。因此,AAV2,VP3的相应衣壳蛋白的序列被选择为相同的SOPM算法(图1a,第3行)。两种蛋白质序列(CPV VP2和AAV2 VP3)的预测二级结构的比较表明两种蛋白质具有相似的拓扑结构,允许使用CPV衣壳蛋白结构作为AAV2衣壳蛋白的粗制模板。在用RASMOL程序分析CPV VP2衣壳蛋白的三维结构后,鉴定了该蛋白中的六个区域暴露在病毒衣壳表面上并且预期足够灵活以接受肽序列的插入(图.1b)。通过比对CPV VP2衣壳蛋白的序列和AAV2,VP3的相应衣壳蛋白鉴定AAV2 VP3衣壳蛋白上的相应区域(图1c)。我们排除了插入的描述位点不被预测为AAV2衣壳蛋白的常规二级结构元件的可能性(图1a),其中插入会使衣壳不稳定。
。。。。(各种实验过程略)
参考资料
- 1999 . Genetic capsid modifications allow efficient re-targeting of adeno-associated virus type 2
