【2.4.3.3】增加ADCC和CDC活性
随着现代生物技术的发展和完善,抗体药物已经成为增长最快的治疗药物,在生物技术制药领域占有重要地位。抗体,也叫免疫球蛋白(Ig),是一种能特异性结合抗原的糖蛋白,人体内表达的Ig主要有5种:IgM、IgA、IgD、IgG和IgE,其中IgG含量最多。
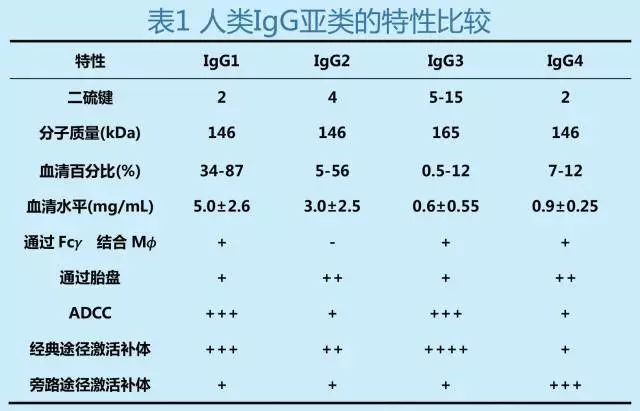
而IgG又有四个亚类,其特点见表1,抗多糖类抗原的活性主要取决IgG1和IgG2,而抗蛋白质和抗病毒抗体有IgG1、IgG3、IgG4参与。其中IgG1在人体内表达最多,另外IgG1在人类血清的半衰期最久,长达21天。
IgG1呈Y字形结构,见图1,包含两条相同的重链(约55kDa)和两条相同的轻链(约25kDa)组成,这四条多肽链通过疏水作用结合在一起,并由二硫链连接。其中重链由VH、CH1、铰链区、CH2和CH3组成,轻链由VL和CL组成。另外,抗体的N端糖基化修饰发生在抗体CH2区的天冬酰胺Asn297位上,分别由N-GlcNAc、甘露糖、岩藻糖和半乳糖构成。
从抗体作用机制来讲,抗体由抗原结合部位(Fab)和可结晶部位(Fc)构成。Fab段可以与特定的抗原结合,由此决定抗体的特异性和亲和力;Fc段可以与免疫细胞表面表达的Fc受体(FcγRI,FcγRII,FcγRIII)、血液中的补体(C1q)和FcRn结合,从而激活免疫效应清除外来物等。

图1 抗体基本结构及其与FcγR、C1q、FcRn的结合区域
抗体的结构决定其作用机制,其Fab段可以识别游离分子(VEGF、TNF等)靶点和细胞表面的受体(CD20、CD19等),决定抗体对外来入侵物如癌细胞等的特异性识别;而Fc段决定抗体的效应功能,包括:
- 抗体依赖的细胞毒性作用(Antibody-dependent cell-mediated cytotoxicity,ADCC)
- 补体依赖的细胞毒性作用(Complement-dependent cytotoxicity,CDC),ADCC和CDC作用机制见图2。
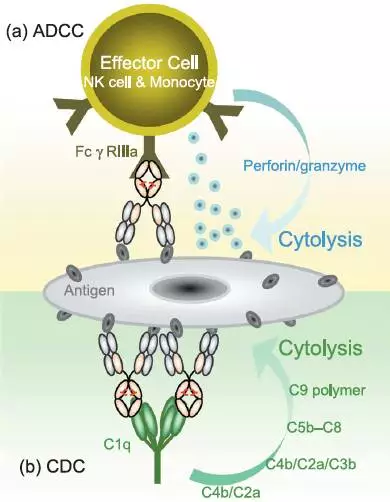
图2 由Fc段驱动的ADCC和CDC作用机制
一、ADCC
当抗体通过抗原结合部位结合肿瘤细胞表面抗原以及Fc部位结合免疫效应细胞表面Fc受体时,免疫效应细胞得到激活,杀死肿瘤细胞,这个过程称为ADCC。Fc受体主要有三种:FcγRI (CD64)、FcγRII (CD32)、FcγRIII (CD16),其中后两种又可分为:FcγRIIa、FcγRIIb、FcγRIIc、FcγRIIIa、FcγRIIIb。不同的免疫细胞表达特定的Fc受体,如中性粒细胞通常表达FcγRI、FcγRII、FcγRIIIb,而NK细胞只表达FcγRIIIa。FcγRIIIa通常认为是引起ADCC的关键受体,所以虽然NK细胞、单核巨噬细胞和中性粒细胞都可以产生ADCC作用,但是NK细胞被认为是最重要的细胞种群。
很多临床研究都证明ADCC作用是肿瘤抗体发挥效用的主要方式,如trastuzumab和alemtuzumab。抗体介导的ADCC强弱和许多因素有关,如抗体与抗原的亲和力、抗体与Fc段受体的亲和力、免疫效应细胞的特性等。一般情况下,对抗原或Fc受体亲和力高的抗体介导的ADCC作用越强。对抗体进行改造,提高其对Fc受体的亲和力是提高ADCC作用的直接、快速和有效的一个途径。如何增强ADCC活性已经成为下一代抗体治疗的主要课题之一。
很多研究都表明,对抗体Fc段的糖基化及氨基酸序列改造可以提高ADCC活性。Stavenhagen的研究团队应用酵母呈现系统筛选了大量的Fc突变体,发现了一个拥有5个突变(F243L,R292P,Y300L,V305I和P396L)的突变体对FcγRIIIa的亲和力提高了10倍,同时也具有更强的ADCC活性。在抗体的糖基化修饰中,岩藻糖被认为是影响ADCC活性最重要的糖,去岩藻糖化可以显著提高抗体与FcγRIIIa的亲和力及ADCC活性(高达100倍)。如图3,Tsuguo Kubota团队通过基因手段将CHO细胞的FUT8基因敲除,用这种细胞生产的抗体不含岩藻糖残基,具有很强的ADCC活性,且细胞的生长及蛋白表达不受影响。

图3 抗体的去岩藻糖化及其对ADCC活性的作用
二、CDC
补体是存在于人或脊椎动物血清与组织液中的一组不耐热的,经活化后具有酶活性的蛋白质,包括30余种可溶性蛋白和膜结合蛋白。CDC指的是补体参与的细胞毒性作用,即补体(C1-C9)通过特异性抗体与细胞膜表面相应抗原结合,形成复合物而激活补体经典途径形成攻膜复合物对靶细胞发挥裂解效应。
CDC作用是由抗体与补体C1q的首先结合引起的,接着C2-C9就被激活形成攻膜复合物对靶细胞发挥裂解效应。很多抗肿瘤抗体都可以引起CDC作用,如抗CD20、CD52、CEA等抗体。
学者对于如何提高CDC活性已有很多研究。Idusogie EE等利用丙氨酸扫描突变技术研究了抗CD20抗体rituximab的CDC功能,找到CH2结构域中与C1q结合的位点Asp270、Lys322、Pro329和Pro331,经改造后可以增加与C1q的结合和CDC活性。除对CH2结构域的氨基酸进行改造外,铰链区的氨基酸调整也可以明显增加C1q的结合和CDC活性。
在上面的表1中可以看到,IgG3的经典途径激活补体活性最高。如图4,Tsuguo Kubota团队通过基因突变将替换IgG1和IgG3的重链恒定区序列构建IgG1/IgG3混合抗体,令人感到意外的是,这种抗体表现很强的C1q的结合和CDC活性。在体外实验中,抗CD20的IgG1/IgG3混合抗体的CDC活性是野生型rituximab的几十倍。

图4 通过构建IgG1/IgG3混合抗体增强CDC活性
值得一提的是,如果对某一抗体通过去岩藻糖化提高其ADCC活性,而通过调整重链恒定区序列提高CDC活性,可以在即不影响ADCC活性又不影响CDC活性的情况下获得活性更强的抗体。
参考来源
- https://mp.weixin.qq.com/s?__biz=Mzg3OTE3NjA4Nw==&mid=2247511647&idx=5&sn=389e48e6379272648379215c8783d574&chksm=cf0a9ea7f87d17b125a3c1ee861d2d2244139252e523b91b83f1e8d8341c5ae49aefe38cd37f&scene=126&sessionid=1620965701&key=3cff6956ae19a5af0d73765b49540bd677b5384b9f7a8c9ac4f13ab8c161f0c40603aee2c6cb2d776cbd2562190fe7ffa125a7772371e1e3c280859a393fdf71d9de01032b8311a4a386064133eb94cb465f36f2e8534de3997f9754f4de3ee01830ec8d54b07fe75016f3ae396079815e9aa76dd33b7c3eb2445177499fbbd0&ascene=1&uin=OTA1MTkzMTAw&devicetype=Windows+10+x64&version=6302019a&lang=zh_CN&exportkey=AZW90dpr67XJFWzyFPZ8cco%3D&pass_ticket=KcVtcvu1UtaNCEc8PkIfP%2FlMHckyYQAJSqQwBhi4K1Eza2sNRdCMzPu20g9WboVR&wx_header=0&fontgear=2 *《抗体理论与技术》; *《抗体药物研究与应用》;
- Improving effector functions of antibodies for cancer treatment: Enhancing ADCCand CDC;
- Engineered therapeutic antibodies with improved effector functions。
