【1.3.4】免疫细胞--抗原递呈细胞
一、抗原递呈细胞
待补充
二、抗原的加工和提呈
抗原提呈细胞(APC)加工提呈的抗原主要分为以下两类:
-
一类是通过巨胞 饮、吞噬或吞饮等作用,被 APC 从细胞外摄入胞内的抗原,如细菌和某些可溶性 蛋白等称之为外源性抗原(exogenous antigen);
-
另一类是在细胞内产生的抗原, 如病毒感染细胞内产生的病毒抗原和肿瘤细胞内产生的肿瘤抗原等,称之为内源 性抗原( endogenous antigen)。 根据抗原来源和性质的不同,可将APC对抗原 的加工提呈途径分为以下四种:
-
内源性抗原加工提呈途径(经典 MHCI类分子途 径)、
-
外源性抗原加工提呈途径(经典 MHCII类分子途径)、
-
MHC 分子对抗原的交 叉提呈途径(非经典 MHC 分子途径)
-
CD1 分子对脂类抗原的提呈途径。
2.1 内源性抗原的加工提呈过程
内源性抗原加工提呈途径简称内源性途径(endogenous pathway),又称胞 质溶胶途径(cytosolic pathway)或经典 MHC-I 类途径。抗原提呈细胞对内源性 抗原的加工和提呈过程如图 11-2 所示,简述如下:
- 细胞内合成的内源性蛋白 抗原在胞质内首先与泛素结合形成泛素化蛋白,在泛素作用下线性化内源性蛋白 抗原进入蛋白酶体。
- 蛋白酶体(proteasome)是胞质内一种大分子蛋白水解酶 复合体,为内含多种蛋白水解酶的中空圆柱体结构,其中蛋白酶体β亚单位-8、 9(proteasome subunit beta type-8、9, PSMB-8、9)是蛋白酶体中具有重要酶 活性的组分,线性化内源性抗原经其作用降解后可成为有助于 MHC-I 类分子识 别结合的多肽片段(抗原肽)。
- 上述内源性抗原肽能与内质网膜上抗原加工相 关转运体 1/2(transporter associated with antigen processing 1/2, TAP1/2)组成的异 二聚体结合,并以 ATP 依赖的方式主动运输到内质网腔内。
- MHCI类分子的 α链和β2 微球蛋白(β2m)在内质网中生成:α链产生后立即与钙联素(calnexin) 结合,使其不被降解而有助于β2 微球蛋白与之结合,并在形成完整 MHCI类分 子后与钙联素分离。
- 内质网中空载 MHCI类分子首先与伴侣蛋白复合体,即 钙网素(Calreticulin)、内质网蛋白 57(ERp57)和 TAP 相关蛋白组成的复合体 结合,并通过 TAP 相关蛋白(Tapasin)与 TAP 异二聚体结合,而使空载 MHC I类分子驻留在内质网抗原肽入口处。
- 胞质中抗原肽通过 TAP 异二聚体进入内质网后,进一步被内质网氨肽酶(ER aminopeptidase, ERAP)加工,使之成为 适合于 MHCI类分子抗原肽结合槽识别结合的由 8-12 个氨基酸组成的抗原肽; 同时使 MHCI类分子暴露并与上述抗原肽结合形成内源性抗原肽-MHCI类分 子复合物。
- 上述内源性抗原肽-MHCI类分子复合物以分泌囊泡形式进入高尔 基体,经糖基化修饰后以胞吐方式表达于 APC 表面,供 CD8+T 细胞识别启动适 应性细胞免疫应答。
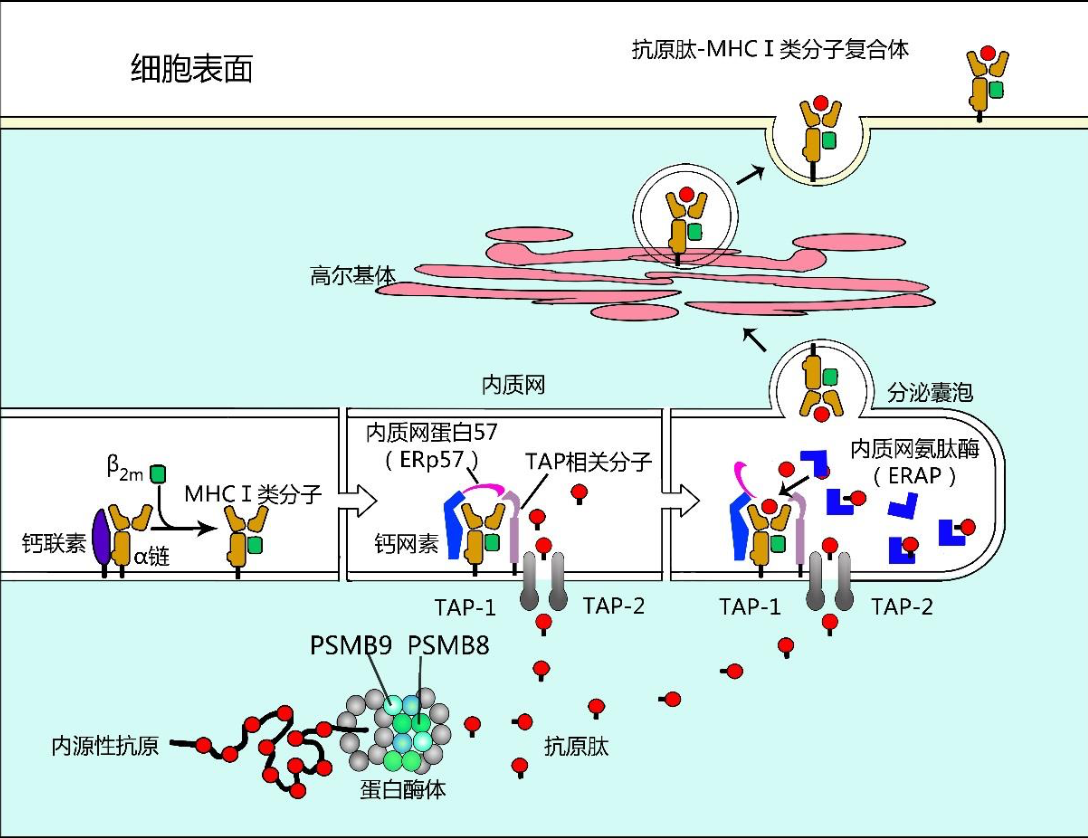
内源性抗原的加工提呈示意图
2.2 外源性抗原的加工提呈过程
外源性抗原加工提呈途径简称外源性途径(exogenous pathway),又称溶酶 体途径(lysosome pathway)或经典 MHCII类途径。抗原提呈细胞(APC)对外 源性抗原的加工和提呈过程如图 11-3 所示,简述如下:
- 外源性蛋白抗原被 APC 摄入胞内最初形成的囊泡称为早期内体(early endosome);早期内体在向胞质深 处移动过程中逐渐发育成熟为晚期内体(later endosome), 此时囊泡内 PH 值降 低呈酸性,蛋白酶活化,可将外源性蛋白抗原初步降解为较大多肽片段。
- 晚期内体与溶酶体(lysosome)融合形成内体/溶酶体,在其内酸性环境中多种蛋白水解 酶作用下,上述蛋白裂解片段进一步降解为适合于 MHCII类分子结合的由 13- 18 个氨基酸组成的抗原肽。
- MHCII类分子和 Ia 相关恒定链(Ia-associated invariant chain, Ii)在内质网中生成:恒定连能与 MHCII类分子抗原肽结合槽结 合,从而有效阻止进入内质网中的内源性抗原肽与 MHCII类分子结合;并引导 MHCII类分子进入高尔基体,形成一种内含恒定链-MHCII类分子复合物和相关 酶类物质的酸化内噬囊泡(acidified endolytic vesicles)。
- 上述内噬囊泡在向内 体/溶酶体移动过程中,其内恒定链逐级降解,而将II类相关恒定链肽(class II associated invariant chain peptide, CLIP)滞留在 MHCII类分子抗原肽结合槽内, 形成 CLIP-MHCII类分子复合物。
- 此种内噬囊泡与内体/溶酶体融合后,在胞 质内形成一种特化的胞内囊泡,称之为 MHCII类器室(MHC ClassII compartment ,MIIC)。
- 在 MHCII类器室内 HLA-DM 分子协助下,首先将 CLIP 与 MHCII类分子解离,然后使外源性抗原肽与空载 MHCII类分子结合形 成抗原肽-MHC II类分子复合物, 并通过胞吐作用与细胞膜融合、使外源性抗原 肽-MHC II类分子复合物表达于 APC 表面,供 CD4+Th 细胞识别启动适应性免 疫应答。

外源性抗原的加工提呈示意图
2.3 MHC 分子对抗原的交叉提呈
抗原交叉提呈途径是指 APC 将摄入胞质内的外源性抗原通过 MHCI类分子提 呈给CD8+CTL细胞或将内源性抗原通过MHCII类分子提呈给CD4+T 细胞的抗原加 工提呈途径。上述抗原交叉提呈途径不是抗原加工提呈的主要方式。目前对抗原 交叉提呈的作用机制还不十分清楚,摘要介绍以下几种观点。
(1)外源性抗原的交叉提呈:
- 某些外源性蛋白抗原可从内体或内体/溶酶 体中逸出而进入胞质,致使上述外源性蛋白抗原能以内源性抗原加工提呈方式表 达于 APC 表面,供 CD8+CTL 细胞识别。
- 内体/溶酶体中形成的抗原肽通过胞吐 作用被排出细胞外后,可直接与 APC 表面空载 MHCI类分子结合形成外源性抗原 肽-MHCI类分子复合物,被 CD8+CTL 细胞识别。
(2)内源性抗原的交叉提呈:
- 在应激情况下,某些胞质内蛋白可形成自 噬体(autophagosome);后者与内体/溶酶体融合可使上述内源性蛋白抗原进入 外源性抗原加工提呈途径。
- 内质网中 Ii 链发生突变不能有效封闭 MHCII类分 子抗原肽结合槽,而使进入内质网腔中的内源性抗原肽与 MHCII类分子结合形成 内源性抗原肽-MHCII类分子复合物,后者移行到APC表面可被CD4+T 细胞识别。
2.4 CD1 分子对脂类抗原的提呈
经典 MHC 分子主要提呈蛋白质抗原,而不提呈脂类抗原。CD1 分子不是经典 MHC 基因编码的产物,较少多样性;但其结构与经典 MHCI类分子类似,也是由 一条重链(α 链)和一条轻链(β2m)通过非共价键连接组成,因此又称 MHCI 类样分子。CD1 分子在 APC 内质网中产生,其主要功能是识别结合外源性和自身 脂类抗原,并以脂类抗原-CD1 分子复合物形式表达于 APC 表面,供 NK T 和 γδT 等细胞识别,使之活化产生细胞毒作用和分泌 IL-4 或 IFN-γ 等细胞因子发挥免 疫调节作用。
CD1 分子对脂类抗原的加工和提呈过程还不十分清楚。目前研究发现 CD1 分 子在结构上与经典 MHCI类分子类似,但其对病原体脂类抗原的加工提呈方式却 与经典 MHCII类分子类似,即富含脂类抗原的病原体被 APC 摄取降解后产生的脂 类抗原是在 MHCII类器室中与空载 CD1 分子结合组成脂类抗原-CD1 分子复合物, 然后通过胞吐作用将上述复合物表达于 APC 表面,供 NK T 和 γδT 细胞识别。
2.5 专职抗原提呈细胞对 CD4+/CD8+T 细胞的激活作用
外周免疫器官和淋巴组织是免疫应答发生的场所。CD4+/CD8+T 细胞进入外周 免疫器官后,首先通过表面黏附分子与专职 APC 表面相应黏附分子发生非特异可 逆性结合,从而为上述 T 细胞表面 TCR-CD3 复合受体与 APC 表面相应抗原肽- MHCII/I类分子复合物的特异性结合创造了条件。在 CD4+/CD8+T 细胞与 APC 短暂 密切的接触过程中,T 细胞通过表面 TCR-CD3 复合受体分子,从 APC 表面众多抗 原肽-MHCII/I类分子复合物中挑选出相应的抗原肽-MHCII/I类分子复合物,并 在与之特异性结合后启动适应性免疫应答。
1.树突状细胞和巨噬细胞对
CD4+/CD8+T 细胞的激活作用 上述专职 APC 对 CD4+/CD8+T 细胞的激活作用如图 11-4 所示:CD4+Th 细胞和 CD8+CTL 通过表面 TCR- CD3 复合受体与上述 APC 表面相应抗原肽-MHCII/I 类分子复合物特异性结合后, 可通过 CD3 分子将抗原刺激信号传至胞内,诱导产生 T 细胞活化第一信号;CD4 和 CD8 分子作为 TCR 辅助受体,能与上述 APC 表面提呈抗原肽的 MHCII/I 类分子 的 β2/ α3 结构域结合,从而增强 CD4+Th 细胞和 CD8+CTL 表面 TCR-CD3 复合受体 与 APC 表面相应抗原肽-MHC II/I 类分子复合物(pMHC)的结合力度,并使细胞 表面 TCR-CD3 复合受体与 CD4/CD8 辅助受体分子胞质区尾肽聚集,导致与尾肽相 关的 lck 蛋白酪氨酸激酶活化,有效促进 T 细胞活化第一信号的产生。
在 T 细胞与 APC 结合相互作用产生活化第一信号基础上,二者表面某些黏附 分子聚集在TCR-pMHC周围构象改变形成免疫突触(immunologycal synapse), 使上述细胞粘附分子间的亲和力/作用时间显著增强/延长,成为诱导产生 T 细胞 活化第二信号的共刺激分子。此时 CD4+Th/CD8+CTL 细胞通过表面 CD28、LFA-2、 LFA-1 等共刺激分子,分别与 APC 细胞表面相应 B7、LFA-3、ICAM-1 等共刺激分 子结合相互作用,可诱导产生 T 细胞活化第二信号、使 CD4+Th 细胞和 CD8+CTL 活 化。

T 细胞活化双信号示意图
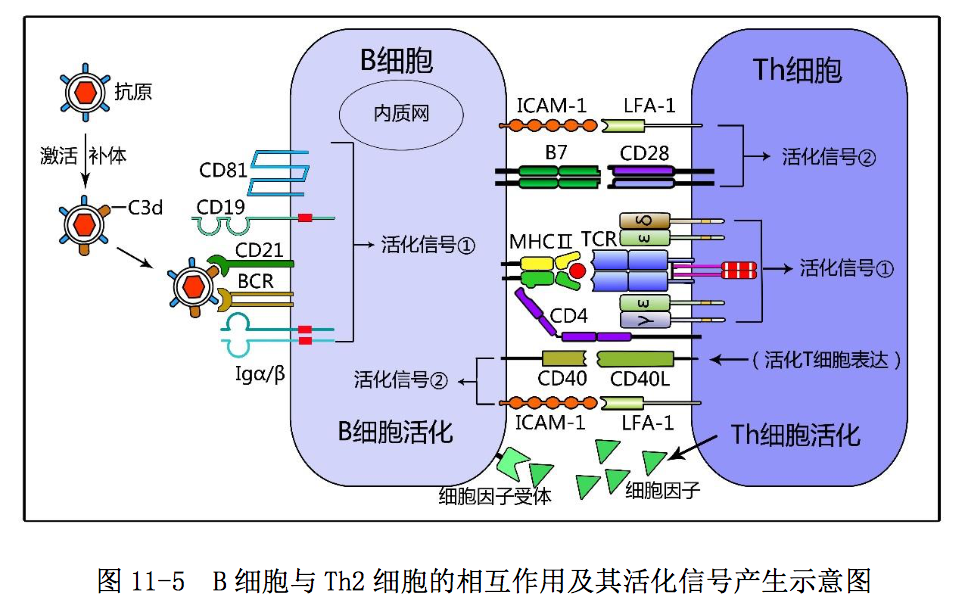
2.B 细胞对 CD4+Th2 细胞的激活作用和二者间的相互作用
B 细胞是具有抗原加工提呈能力和执行特异性体液免疫应答的免疫细胞。B 细胞作为专职抗原提呈细胞,通过表面 BCR-Igα/Igβ复合受体识别摄取抗原后, 可经外源性抗原加工途径将T细胞识别的线性抗原表位,以抗原肽-MHC II类分 子复合物的形式表达于 B 细胞表面,供抗原特异性 CD4+Th2 细胞识别。B 细胞对 CD4+Th2 细胞的激活作用如图 11-5 所示:CD4+Th2 细胞通过表面 TCR-CD3 复合受 体和 CD4 辅助受体与 B 细胞提呈的抗原肽-MHCII 类分子复合物特异性结合,可 诱导产生 T 细胞活化第一信号;通过表面 CD28 和 LFA-1 等共刺激分子与 B 细胞 表面相应 B7 和 ICAM-1 等共刺激分子结合,可诱导产生 T 细胞活化第二信号,使 CD4+ Th2细胞活化、表达CD40L和IL-2R等多种细胞因子的受体;同时分泌IL- 4、IL-5 和 IL-6 等 Th2 型细胞因子,为活化 B 细胞增殖分化奠定了基础。
B 细胞作为参与执行体液免疫应答的适应性免疫细胞,通过表面 BCR-Igα /Igβ复合受体和 BCR 辅助受体(CD19-CD21-CD81 复合体)识别结合抗原-C3d 复 合物后,可诱导产生 B 细胞活化第一信号;通过表面 CD40 和 ICAM-1 等共刺激分 子与活化 CD4+Th 细胞表面 CD40L 和 LFA-1 等共刺激分子结合,可诱导产生 B 细 胞活化第二信号使 B 细胞活化(图 11-5),表达 IL-4R、IL-5R 和 IL-6R 等多种 细胞因子受体,为其进一步增殖分化做好准备。
参考资料
- 《医学免疫学》课件 新乡医学院 宋向凤、张国俊、徐春阳、孙爱平、孙书明、赵铁锁等老师
