【5.2.3.6】疏水作用层析
疏水作用层析(HIC)分离蛋白质主要是基于它们疏水性的不同。它常在蛋白质纯化工艺的中期使用。在HIC中,蛋白质在高离子强度的缓冲液中与固定相结合,因此,无需更换缓冲液或者洗脱液即可在离子交换色谱之后直接应用HIC。同样,HIC也可以跟在通过用盐类沉淀快速去除部分而非全部蛋白质的硫酸铵沉淀步骤之后实施。HIC有时在纯化工艺的前期使用,有时也作为最后一个步骤来去除目标蛋白中的微量杂质。
溶液中存在的盐离子可能导致蛋白质的部分去折叠,暴露出部分常规情况下隐藏于内部的疏水残基。当加入离子强度较低的缓冲液时,结合到固定相的蛋白质恢复到原折叠结构。由此,可减少其可与固定相相互作用的疏水残基的暴露,有利于蛋白质从固定相上洗脱下来。因为蛋白质可以随着离子强度的降低而自动地再折叠回原结构,所以HIC是一种非常有价值的一种蛋白质纯化手段。
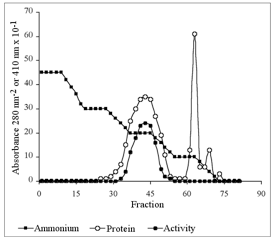 图 8. 逐渐降低盐(硫酸铵)浓度梯度从疏水柱上洗脱下的蛋白质。
图 8. 逐渐降低盐(硫酸铵)浓度梯度从疏水柱上洗脱下的蛋白质。
收集的组分需进行蛋白浓度和目标蛋白特异性活性的检测。根据蛋白质活性检测结果,目标蛋白的浓度在第45组组分中达到最高。
离子强度应该尽量低,使其可以促使目标蛋白结合,同时又不会导致蛋白质沉淀。如果结合所需离子强度高到导致目标蛋白的沉淀,可以使用略低的离子强度。这种情况下,层析过程可以将所有结合蛋白质与穿透的未结合目标蛋白分离开。
在层析柱上样前,固定相必须用高离子强度的缓冲盐平衡(蛋白质样品所使用的相同的缓冲液),然后柱上上样,并淋洗一段时间后,再用较低离子强度的缓冲液将蛋白质洗脱(图 7、8)。

图 7. 疏水作用层析。
在高离子强度下,蛋白质部分去溶剂化,使其通常隐藏在内部的疏水部分更多地暴露出来。这些残基会与介质上的疏水官能团发生疏水相互作用。降低离子强度可以使蛋白质重新隐藏其疏水部分,折叠回复原结构。这会降低蛋白质与固定相之间的疏水相互作用,完成蛋白质的洗脱。
疏水作用层析的固定相是由交联的琼脂糖或合成的共聚高分子的骨架组成。骨架上共价连接上烷基或者芳香基的配体,以便与疏水性分子产生特异性相互作用。
官能团的种类包括:
-
烷基 - 不同长度的碳氢链结构,通常为丁基或者辛基。固定相的结合能力随着烷基链的增长而增加 [31] 。官能团结合蛋白的能力主要是基于蛋白质的疏水性
-
芳香基 - 一种由芳环衍生而来的官能团,通常为苄基。芳香基的特异性通常更高,因为蛋白质还可以通过基本的堆积作用与该官能团相互作用。
每一种蛋白的结合和洗脱缓冲液所用盐的种类和浓度都应经由实际实验确定。此外,蛋白质的再折叠和活性在洗脱后都必须得到保证。
和其他柱层析类似,优化HIC工艺时也需要解决大量的问题。每一种蛋白都需要调节缓冲液条件和固定相以保证获得最优化的分离。
参考
