【5.1.2】用于 mRNA 疫苗的纳米材料递送系统(LNP)
最近 mRNA 疫苗在 SARS-CoV-2 临床试验中取得成功的部分原因是脂质纳米颗粒递送系统的开发,该系统不仅在肌肉注射后有效表达 mRNA 编码的免疫原,而且还起到佐剂和疫苗反应原性的作用. 我们概述了 mRNA 递送系统,然后重点介绍了当前 SARS-CoV-2 疫苗临床试验中使用的脂质纳米颗粒。该综述最后分析了 mRNA 疫苗中脂质纳米颗粒的性能决定因素
一、前言
COVID-19 大流行将 mRNA 疫苗推到了生物技术和制药行业的中心舞台。由 BioNTech/Pfizer、Moderna、CureVac、Sanofi/TranslateBio, Arcturus/Duke-NUS Medical School in Singapore, Imperial College London, Chulalongkorn University in Thailand, and Providence Therapeutics 领导的 8 项 mRNA 疫苗人体试验正在进行中 [ 1 ]。值得注意的是,其中两项试验已经公布了中期 3 期试验结果,该结果报告了在 2 剂 30 µg 或 100 µg 编码刺突蛋白免疫原的 mRNA 序列后,SARS-CoV-2 感染减少 94% 以上的功效, 在脂质纳米颗粒中递送 [ 2 , 3]。疫苗开发的速度也超出了预期,这些结果发生在 SARS-CoV-2 序列公开后仅 10 个月。这一成功不仅证明了生物技术和制药行业有能力应对紧迫且未满足的全球需求,而且证明了 mRNA 作为一种药物形式(在这种情况下是预防性疫苗)的固有能力。本综述的目的是概述 mRNA 递送系统的发展,然后总结 SARS-CoV-2 mRNA 疫苗的临床前和临床发现,并将它们与有助于其成功的递送系统特征联系起来。
与其他药物形式(包括小分子、DNA、寡核苷酸、病毒系统和蛋白质(包括抗体))相比,信使 RNA 疗法具有许多优势和若干挑战。
-
与寡核苷酸和大多数小分子药物靶点相比,介导刺激和抑制作用模式以及表达或替换有缺陷的蛋白质的能力扩大了其使用的潜在适应症范围。
-
与 DNA 相比,mRNA 只需要进入细胞质核糖体翻译机制而不是细胞核,并且不会冒基因组整合的风险。
-
与蛋白质和病毒系统相比,mRNA 制造是无细胞的,速度更快,并且蛋白质产品具有天然糖基化和构象特性。
-
mRNA 平台固有的挑战是其固有的免疫原性、对酶促降解的敏感性以及裸露 mRNA 的细胞摄取水平几乎可以忽略不计。mRNA 的先天免疫原性是由于 Toll 样受体 (TLR)、解旋酶受体,包括视黄酸诱导基因 I (RIG-I) 样受体 (RLR) 对单链和双链 RNA 的细胞检测,和其他 [ 18 , 19 ],然后通过 NF-κB 和干扰素 (IFN) 调节因子 IRF3 和 IRF7 发出信号,IRF3 和 IRF7 易位到细胞核与 I 型 IFN 基因启动子结合,诱导 I 型干扰素 (IFN- α 和 IFN-β),伴有促炎细胞因子,如肿瘤坏死因子-α(TNF-α)、IL-6 和 IL-12 [ 20]]。分泌的干扰素通过其受体和同一细胞和相邻细胞中的 JAK/STAT 通路发出信号,以激活 300 多个 IFN 刺激基因,包括蛋白激酶 PKR,作为一般的病毒防御机制。虽然这种激活可能有利于对 mRNA 疫苗产生免疫反应,但一个直接的影响是通过 eIF2a 的 PKR 磷酸化下调翻译,这会损害 eIF2 活性,抑制 mRNA 翻译,从而抑制免疫原的蛋白质合成 [ 21 ]。消除这种先天免疫反应的主要方法是替换天然存在的核苷,例如 1-甲基假尿苷 [ 22]] 和其他存在于转移中的核苷和核糖体 RNA(但通常不在 mRNA 中)进入 mRNA 序列,然后使其无法通过这些先天免疫传感器检测到 [ 23 , 24 ]。这种核苷修饰的免疫沉默 mRNA 平台是 mRNA 技术的基础,这些 mRNA 技术最近在 BioNTech/Pfizer 和 Moderna SARS-CoV-2 疫苗试验中显示出超过 94% 的效力,建立在之前针对其他病原体的试验的基础上,详细描述以下。CureVac 追求的第二种方法是序列工程,涉及密码子优化和尿苷消耗 [ 25 ],因为 TLR7 和 TLR8 主要识别富含 GU 的单链 RNA 序列 [ 26]]。
-
mRNA 疗法的第二个挑战是它对核酸酶的敏感性,例如在血清中的半衰期 <5 分钟 [ 27 ]。尽管 siRNA 的化学修饰在提高稳定性和降低免疫原性方面非常成功 [ 28 ],但迄今为止,由于翻译机制对这些修饰的敏感性,它们在 mRNA 上还没有成功 [ 29 ]。
-
mRNA 的第三个挑战是在大多数细胞类型中缺乏对裸 mRNA 的细胞摄取 [ 30 ],但未成熟的树突细胞除外 [ 31]]。
-
最后两个挑战通过将核苷修饰或序列工程化的 mRNA 结合到递送系统中来解决,该系统既保护 mRNA 免受酶攻击,又促进细胞摄取。例如,与在动物模型中施用的裸 mRNA 相比,掺入脂质纳米颗粒可保护 mRNA 免受酶促攻击,并将细胞摄取和表达提高多达 1000 倍 [ 32 , 33 ]。
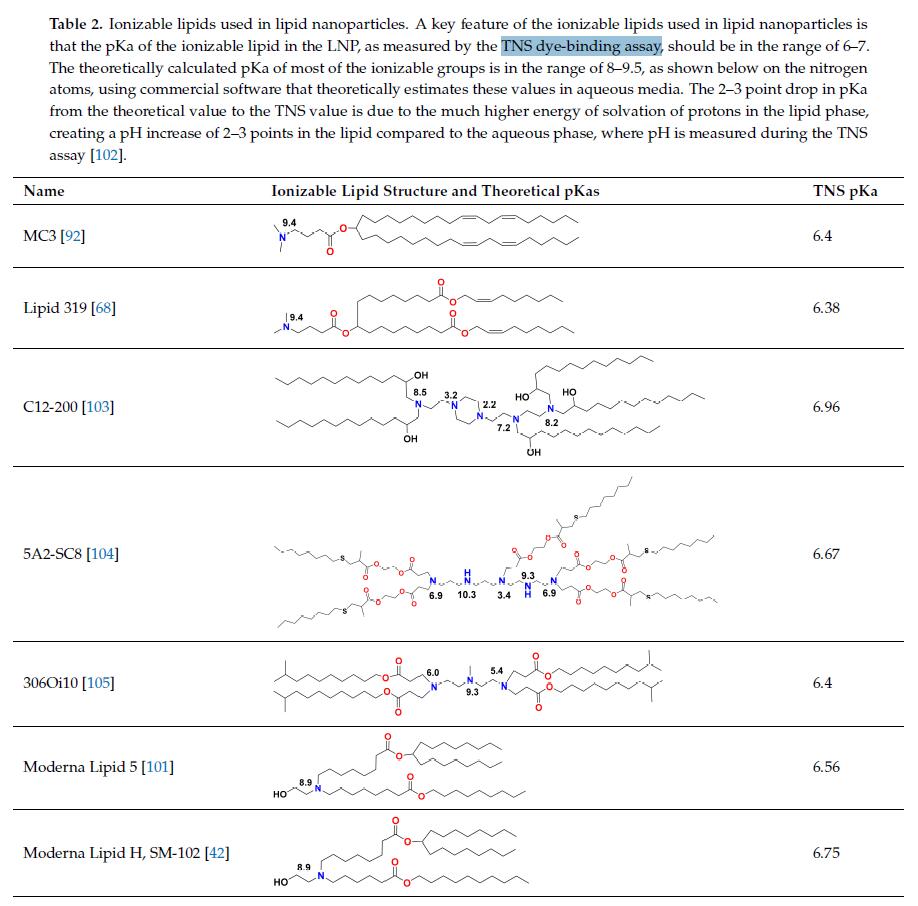
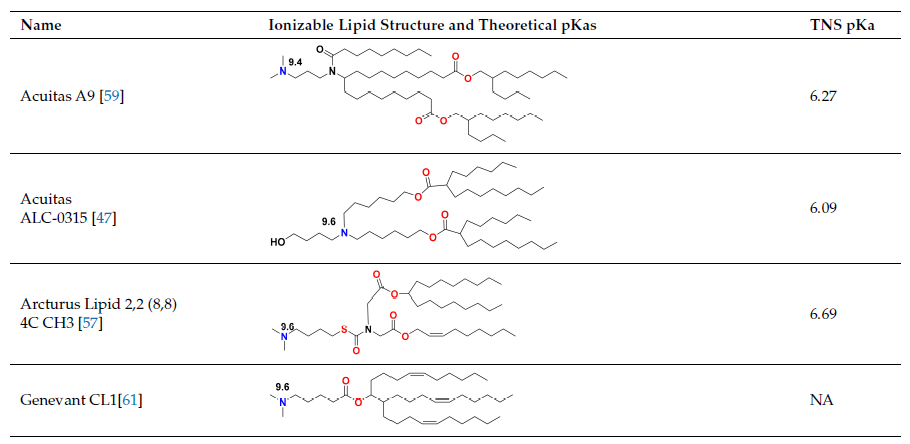
治疗性 mRNA 是通过体外转录 (IVT) 从质粒 DNA 骨架产生的,以产生带有 5' 帽、5' 非翻译序列 (UTR)、编码目标蛋白质的开放阅读框、3 ‘UTR 和 polyA 尾巴 [ 4 ]。天然真核生物 5’ 帽 (cap0) 是一个倒置的 7-甲基鸟苷 (m7G),通过 5' 到 5' 三磷酸与 mRNA 的第一个核苷酸相连。Cap0 保护内源 mRNA 免受核酸酶攻击,参与核输出并与翻译起始因子 结合以启动蛋白质翻译。已经确定了两个额外的 5' 帽(cap1 和 cap2),它们在第二个或第三个核糖核苷酸上含有额外的甲基,并且比 cap0 的免疫原性更低(因此是首选)[ 34]。目前常用的加帽方法涉及共转录加帽过程,产生 cap1,其具有高翻译和低免疫原性 [ 35 ]。5’UTR 参与翻译起始,可以包含一个 Kozak 序列以及一个内部核糖体进入位点,用于不依赖于帽的翻译 [ 36 ]。开放阅读框后面是 3’UTR,它影响 mRNA 的稳定性和蛋白质表达的持久性。polyA 尾部由大约 100 个残基编码,有助于启动翻译和延迟降解。mRNA 的 IVT 生产需要仔细纯化以去除 DNA 和双链 RNA 污染物,这些污染物具有免疫原性 [ 37 , 38]。上述mRNA可以是核苷修饰的或没有核苷修饰的序列工程化,但不能自我复制。能够复制的自我扩增 mRNA (samRNA) 也在 SARS-CoV-2 的临床试验中进行测试,并且更长~10 kb 的序列,因为它们包含四个额外编码的非结构基因,包括依赖于 RNA 的 RNA 聚合酶,导致在细胞内自我复制但不产生感染性颗粒,因为它们缺乏结构基因 [ 39]。samRNA 不能进行核苷修饰,因为这些修饰会干扰自我扩增。由于扩增过程,与非扩增 mRNA 的 30–100 µg 相比,samRNA 在当前的 COVID-19 临床试验中通常使用较低的剂量(1–10 µg)。有趣的是,上述所有类别的 mRNA 疫苗目前都在针对 SARS-CoV-2 的人体临床试验中进行测试,总结如下:表格1. 这些临床试验中的所有 mRNA 递送系统都是脂质纳米颗粒。Pfizer-BioNTech LNP [ 40 ] 和 Moderna LNP [ 41 ]的确切成分已公开披露,而其他一些尚未公开。其他的都最有可能类似于 Alnylam Onpattro™ 产品(在下面进一步描述),但具有专有的可电离脂质,正如所公开的那些。尽管可能并非在所有情况下都知道所使用的特定可电离脂质,但可以从期刊和专利出版物中了解其一般类别,并在表格1.

在 COVID-19 之前,mRNA 疫苗用于传染病的临床前和临床研究,包括流感、寨卡病毒、艾滋病毒、埃博拉、狂犬病、基孔肯雅热、疟疾、生殖器疱疹、弓形虫等
二、 mRNA 疫苗的早期递送系统
鱼精蛋白是一种富含精氨酸的小阳离子蛋白的混合物,已被用于与 mRNA 形成复合物,与裸 mRNA 相比,这种复合物改善了转染 [ 62 ]。后来,游离 mRNA 与鱼精蛋白复合 mRNA 的混合物被引入 [ 63 ],因为鱼精蛋白复合 mRNA 部分抑制蛋白质表达 [ 64 ]。动态光散射表明游离 mRNA 的大小接近 50 nm,而鱼精蛋白/mRNA 复合物在 250-350 nm 范围内 [ 63 ]。CureVac 为狂犬病疫苗候选者 CV7201 采用了这种方法,这是一种冻干的、温度稳定的非修饰 mRNA,由编码狂犬病病毒糖蛋白 (RABV-G) 的游离和鱼精蛋白复合 mRNA 组成 [ 65]。在 Balb/c 小鼠中,10 µg 和更高的两次剂量诱导的中和效价高于 WHO 的保护阈值,并且两次给予 80 µg 剂量可防止致命的脑内攻击 [ 66 ]。在通过皮内和肌内途径使用 80-640 微克剂量的 1 期人体试验中,只有使用特定注射器装置接受三剂 80-400 微克剂量的参与者亚组达到了 WHO 中和效价阈值 [ 67]]。在最高剂量下,101 名参与者中有 1 人发生了严重不良事件(贝尔氏麻痹),所有参与者中有 5% 经历了征集的严重不良事件。所有不良事件的总体发生率都很高,97% 出现注射部位反应,78% 出现全身不良事件。鉴于鱼精蛋白复合 mRNA 的这种次优递送,CureVac 采用了 Acuitas [ 47 , 68 ]的脂质纳米颗粒递送系统,并在 0.5 µg 的低 20 倍剂量(相对于鱼精蛋白复合 mRNA 为 10 µg)的情况下证明了大大提高了中和效价。 Balb/c 小鼠和 10 µg 剂量的非人类灵长类动物 [ 69]。T 细胞反应的激活以及引流淋巴结和注射部位中 IL-6 和 TNF 的存在表明 LNP 在介导阳性免疫反应中的作用。一项临床试验已经启动(NCT03713086),预计将于 2021 年报告中期结果。
通过将阳离子脂质 DOTAP 与含有角鲨烯、脱水山梨糖醇三油酸酯和聚山梨醇酯 80 的商业佐剂 (MF59) 结合在 pH 6.5 的柠檬酸盐缓冲液中,开发了一种用于 mRNA 递送的阳离子纳米乳液 (CNE,cationic nanoemulsion) [70]。将编码呼吸道合胞病毒糖蛋白 (RSV-f) 的自扩增 mRNA 与 NP 胺(来自 DOTAP)与磷酸盐(mRNA)的比率为 7 的组合使用导致平均 129 nm 大小的纳米颗粒。这种方法的一个优点是能够分别存储 CNE 和 mRNA,并仅在使用时将它们组合起来。在 Balb/c 小鼠中施用两次 15 µg 剂量引起的中和效价高于含佐剂的亚单位疫苗。两种剂量的 75 µg 在非人类灵长类动物中可检测到中和效价和 T 细胞反应。在此概念的基础上,一个独立的小组创建了一种纳米结构脂质载体 (NLC,Nanostructured Lipid Carrier ),它是 CNE 和脂质纳米颗粒之间的混合体,由液态油相(如角鲨烯)和由饱和脂肪酸组成的固相脂质组成。甘油三酯 [71]。含有编码梅花免疫原的自扩增 mRNA 的 NLC 具有 40 nm 的粒径和 15 的 NP 比,并且能够在单次注射低至 0.1 µg 的剂量后在 C57BL/6 小鼠中产生保护性中和滴度或 0.01 微克。
三、 用于 mRNA 传递的聚合物
几十年来,阳离子聚合物已广泛用于核酸递送,包括例如聚(L-赖氨酸)、聚乙烯亚胺(PEI)、DEAE-葡聚糖、聚(β-氨基酯)(PBAE)和壳聚糖。在其最简单的形式中,阳离子聚合物与核酸过量混合以形成静电结合的阳离子复合物。尽管已经开发了许多聚合物,但它们在核酸递送方面不如脂质纳米颗粒先进,并且将它们成功应用于疫苗的动物研究数量有限。 PBAE 与聚乙二醇 (PEG)-脂质共同配制以形成 mRNA/PBAE/PEG-脂质纳米颗粒,在小鼠静脉内给药后,能够将 mRNA 功能性递送至肺部 [72]。一种可生物降解的聚合物,聚(胺-共酯)(PACE)三元共聚物,已经使用促红细胞生成素作为基因传递后 IV 给药的报告基因进行了 mRNA 传递 [73]。通过控制分子量和端基化学,PACE 家族的 10 kDa 成员实现了与 TransIT 相同的体外转染效率,TransIT 是一种有效但有毒的胶体不稳定的大型商业参考。静脉注射 20 µg EPO 的体内表达比 TransIT 强五倍。合成超支化聚(β 氨基酯)(hPBAE)用于通过吸入将 mRNA 递送至肺。 hPBAE mRNA 复合物的大小为 137 nm,当雾化和吸入小鼠时能够转染 25% 的肺内皮,而没有明显的毒性,表达水平是分支 PEI 的 10 倍 [74]。二硫键连接的聚(酰氨基胺),pABOL,以 8 kDa 到 167 kDa 的分子量范围合成,并且能够形成大小接近 100 nm 的多分散纳米复合物 [75]。使用自放大 mRNA 报告基因的这些复合物的体内荧光素酶表达与肌肉注射后的 PEI 相似。当以初免-加强设计将血凝素 (HA) 流感免疫原递送给小鼠时,低分子量 8 kDa pABOL 的中和效价最高,并超过 PEI。提供 1 µg HA 自我扩增 mRNA 的 8 kDa pABOL 也部分保护了对致命流感的攻击,防止了死亡,但不能防止显着的体重减轻。该 pABOL 系统被伦敦帝国理工学院的研究小组考虑用于为 SARS-CoV-2 提供自我放大的 mRNA 免疫原;然而,使用 pABOL 递送 SARS-CoV-2 免疫原的效力比使用 Acuitas 优化的脂质纳米颗粒递送相同免疫原的效力低 1000 倍 [59]。总的来说,pABOL 中 1μg 的自扩增 RNA 产生与优化脂质纳米颗粒中的 0.001μg 相同的结合抗体和中和滴度(Anna Blakney 博士,个人通讯)。许多其他聚合物系统能够在体外或体内递送 mRNA,但仍有待在疫苗环境中进行测试
四、用于当前 SARS-CoV-2 临床试验的脂质纳米颗粒的开发
最早的 mRNA 转染试剂是季铵化阳离子 DOTAP 结合可电离和融合 DOPE,从 DNA 转染 [85] 中采用,用于在多种细胞类型中转染 mRNA [86]。尽管在体外有效,永久阳离子季铵基团使这些大尺寸的脂质复合物从循环中迅速清除,通常靶向肺,并表现出毒性。今天的 LNP 的先驱是稳定的质粒 - 脂质颗粒 (SPLP,stabilized plasmid–lipid particle),它是通过将融合可电离的 DOPE 与季铵化的阳离子脂质 DODAC 结合而形成的,DODAC 静电结合并封装质粒 DNA,然后用亲水性 PEG 包被以稳定它在水性介质中,并在体内给药时限制蛋白质和细胞的相互作用 [87]。 DOPE 可以在细胞摄取后在内体中质子化,并且由于它是锥形的,它可以与内体磷脂形成内体溶解离子对,以促进内体释放,这是成功递送的关键事件 [17]。然后将 SPLP 进一步开发为含有 siRNA 的稳定核酸脂质颗粒 (SNALP),其中包括四种脂质:
- 可电离而非季铵化(用于形成季铵化两性离子脂质的饱和双层)的阳离子脂质(ionizable cationic lipid)
- DSPC
- 胆固醇
- PEG-脂质 [88] 。
具体作用:
- 除了与核酸静电结合外,SNALP 中的可电离脂质还起到融合脂质的作用,并在内体中质子化,与内体磷脂形成膜不稳定离子对。
- 现在已知DSPC 有助于在PEG 表面下方形成稳定的双层[89]。
- 胆固醇有多种作用,包括填充颗粒中的间隙、限制 LNP-蛋白质相互作用以及可能促进膜融合 [90]。 可电离的脂质在生理 pH 下呈中性,从而消除循环中的任何阳离子电荷,但在 pH ~6.5 时在内体中质子化以促进内体释放,从而发挥核心作用。
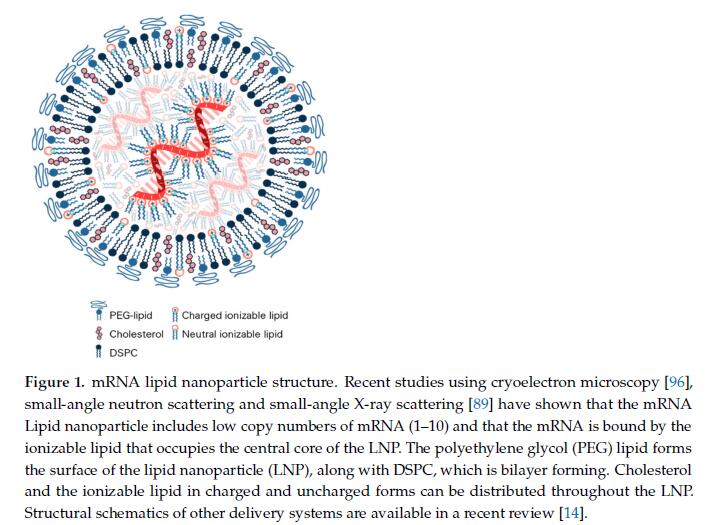
2018 年获得临床批准的第一个 siRNA 产品的开发主要集中在优化可电离脂质,其次是优化 PEG-脂质和 LNP 中使用的四种脂质的比例,以及 LNP 组装和制造程序。根据分子形状假设 [12,91],发现 C18 尾部中最佳数量的不饱和键提供通过醚连接到二甲胺头部基团的二亚油酸尾部 [88]。然而,将单个接头引入二亚油酸尾部,其具有从二甲胺头基到接头的优化碳数,导致 LNP 中可电离脂质的 pKa 对于可电离脂质 DLin-MC3-DMA 接近 6.4。 优化的最后一步是将 MC3/DSPC/胆固醇/PEG-脂质的这些脂质的摩尔比调整为 50/10/38.5/1.5。 总体而言,这种从 DLin-DMA 到 DLin-MC3-DMA 的优化过程需要在数千种配方中筛选 300 多种可电离脂质,并导致效力增加 200 倍,有效剂量相应减少,以实现对靶基因的持久抑制 >80% 和允许 Onpattro ™在 2018 年获得临床批准的治疗窗口 [94,95]。这种为 siRNA 开发的 MC3 配方是下文描述的 LNP 后续开发的基础(图 1),在被批准用于 SARS-CoV-2 mRNA 疫苗的递送后,它们现在正在紧急使用。
Moderna 在上述 Onpattro 配方中使用 MC3 进行了多项临床前 [97,98,99] 和临床研究 [97,100],以提供核苷修饰的 mRNA 编码免疫原。在这些将一类新的可电离脂质与 MC3 进行比较的研究中,MC3 后来被确定为 [42,101] 为可电离脂质。这一新类别包括脂质 H [42],它是 Moderna 的 SARS-CoV-2 产品 mRNA-1273(表 2)中的可电离脂质 SM-102 [41]。 MC3 LNP 使用针对寨卡病毒的核苷修饰的 mRNA 编码免疫原,能够保护缺乏 I 型和 II 型干扰素 (IFN) 信号的免疫功能低下的小鼠,以一次 10 µg 剂量或两次 2 µg 剂量接种-升压设计[99]。在预先给予抗-ifnar1 阻断抗体以创建致死模型的免疫活性小鼠中获得了类似的结果。在一系列提供核苷修饰的 mRNA 编码血凝素 (HA) 免疫原的流感研究中,皮内提供的 MC3 LNP 能够以低至 0.4 µg 的单剂量完全保护小鼠免受致命攻击,尽管攻击后体重减轻即使单次给药高达 10 µg [97]。 50 µg 或 100 µg 的单剂量在雪貂中产生高 HAI(血凝抑制试验)滴度,在非人类灵长类动物中,200 或 400 µg 的两个剂量也是如此。在接受 100 µg 剂量的少数 (23) 人受试者中,所有受试者的 HAI 滴度均 >40(WHO 保护相关系数),比研究开始时的基线高出四倍多。在使用这些相同的 MC3 LNP 提供两种不同的核苷修饰 mRNA 编码的 HA 免疫原的更大的 1 期试验中,肌肉注射 100 µg H10N8 免疫原导致 100% 的 23 名受试者的 HAI 滴度 >40 [100]。尽管没有发生危及生命的不良事件,但这 23 名受试者中有 3 名经历了严重的 3 级不良事件。在三个受试者中有两个出现 3 级不良事件后,计划的 400 µg 剂量被终止,这符合研究暂停规则。在较低剂量下,不良事件的频率和严重程度降低,尽管几乎每个受试者都经历了至少一次不良事件。这些研究是有希望的,但也强调了相对狭窄的治疗窗口,以在不会引起大量不良事件的剂量下获得保护性免疫。这让人想起 MC3 前体 DLin-DMA 的狭窄治疗窗口,它需要提高效力以降低剂量并仍然实现有效的基因敲低。
由于 siRNA 产品需要针对慢性疾病重复给药,因此担心 MC3 中二亚油酸烷基尾部的缓慢降解会导致重复给药的积累和潜在毒性。一种可生物降解的 MC3,脂质 319(表 2),是通过用一级酯替换每个烷基链中的两个双键之一而产生的,一级酯可以在体内被酯酶轻松降解 [68]。注意到脂质 319 在肝脏中的半衰期不到一个小时,同时它在肝脏中保持了与 MC3 相似的基因沉默效率。降解产物在体内得到证实,以及它们的分泌和脂质 319 的无毒性质。脂质 319 的这项研究在 SARS-CoV-2 的临床前和临床研究中被引用为代表 BioNTech 中使用的 Acuitas LNP 类[49] 和 CureVac [53,69] 产品,尽管在伦敦帝国理工学院的试验 [60] 中提供自放大 RNA 的 Acuitas LNP 被引用为包含在最近的专利申请 [59] 中,此处由来自 Acuitas 的脂质 A9(表 2)。最近,BioNTech 批准的 BNT162b2 中 Acuitas 可电离脂质的身份被公开 [40] 为 ALC-0315(表 2)。这些 LNP 的一个重要方面是它们是通过在 IV 给药后筛选肝脏中的 mRNA 表达而开发的,并且可能尚未针对基于 mRNA 的疫苗的肌内给药进行完全优化。
Moderna 最近开发了一类新的可电离脂质来替代 MC3,主要是由于上述与 MC3 降解缓慢相关的担忧,但也努力通过实现比二亚油酸 MC3 烷基尾部更大的分支来提高其效力 [42,101 ]。这类新的脂质具有乙醇胺可电离的头部基团,连接到一个包含主要可降解酯的饱和尾部(如 Maier 2013 的那个)和第二个饱和尾部,在七个碳后分支成两个饱和的 C8 尾部,使用不易降解的二级酯,如脂质 5 [101](表 2),针对肝脏静脉注射进行了优化,类似的脂质 H [42] 或 SM-102,发现最适合肌肉注射 (IM) 疫苗。增加分支是 Acuitas 追求的一个共同特征,因为 Lipid A9 共有五个支链 [59](表 2),而 Moderna LNP 则只有三个。增加的分支被认为会产生一种具有更多锥形结构的可电离脂质,因此,当与内体中的阴离子磷脂配对时,根据几十年前概述的分子形状假设,将产生更大的膜破坏能力 [12] ,91]。静脉注射时,24 小时后肝脏中检测不到脂质 5,而肝脏中存在 MC3 为其初始剂量的 71%,证实了脂质 5 的可降解性。脂质 5 在小鼠中的效力是 MC3 的三倍用于荧光素酶表达,IV 给药后在非人类灵长类动物中对 hEPO 的效力提高 5 倍。这些效力的增加与内体释放的增加一致并可能由内体释放的增加引起,对于脂质 5,细胞中高达 15% 的 mRNA 从内体释放,而 MC3 为 2.5%,后者与之前测量的相似对于 MC3,使用 siRNA [106]。然而,在这些内体释放实验中,MC3 的细胞摄取比脂质 5 高四倍,因此这两种 LNP 的细胞质中释放的 mRNA 的绝对量相似。在肌肉注射疫苗中检查了相同的可电离脂质库,同样发现由于初级酯可降解并迅速消除,并且与 MC3 相比,在蛋白质表达或免疫原性方面的效力通常增加 3-6 倍。流感核苷修饰的 mRNA 在小鼠中编码免疫原,尽管在非人灵长类动物中的免疫原性与 MC3 在 5 µg 初免-加强剂量下相同 [42]。脂质 H 或 SM-102(表 2)被确定为最佳候选物,并且在结构上仅与脂质 5 不同,脂质 5 被确定为最适合 IV 给药,通过伯酯的两个碳置换。 Lipid 5 LNP 的 pKa 为 6.56,而 Lipid H LNP 的 pKa 为 6.68,表明 pKa 的略微增加可能有利于 IM 与 IV 给药,尽管这种差异在测定的可变性范围内。大鼠肌肉注射部位的组织学检查表明,与 MC3 相比,Lipid H LNP 吸引较少的中性粒细胞和巨噬细胞富集的炎症浸润,这可能会降低人体试验中注射部位的反应原性 [42]。
五、 当前 SARS-CoV-2 临床试验中的 mRNA 脂质纳米颗粒
5.1. BioNTech/辉瑞
Acuitas ALC-0315 (表 2) 结合 DSPC、胆固醇和 PEG-脂质是 BioNTech 的 SARS-COV-2 试验中的递送系统 [ 40 ]。CureVac 和伦敦帝国理工学院也可能使用 ALC-0315 或 A9
5.2. 摩登纳
在 Moderna 的研究中,核苷修饰的 mRNA 编码的免疫原是一种跨膜锚定的双脯氨酸稳定的预融合尖峰,具有天然弗林蛋白酶裂解位点,并在遵循原型 MC3 LNP 的 LNP 中递送,但用脂质 H (SM-102) 代替 MC3
5.3. CureVac
CureVac mRNA LNP (CVnCoV) 是一种非化学修饰的序列工程 mRNA,编码双脯氨酸稳定的全长 S 蛋白,在 Acuitas LNP 中提供,可能使用可电离脂质 ALC-0315
5.4. Translate Bio
Translate Bio 使用未修饰的 mRNA 编码双脯氨酸稳定刺突蛋白的双突变形式,该蛋白以 LNP 形式提供,该蛋白被引述为基于可电离脂质 C12-200 [ 109 ],但可能是最近合成的候选物ICE- [ 110 ] 或基于半胱氨酸的 [ 55 ] 可电离脂质家族
。。。。。 其他的略
5.9 储存和配送
实验室制造的大多数 RNA LNP 在 4 °C 下可稳定数天,但随后表现出尺寸增加和生物活性逐渐丧失,例如荧光素酶表达 。在以前的 siRNA LNP 配方中,经常观察到 LNP 聚集导致的尺寸随时间增加 [ 117 ]。为了稳定用于储存和分发的 mRNA LNP 疫苗,迄今为止需要冷冻格式
六、类脂质纳米粒子 Lipidoid Nanoparticles
许多脂质样实体,称为类脂质(lipidoids),最初被开发用于 siRNA 传递,随后用于 mRNA 传递。一个例子是 C12-200 (表 2),由于其通过 IV 给药在肝细胞基因沉默中的高效性而从一个大的类脂质家族中选择出来 [ 123 ]。为了实现有效的肝脏导向基因沉默,C12-200 与 MC3 Onpattro 原型相同的脂质结合,即 50% 可电离脂质、10% DSPC、38.5% 胆固醇和 1.5% PEG-脂质。后来的一项研究发现,通过将可电离脂质的百分比降低到 35%,但将可电离脂质与核酸的重量比从 5 增加到 10 并替代具有融合不饱和 DOPE 的 DSPC [ 103]。有趣的是,这种优化的配方使 mRNA 表达增加了七倍,但没有改变 siRNA 的沉默效率。C12-200,在这种配方中,也被研究用于小鼠和非人类灵长类动物的 mRNA 介导的蛋白质替代疗法 [ 124 ],但据观察,当皮下注射时,组织学发现它会产生强烈的炎症反应 [ 109 ]。C12-200 是一种小分子树枝状聚合物,具有五个烷基链和五个氮原子,根据可以使用商业软件(例如 ACDLabs Percepta)进行的电离分析,其中三个似乎是可质子化的。表 2)。另一种树枝状脂质体 5A2-SC8 在单独的筛选过程中被鉴定为具有高 siRNA 向肝脏递送效率,并且还具有五个氮原子和五个短烷基链 [ 125 ](表 2)。5A2-SC8 类脂质的 mRNA 传递效率低,除非通过将可电离脂质摩尔分数降低至 24%、使用 DOPE 代替 DSPC 并增加其他脂质比例来类似地改变其配方参数,但同时增加5A2-SC8与mRNA的重量比为20[ 104]。这些配方变化似乎需要这些树枝状类脂质成为有效的 mRNA 传递载体,可能是因为它们具有多质子头基团和树枝状聚合物结构。另一种非常高分子量的修饰树枝状聚合物用于提供编码流感、埃博拉和弓形虫的免疫原的自我放大 mRNA,并且在单次非常高的 40 µg 剂量或初免后显示对小鼠的所有三种病原体都有保护作用4 µg 注射,这也是复制 RNA 的高剂量 [ 126]。最近对一系列类脂质的一个有趣的发现是,在这种小的三氮树枝状聚合物的四个烷基链中的每一个的末端增加一个单碳支链,与其他类脂质相比,肝脏表达的效力增加了 10 倍以上。这个类[ 105 ]。这种增加的效力与 LNP pKa 没有相关性,但与 TNS 染料在 pH 5 时的绝对荧光相关,这表明内体中质子化的幅度与 mRNA 表达相关,大概是通过促进内体释放. 根据分子形状假设 [ 12 , 91],额外的碳分支也可以预期产生更多的锥形结构,从而产生更多的膜破坏
…
九、脂质纳米粒子的组装和结构
目前的 mRNA 脂质纳米颗粒生产方法利用微流体或 T 型接头混合,将含有疏水脂质的乙醇相和含有 mRNA 的水相混合在缓冲液中,例如醋酸,pH 值为 4。图2)。先前的方法,例如薄膜水化和乙醇注射,通常不被使用,因为它们会导致异质的较大尺寸的纳米粒子,其 mRNA 封装效率较低,难以扩大规模 [ 95 ]。微流体混合的优势在于能够将乙醇中的极少量脂质与水溶液中的 mRNA(数十微升)混合,从而可以筛选许多成分和配方参数。另一方面,T 混合是大批量 mRNA LNP 商业生产的一般选择方法,例如当前临床试验中的那些。最近的一份出版物表明,这两种方法都会产生相似大小和形态的 LNP [ 96]。两种溶液的快速混合是将所得粒径限制在 <100 nm 的关键,从而无需其他生产方法 [ 137 ]所需的尺寸减小方法(挤出、超声处理)。从这些溶液中组装和形成 LNP 是由疏水力和静电力驱动的,如图2. 四种脂质(可电离脂质、DSPC、胆固醇、PEG-脂质)最初可溶于乙醇,不存在任何抗衡离子,因此可电离脂质未质子化且呈电中性(图2一个)。一体积含脂质的乙醇溶液通常与三体积 mRNA 在 pH = 4 醋酸盐缓冲液中混合,这样当脂质接触水性缓冲液时,它们在 3:1 水/乙醇溶剂和可电离脂质中变得不溶质子化并带正电,然后驱动它与 mRNA 带负电的磷酸骨架静电结合(图2B),当脂质变得不溶时,形成脂质颗粒,将 mRNA 包裹在主要的水悬浮液中。该过程中的一个关键成分是 PEG-脂质,因为 PEG 链是亲水的,从而包覆颗粒并决定其最终的热力学稳定尺寸。通过改变 PEG 的摩尔分数,LNP 的大小可以被可预测地控制,例如,从 0.5% 摩尔分数的 100 nm 到 3% PEG-脂质摩尔分数的 43 nm [ 89 ]。最近一个非常重要的观察结果是,当 mRNA LNP 悬浮液在水性缓冲液中稀释或在水性缓冲液中透析以提高 pH 值并消除乙醇时,LNP 结构和大小在混合后继续演变 [ 96]]。水相和脂质相的初始混合产生接近 5.5 的 pH 值,使可电离脂质质子化,其 LNP pKa 接近 6.5,并允许 mRNA 结合和封装。图2公元前)。随后通过稀释、透析或切向流过滤提高 pH 值会中和可电离的脂质,直到它在 pH 值 7.4 时主要不带电(图2D)。随着可电离的脂质变成中性,它的溶解度也会降低,导致形成更大的疏水脂质域,从而驱动 LNP 的融合过程,使其尺寸增加,LNP 的核心变成无定形的电子致密相,主要是含有与 mRNA 结合的可电离脂质。据估计,在这个过程中,多达 36 个囊泡可以融合形成一个最终的 LNP(图2光盘)。使用 FRET 对证明了融合,并且在此过程中进一步看到了 PEG-脂质的作用,因为在混合后添加 PEG-脂质控制最终 LNP 的大小与在混合前添加 PEG-脂质的方式相同 [ 138 ]。这项研究和另一项使用中子散射方法的研究也表明,DSPC 在 LNP 中外围 PEG 层的正下方形成一个双层,其中心核心主要是与 mRNA 结合的可电离脂质。图2D)。胆固醇被认为分布在整个 LNP [ 89 ]。

十、疫苗 mRNA 递送系统性能的决定因素
mRNA 传递系统性能的决定因素是多因素和相互作用的,包括:
- 它们传递到适当细胞并有效地将 mRNA 释放到细胞质翻译机器的效力或能力;
- 它们的佐剂性,可以增强免疫反应;
- 最小化可能由注射部位过度炎症或全身分布和脱靶表达引起的不良事件或毒性的任何贡献
..
10.1. 剂量
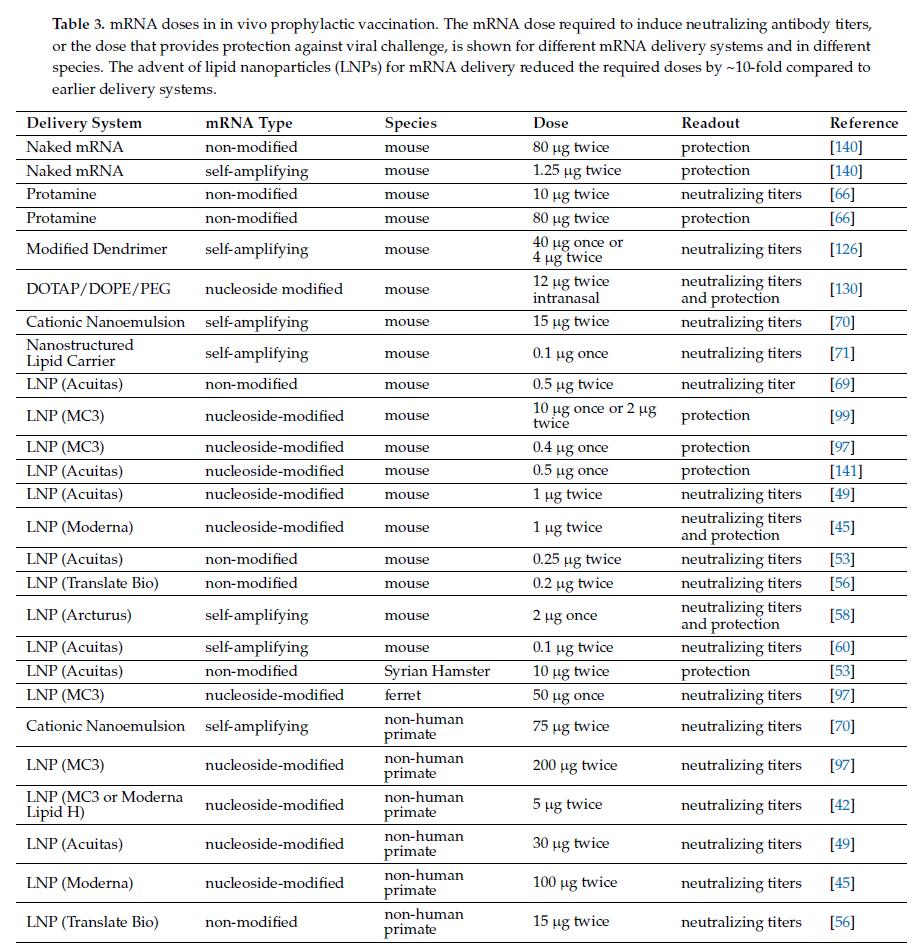
目前在 SARS-CoV-2 临床试验中所采用的大范围剂量,从 1 到 100 µg,最容易理解 mRNA 递送系统的效力。表格1)。人体试验中的剂量明显分为较高的 30–100 µg 剂量的核苷修饰 RNA(Moderna, BioNTech),较低剂量的 7.5–20 µg 未修饰 RNA(CureVac,Translate Bio),甚至更低的 1–10 µg 剂量用于自扩增 RNA(Arcturus,伦敦帝国理工学院)。在确定这些剂量时有两个因素在起作用:相对于恢复期血浆所达到的中和抗体滴度和 T 细胞反应的水平,以及每个剂量发生的不良事件的频率和严重程度。似乎有一个相当狭窄的接受窗口,其中实现保护所需的剂量也接近于产生不可接受的不良事件频率和严重程度,正如所有 1 期临床试验中测试的最高剂量的终止所证明的那样。在 BioNTech 1 期试验中测试的两种修饰核苷构建体与恢复期血浆相比具有较高的中和效价,而编码膜结合全长刺突蛋白的较大构建体具有较低的不良事件频率和严重程度,因此选择了该阶段3 学习。值得注意的是,剂量(dose)表示为质量(mass),而摩尔剂量(molar dose)取决于构建体的长度,此外,实际翻译的 mRNA 量是两者的一小部分,这取决于传递系统的效率和靶向特性。
10.2. 效力和递送效率
有许多研究试图确定 LNP 和其他核酸递送系统的结构-功能关系。LNP 最常被引用的决定其效力或递送效率的特征是其 pKa。pKa 是 LNP 中 50% 的可电离脂质质子化时的 pH 值。迄今为止,LNP pKa 仅使用称为 TNS 的染料结合测定法进行测量,TNS 带负电荷并在与带正电荷的 LNP 结合时经历荧光增强 [ 88]]。在覆盖广泛 pH 值的缓冲液中与 TNS 一起孵育的 LNP 的荧光测量用于推断染料与表面电荷的结合和估计的 pKa,其中获得最大荧光的一半。众所周知,基于 MC3 的 Onpattro LNP 具有 6.4 的最佳 pKa,可在静脉给药后沉默肝细胞 [ 92]]。对于影响肝细胞沉默的任何 LNP,TNS pKa 在 6.2-6.8 的范围内有一个非常明显的最佳值。解释这种 pKa 依赖性的一个很好的模型是基于 LNP 中的可电离脂质在 pH 7.4 时接近中性,而在内化进入细胞后,内体的 pH 将随着它通过内溶酶体途径进化而开始下降,从而逐渐质子化可电离的脂质,然后与内体的阴离子内源性磷脂结合并破坏其双层结构,将 mRNA 释放到细胞质中以装载核糖体 [ 17]]。
内体破坏需要可电离脂质的一个附加特征,即锥形形态,其中脂质尾部的横截面大于其头部的横截面。这使得可电离的脂质/内体磷脂离子对与双层不相容,并且更有可能形成结构,例如可以破坏内体膜的倒六边形相。这被称为分子形状假设 [ 91 ] 并且是解释为什么将一个或两个双键引入饱和的 C18 烷基链会产生更锥形和更少圆柱形的形态的机制,该形态具有膜破坏和内体溶解作用 [ 88]]。这两个 C18 亚油酸尾部,结合适当调整的二甲胺头基 pKa,是 MC3 可电离脂质的定义特征。已替代 MC3 进行 mRNA 传递的可电离脂质保留了 pKa 要求,但通过在烷基尾部引入更多分支来追求更大的内涵体溶解特性。例如,来自 Moderna 的脂质 H 和脂质 5 具有三个烷基尾部,来自 Arcturus 的脂质 2,2 (8,8) 4C CH3 也是如此,而 Acuitas ALC-0315 具有四个烷基尾部,而 A9 具有五个烷基尾部(表 2)。这种增强的锥形形态可能是包含这些可电离脂质的 LNP 是具有更大内体释放的更有效的递送载体的原因。
尽管 LNP pKa 和分子形状假设已被证实有助于 LNP 递送效率,但其他因素也很重要,例如 LNP 表面上 PEG-脂质的稳定性,以及乙醇溶液中四种脂质的比例,最终决定了 LNP 超微结构。如上所述,PEG-脂质通过提供亲水壳来控制 LNP 的大小,该壳在组装过程中限制囊泡融合,以便更高的 PEG-脂质浓度产生更小的 LNP。例如,一项研究表明,将 PEG-脂质的摩尔分数从 0.25% 改变到 5% 将 LNP 大小从 117 nm 减少到 25 nm,并且肝细胞沉默的最佳大小为 78 nm,由 2.5% PEG– 生成。脂质 [ 142]。由于 PEG-脂质的烷基尾部有 14 个碳原子,它不能稳定地锚定在 LNP 表面,并且随着可电离脂质 MC3 和 DSPC 的脱落,发现它在循环中逐渐从 LNP 脱落。这种 PEG 脱落被认为在某些时候使 LNP 转染有能力,但如果过于极端,会导致可电离脂质和 DSPC 的快速损失,这将对内体释放产生负面影响。例如,通过将烷基尾延长至 18 个碳,PEG-脂质不会脱落,但在肝细胞中也不会沉默。另一方面,添加更高浓度的 PEG 以制造更小的颗粒会导致更快的脱落、可电离脂质的损失和沉默的减少。目前仅部分了解 LNP 的不稳定和动态性质。89 ]。然而,通过改变四种脂质的摩尔比,以将 LNP PEG 层下的 DSPC 计算密度保持在 64 nm 1.5% PEG-脂质 LNP 中的最佳值,这些作者能够制造更大的与 64 nm 大小的 LNP 相比,100 nm LNP 的 mRNA 表达增加了两倍。因此,除了 LNP pKa、可电离脂质分子形状和 PEG-脂质的动力学之外,LNP 超微结构的更详细特征和每个组分的状态对于确定效力也很重要。
10.3. 内体释放 Endosomal Release
对 siRNA-LNP 的细胞摄取和内体运输进行了详细研究,并假设其与 mRNA LNP 的摄取和内体运输相似。对于 MC3 LNP,在电子显微镜下使用胶体金颗粒计数进行的一项定量研究表明,内体中只有 2% 的 siRNA 实际上从内体中逃逸到细胞质中,导致每个细胞有几千个 siRNA 分子可用于沉默。106 ]。然而,这个数字与在治疗相关浓度下每个细胞与 RISC 相互作用的功能活性 siRNA 的估计水平处于同一范围内。因此,绝大多数 siRNA 注定要通过多泡体(晚期内体)进行溶酶体降解或再循环,以在外泌体中释放 [ 143,144 ]。增加 LNP 的内体溶解行为是提高递送效率的核心方法,主要是通过调节 LNP 的 pKa 和增加可电离脂质的锥形形态。对于后者,脂质 H [ 42 ] 和脂质 5 [ 101 ] 包含三个分支,而 MC3 中包含两个分支,但具有相似的 pKa,与 MC3 相比,内体释放增加了四倍。Acuitas ALC-0315 尚未报告内体释放;然而,它的肝细胞沉默效率是 MC3 的 10 倍 [ 47],表明其更锥形的四分支结构也具有更高的内体释放。因此,这些新一代可电离脂质似乎实现了内体释放,与 MC3 siRNA-LNP 的 2-5% 相比,接近 15% 或更高。该领域的挑战之一是缺乏可以广泛实施的可靠的标准化内体释放方法。许多方法已被开发,但通常是仅专用于一个实验室组[ 42,101,145,146,147,148,149 ]。最近还显示 mRNA 以与释放到细胞质中的量相似的量进行胞吐作用 [ 150]。MC3 LNPs 在晚期内体中分解,MC3 和 mRNA 的 NP 1 复合物被重新包装到从细胞中输出的外泌体中。这些内-外泌体保持了与原始 MC3 LNP 相似的 mRNA 传递能力,但可以运输到不同的组织,并且似乎免疫激活较少。LNP 传递的 mRNA 外泌体重新分布的潜在意义仍有待探索。
10.4. 电荷和配体介导的靶向
使用永久带电的阳离子非电离脂质的早期脂质纳米颗粒很大,并且由于它们的永久正电荷,被快速调理并通常靶向肺。 BioNTech 的小组减少了 DOTMA/DOPE mRNA LNP 中阳离子 DOTMA 的量,直到净电荷为负,因为阴离子 mRNA 在 NP 比率小于 1 时过量。静脉注射这些带负电荷的大 300 nm mRNA LNP 导致树突细胞中的脾脏靶向和 mRNA 表达,并且它们能够介导适应性以及 I 型 IFN 介导的先天免疫机制,用于癌症免疫治疗 [ 151]]。类似地,脾靶向 mRNA LNP 是使用 C12-200 原型 LNP 产生的,但用小的树突可电离脂质 Cf-Deg-Lin 代替 C12-200,Cf-Deg-Lin 具有四个亚油酸烷基链和四个氮原子,TNS pKa 为5.7. LNP 的这种非常低的 pKa 将确保可电离的脂质在其 pH 值低于 7 之前不会被质子化,从而产生一个 LNP,该 LNP 将承载来自 mRNA 的净负电荷,直到内体途径的很晚,因此类似地运输到脾[ 152]]。他们发现脾脏中表达 mRNA 的主要细胞群是 B 淋巴细胞,根据流式细胞术分析,其中 7% 的 B 淋巴细胞表达了 mRNA。最近,使用三种不同的基本 LNP 实现了电荷介导的靶向,其中 MC3、C12-200 或 5A2-SC8 作为可电离脂质与一定摩尔分数的永久阳离子脂质 (DOTAP) 或永久阴离子脂质 (18PA) 混合赋予 LNP 净正、净负或中间近中性净电荷 [ 153 ]。与上述发现一致,高度阳性的 LNP 靶向肺,高度阴性的 LNP 靶向脾,而中等电荷水平主要靶向肝脏。肝脏靶向已被证明依赖于 Apo-E 与近中性脂质体或 LNP 的结合。154 ],这不会发生在带负电荷的脂质体中 [ 155 ]。
值得注意的是,所有上述电荷介导的靶向研究都是使用 IV 给药完成的,并且尚未检查通常用于疫苗接种的途径,例如肌肉内或皮内途径。然而,大多数分析肌内注射后表达的研究确实检测到 mRNA LNP 的全身运输,这些 LNP 在肝脏中快速而强烈表达,同时在肌肉和引流淋巴结中表达 [ 97 , 156 , 157 ]]。因此,这些特定的 LNP 似乎进入脉管系统,随后由于被动 ApoE 介导的靶向而在肝细胞中表达,这并不奇怪,因为它们是为肝细胞靶向而设计的。然而,免疫原的这种全身分布和表达可能会产生全身细胞因子、补体激活并导致其他潜在的不良影响,这些影响可能会放大不良事件的频率或严重程度和/或损害免疫反应的产生。最后,仅针对配体介导的 LNP 靶向进行了有限数量的研究。通过将 CD31 (PECAM) 抗体与 LNP 结合并在血管内注射来实现肺内皮细胞靶向 [ 158]]。然后,肝脏肝细胞导向的 LNP 在很大程度上被重定向到肺。使用 VCAM 配体的类似方法成功地将 LNP 靶向大脑的发炎区域,并减轻了 TNF-α 诱导的脑水肿 [ 159 ]。使用甘露糖化脂质体也可以更有效地转染体外树突细胞,这可能是一种适用于疫苗接种的策略 [ 160 ]。还开发了用于识别靶向特定细胞类型的配体的更高通量筛选方法,并且可能适用于靶向特定树突细胞亚群 [ 161 , 162 ]。
10.5. 脂质纳米颗粒的佐剂性
已知脂质纳米颗粒具有其自身的佐剂活性。对 10 µg 剂量的小鼠和 100 µg 剂量的核苷修饰的 mRNA LNP(来自 Acuitas)编码各种免疫原的非人灵长类动物进行的一项研究显示,抗原特异性 T 滤泡辅助 (Tfh) 细胞和生发中心 B (GC) 数量增加B) 与灭活病毒相比的细胞 [ 33]。Tfh 细胞驱动免疫球蛋白类别转换、亲和力成熟以及长期 B 细胞记忆和浆细胞。当 FLuc mRNA LNP 与蛋白质亚基 HA 免疫原共同给药并且生发中心 B 细胞数量增加四倍时,发现了 LNP 本身的佐剂特性,尽管与单独的蛋白质相比,Tfh 细胞的数量没有增加。因此,LNP 似乎会放大 GC B 细胞的反应,尤其是对核苷修饰的 mRNA LNP 的反应。另一项使用来自 Merck 的不对称可电离脂质的研究调查了使用 LNP 作为乙型肝炎蛋白亚单位疫苗的佐剂 [ 163]]。将 LNP 与蛋白质亚单位疫苗共同给药可将 B 细胞反应增强至与已知疫苗佐剂相当的水平,包括铝基佐剂、寡核苷酸和 TLR4 激动剂、3-O-脱乙酰基单磷酰脂质 A (MPL)。LNP 引发了强效的抗原特异性 CD4+ 和 CD8+ T 细胞反应,并且在 LNP 中加入额外的佐剂可能会进一步影响 Th1 与 Th2 的偏向性。该小组使用登革热病毒免疫原进行的一项后续研究发现,LNP 中具有类似的强佐剂活性,并且这种活性取决于可电离脂质的存在 [ 164 ]。脂质体中的脂质成分以前也被认为在粘膜疫苗中具有佐剂活性 [ 165 , 166 ]。
10.6. mRNA LNP 的注射部位反应、安全性、耐受性、反应原性 Injection Site Reactions, Safety, Tolerability, Reactogenicity of mRNA LNPs
对通过静脉注射给大鼠和非人类灵长类动物肝脏表达 hEPO 的 MC3 核苷修饰 mRNA LNP 的一般安全性研究发现,轻度毒理学事件高达 0.3 mg/kg,是预期治疗剂量的 10 倍以上 [ 167 ] . 大鼠的主要发现是白细胞计数增加、所有剂量下凝血参数的变化以及肝损伤。非人类灵长类动物表现出淋巴细胞耗竭,伴随着轻度和可逆的补体激活。这些结果与早期针对 siRNA 递送的相同 LNP 的毒理学研究一致 [ 168]],其中大鼠死亡率为 6 mg/kg,而无可观察到的不良反应水平 (NOAEL) 被确定为 1 mg/kg。血清化学参数(ALT、AST 和 TBIL)、血尿和肝脏(空泡形成、炎性细胞浸润、纤维化、出血和肝细胞坏死)、脾脏(淋巴管萎缩和坏死)的血清化学参数升高超过 3 mg/kg和肾脏(肾小管变性/再生)。患者的安全性发现包括输液相关反应(15% 的患者,可能是补体介导的)和促炎细胞因子的短暂升高。值得注意的是,上述静脉给药的剂量,例如 0.3 mg/kg,比目前使用肌注给药的 SARS-CoV-2 临床试验中的剂量高 10 倍以上。尽管如此,在目前的人体试验中,这些较低的剂量仍然会导致局部注射部位反应和全身不良事件的发生频率高,有时严重程度中等。目前,关于这些人类不良事件在动物中的相关性的已发表的动物研究很少。
使用 MC3 LNP 对注射部位和 mRNA 表达的运输进行了一项广泛的恒河猴研究,以 50 µg 的剂量肌肉内或皮内递送编码流感免疫原 H10 mRNA 的核苷修饰 mRNA [ 98]。他们发现在 4-24 小时内细胞会快速浸润到注射部位,这可以单独由 LNP 驱动,主要由中性粒细胞和单核细胞组成。表达 mRNA 的主要细胞类型是注射部位和引流淋巴结中的多个单核细胞和树突细胞亚群。T 细胞反应的启动仅限于引流淋巴结,单独的 LNP 不会在抗原呈递细胞中诱导 CD80。疫苗特异性 CD4+ T 细胞的持续生成仅发生在疫苗引流淋巴结中,其中 mRNA 编码抗原的检测在 24 小时达到峰值,而抗体反应持续数周。使用未修饰的编码狂犬病病毒糖蛋白 G (RABV-G) 的 mRNA 也报告了与上述一致的结果,该 mRNA 在 Acuitas LNP 中递送给具有 0.69 ]。他们还发现,单独的 LNP 介导了肌肉注射部位和引流淋巴结中细胞因子的产生,但认识到 IL6 的全身检测可能由于通过血液运输和在肝脏中表达而发生。在 10 µg 和 100 µg 剂量下,在非人灵长类动物中观察到注射部位出现红斑和水肿。值得注意的是,mRNA 递送系统中使用的 LNP 的大小范围为 10-100 nm,已知这是淋巴管摄取的最佳选择,并且脂质的聚乙二醇化可改善淋巴管中的滞留 [ 169 ] 和可以减少补体激活 [ 109]。自 Pfizer/BioNTech 疫苗获得紧急使用批准以来,已观察到数次急性过敏反应发生率,相当于 100,000 次疫苗接种中的 1 例,约为其他疫苗的 10 倍 [ 170 ]。这种过敏反应的一个可能来源是一般人群中抗 PEG 抗体的流行,由于在 LNP 中使用 PEG-脂质,这可能会引发患者亚群的过敏反应。PEG介导的过敏性反应已经注意到,例如,在临床造影剂[ 171 ]和阿霉素[的脂质体制剂172]。尽管如此,当前 SARS-CoV-2 疫苗的给药剂量与 PEG 总剂量相对应,比这些产品中发现的剂量至少低 15 倍,这似乎降低了这种可能性。另一种可能性是这些反应本质上是类过敏反应,但不是对炎症和其他因素的非特异性反应。正在进行一项临床研究以进一步阐明这个问题 [ 173 ]。
参考资料
