【2.4.4】双特异性和三特异性抗体的构建基块(Blocks)
双特异抗体 大致可以分为两类:
- 含Fc的双特异抗体
- 不含Fc的双特异抗体。
对于含Fc的双抗可以进一步分为两类
- 对称型
- 非对称型
靶向两种抗原或表位的双特异性抗体(BsAbs)将两种不同的单克隆抗体(mAbs)的特异性和特性整合到一个分子中。 这样,与常规的单特异性IgGs相比,BsAbs可以引发协同活性并提供增强的治疗功效和/或安全性的能力。 基于结合单克隆抗体(mAbs)的抗原识别结构域,可以生成BsAbs和三特异性抗体(TsAbs)的构建基块格式很多。 这篇综述描述了用于实现多价和多特异性的多种多样的基于抗体的构件。 这些多样化的构建基块为定制BsAb和TsAb的设计提供了机会,以使其与所需应用相匹配。
一、前言
单克隆抗体(mAb)对人类疾病的治疗产生了深远的影响,在过去的20年中,目前正在临床研究中的100多种已被批准用于各种适应症的50多种单克隆抗体(mAb)[1]。但是,mAb仅干预单分子途径,许多抗体在复杂的多方面疾病(例如癌症或自身免疫)中的功效或耐用性有限。 BsAbs可用于靶向多种抗原/表位以阻断肿瘤逃逸机制,更有效地阻断自身免疫性疾病中的炎症级联反应,更广泛地识别病毒或细菌的抗原区域,或者在其他适应症中更广泛地影响疾病机制用mAb [3,4]即可实现。例如,调节双特异性分子对两个细胞表面受体的亲和力可以提高其对特定细胞类型的选择性[5,6];而双特异性介导的受体交联则可以诱导新的信号传导[7-9]。 BsAb也已用于将免疫细胞重定向至靶向恶性细胞类型[10]。 BsAb还可以使用许多其他可能的机制来潜在地提高治疗效果和/或安全性[11]。最近,甚至有令人信服的理由超越BsAb的结合而结合两种以上的抗原。例如,检查点抑制剂已成为癌症免疫疗法的新范例。针对PD-1,CTLA-4和CD137的mAb与抗CD19的组合具有消除小鼠多种同系肿瘤的能力[12]。在传染病中,针对多种抗原或表位的靶向可导致疗效提高,正如针对HIV,流感甚至埃博拉病毒所证明的那样[13-15]。 BsAb的格式和应用已在其他地方进行了全面综述[3,16]。然而,在产生用于多价和多特异性构建体的基于抗体的构建基的能力方面已经有了许多最新进展。这篇综述描述了用于产生纯重组双特异性和三特异性抗体的常用构件
二、特异抗体的构建基块 Building blocks for Multispecific Antibodies
可以从在同一生产细胞中表达的两个或多个不同的抗体结合部分组装多特异性IgG分子。 这些抗原结合部分由抗体Fab,Fv或单个抗体可变域组成,可以像串珠一样连接。 它们还可以包含抗原结合支架蛋白。 这些已在其他地方进行了审查[17]。 在过去的几十年中,已经构想出许多结构特征,以改善药代动力学性能,并特别注重可制造性(manufacturability)
2.1 基于V结构域的双特异性抗体 V domain-based bispecific antibodies
双特异性蛋白的最简单构建基块使用称为dAb的单抗体可变域作为其模块化抗原结合单元。这些dAb主要由VH,VL或其他Vtype域组成,包括衍生自仅骆驼科重链抗体的VHH支架[1820](图1)。包含两个或多个单域抗体将通过连接接头产生具有一或两个特异性的二价,三价或什至多价分子[3]。自然地,VH和VL结构域需要相互配对才能结合靶标。然而,有一些VH和VL构成了抗体的全部结合能力[21,22]。在大多数情况下,必须对VH和VL进行改造,使其在分离时获得足够的抗原结合[23,24]。大多数情况下,VH和VL孤立地没有理想的生物物理特性[25]。除非经过适当工程改造,否则从其天然稳定IgG上下文中获得的分离的IgG可变域通常会遇到溶解度,聚集或稳定性问题[26]。已经鉴定出在VH / VL界面处具有亲水突变的变体,具有改善的生物物理特性,包括重新折叠的能力,并可以作为理想的工程抗原结合支架[27]。稳定dAb的方法包括将决定互补性的区域嫁接到稳定的构架上,引入非典型的二硫键,随机诱变与严格选择相结合,点突变(例如包含负电荷)和遗传融合[28]。利用这些不同的策略,稳定了dAb而不显着损害其亲和力[28]。来自骆驼科动物的VHH已进化为无需LC即可结合抗原,是具有令人惊讶的稳定性,溶解性和可折叠性的天然单结构域[29]。单链的性质和小巧的尺寸使dAb成为设计双特异性构建基块的理想选择[30]。例如,目前正在临床试验中由融合蛋白组成,该融合蛋白由靶向IL-6R的两个序列优化的,来自美洲驼的VHH域组成,以减少炎症和血清白蛋白延长半衰期[31](图1)。同样,产生了针对口蹄疫病毒的三价双特异性VHH融合蛋白,其中一个结合位点针对猪免疫球蛋白,这也增加了融合蛋白的体内半衰期[32]。
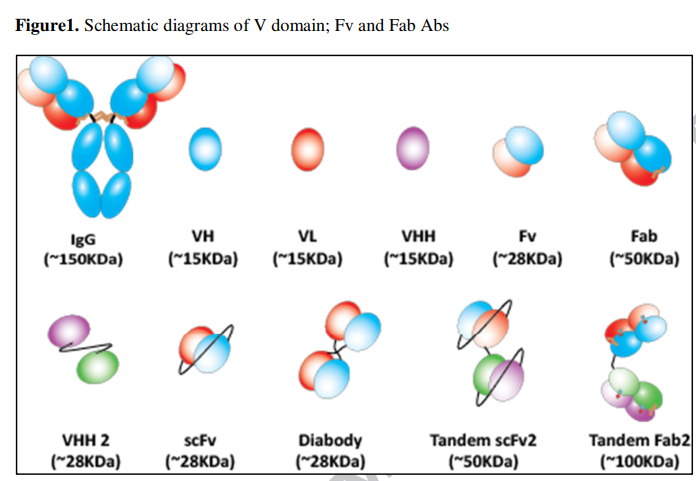
2.2 基于Fv片段的双特异性抗体 Fv fragments based bispecific antibodies
单链Fv(scFv)是通过将抗体的组分V基因与编码适当设计的接头肽(如(Gly4Ser)3 [33])的寡核苷酸连接而形成的。连接子桥接第一个V区的C末端和第二个V区的N末端,顺序为VH-接头-VL或VL-接头-VH [33](图1)。单个scFv模块的稳定性是普遍关注的问题,因为从抗原结合Y或Fab的完整X片段中去除恒定结构域会显着破坏分离的VH / VL的稳定性[25]。通过在VH44和VL100的VH / VL界面之间引入稳定的二硫键,可以实现一种提高scFvs稳定性的方法[34-36]。在另一种方法中,VH和VL结构域之间的氢键被残基VH39和VL38之间的静电相互作用取代,从而有利于所需的VH-VL缔合[37]。统计分析和基于结构的方法的组合也可用于设计小型,集中的库,以鉴定具有改进稳定性的scFv [38]。然后可以将此类稳定化的scFv用作构建模块,从而能够生产具有良好生物物理特性的双特异性和多价抗体
在过去的二十年中,已经构建了一系列BsAb格式,其中Fv或scFv片段是基本的构建基块。双抗体(图1)是由多个Fv组成的一种常见BsAb格式。以这种格式,来自不同抗体的两个可变域通过短接头连接,该短接头通常是五个氨基酸残基,例如GGGGS [39],并与包含同源VH或VL对的第二条多肽链配对。短接头阻碍了每条链中scFv的形成,并有利于分子间链配对以产生BsAb。像scFvs一样,双抗体也通过各种亚基之间的二硫键得以稳定[40,41]。这些双抗体由于体积小而具有独特的功能,例如改善的肿瘤靶向性和对免疫突触的强大效力[42,43]。双特异性串联scFv格式已广泛用于癌症免疫治疗,用于将T细胞重新定向到肿瘤微环境的肿瘤细胞或肿瘤相关细胞[44,45],其中第一个BiTE分子(blinatumomab)被批准用于治疗急性淋巴细胞白血病[46,47](图1)。
许多基于scFv的BsAbs缺少Fc区,并低于约60 kDa的肾脏透析滤膜,导致血清半衰期短,与IgG或通过连续输注给药相比,可能需要更频繁的给药[48]。为了获得更高的价,可将scFvs融合至同型或异型二聚体亚基。例如,通过将抗HER2 scFv与一个CH3结构域的N末端融合,将抗CD16 scFv与另一个CH3结构域的抗CD16 scFv融合,形成了双特异性,二价融合蛋白(微型抗体)。诱导异二聚化的基序[49](图2)。通过将额外的抗HER2 scFv融合到第一个CH3域的C端,该格式进一步扩展为生成双特异性三价微型抗体[49]。
为了产生具有mAb样药代动力学的双特异性疗法,可将scFvs融合在标准IgG HCs或LCs(表示为scFv-IgG)的氨基或羧基末端[9,50-53](图2)。 Fc部分介导mAb样的血清半衰期,并可能为scFv-IgG提供Fc介导的效应子功能[51]。在过去的几年中,已经产生了多种不同的双特异性scFv-IgG融合蛋白,并用于癌症治疗,例如多靶点方法[54],通过血脑屏障递送抗体[55],T细胞重新靶向[56] ]和预先靶向的放射免疫疗法[57]。

双变量域DVD-IgT格式是另一种Fv-IgG融合概念,最早于2007年进行了描述[2]。像scFv-Ig一样,DVD-Igs通常是由两个HC和两个LC组成的双特异性四价免疫球蛋白G(IgG)样分子。每个HC和LC都有两个Fv区域,这些区域通过单独的接头串联连接[58](图2)。两个Fv的融合与双抗体的融合相似,不同之处在于内部抗原结合区是Fab而不是Fv,以增强BsAb的稳定性和链配对。 DVD-Ig格式的内部和外部可变域可以通过连接任意一对mAb的可变域进行工程化,在许多情况下保留亲本抗体的活性[58]。 DVD-Ig格式具有使用单个HC和单个LC(如天然mAb)实现双特异性的优势,因此可以避免在共同表达多个HC和LC时出现下面描述的HC / LC配对问题[59]。这些分子具有良好的理化性质和药代动力学。一些DVD-Ig已显示出位置作用,其中内部结合亚基的抗原亲和力比亲本抗体弱,因此需要进行接头工程以重新获得两个亲本mAb的全部结合力[60]。
2.3 基于Fab的双特异性抗体 Fab- based bispecific antibodies
仅Fv部分(V域和scFv)的缺点是它们缺乏在大多数哺乳动物免疫球蛋白中发现的天然Fab(抗原结合片段)结构。 天然Fab体系结构分别提供重链和轻链恒定域CH1和CL的稳定相互作用[25,36]。 这些稳定结构域的缺乏会导致热稳定性或溶解度下降,并在含有分离的Fv片段的BsAb中聚集的可能性增加。 利用全抗体Fab部分作为多特异性蛋白质的构建模块时的主要挑战是在同时共表达多个HC和LC时实现正确的HC / LC配对[61]。 需要引导每个LC与其关联的HC配对以产生均一组装的基于Fab的BsAb。
2.3.1 Crossmab
CrossMab技术被开发为在双特异性异二聚体IgG抗体中强制正确HC / LC链缔合的方法[62]。通过交换BsAb一半的抗原结合片段(Fab)中的结构域,可以实现LC及其同源HC的正确结合。一个Fab臂的LC被相应HC的整个Fd(CrossMabFab)交换,或者仅交换一个Fab的一对可变域(CrossMabVH-VL)或恒定域(CrossMabCH1-CL)[62] (图2)。 CrossMab技术可在共表达时正确组装两个HC和两个LC,并用于形成双特异性单价IgG抗体,而无需使用任何连接子或连接子[62]。另外,蛋白链的序列可以直接衍生自两种亲本抗体,而无需进一步优化。在所评估的三种形式中,CH1-CL结构域交换的变体在纯化后可以最佳地产生所需的BsAb,而没有主要的副产物。 CrossMab CH1-CL用于产生针对VEGF和Ang-2的双特异性CrossMab,并显示抗原同时结合且亲和力不变。这种CrossMab(A2V)可以通过重新编程肿瘤免疫微环境并延迟肿瘤生长来延长胶质母细胞瘤小鼠的生存期[63]。尽管CrossMab方法已证明自身是生成单价,双特异性IgG分子的通用平台,但它也已用于创建基于IgG的多价和多特异性抗体[64]。 CrossMab技术支持任何其他格式,包括与CD20的高亲和力二价结合以及B和T细胞结合域以2:1分子形式的头尾方向。这种基于IgG的新型T细胞双特异性抗体CD20-TCB(NCT03075696)目前正处于早期临床试验中,作为血液恶性肿瘤的下一代治疗方法[65](图3)。基于相同的2:1 TCB分子格式的CrossMab CEA TCB(NCT02324257)显示出强大的抗肿瘤活性,可抑制肿瘤生长并产生高度发炎的肿瘤微环境。目前,它还在表达CEA的实体瘤的治疗中处于早期临床试验中[66]。临床前研究中已经评估了许多CrossMab,到目前为止,基于 CrossMab 技术的四种不同的量身定制的双特异性抗体已进入临床研究[64]。但是,由于未修饰的LC配对不正确,在某些CrossMab中观察到异质性,提示可能需要引入其他突变来纠正此问题[64]。我们的小组发现,VH-VL相互作用可以控制HC和LC之间的相互作用特异性。这可能会使HC和LC之间交换恒定域而使任何配对特异性变得复杂或超越[67,68]

2.3.2 Orthomab
Orthomab技术于2014年首次报道[67]。它将计算和合理设计与筛选和基于结构的优化相结合,以生成与天然存在的IgG Fab正交的HC / LC接口[67]。使用Rosetta分子建模套件中的多状态设计(SD)算法可实现正交HC / LC接口的设计[69]。最初的设计需要基于竞争性HC / LC结合测定和高分辨率结构确定的结果进行优化,以达到最终状态。对于CH1 / C-,已经描述了不同的恒定域设计;和CH1 / C-:接口[67,68]。促进CH1 / C-的主要设计;配对特异性相对于野生型界面的标记为Xconstant重新设计2Y或XCRD2Y,包括对CH1 / C-的以下更改;接口:C-; _ L135Y.S176W / CH1_H172A.F174G)[67,69]。对于CH1 / C- :,促进CH1 / C-:配对特异性的主要设计标记为14.1.2(CK_S131R.E123K / CH1_K145A.K221E),细微变化表示为14.3.1.1、14.3.1.2、15.1和15.2 [68] 。有趣的是,特异性同时由CH1 / C-诱导。和CH1 / C-:设计[67,68]在没有可变域的情况下几乎完成,当将培妥珠单抗可变域添加到抗体中作为筛选的一部分时,这些设计仅提供了较弱的特异性,表明可变域可以具有在HC / LC配对中起着重要和显性的作用[67,68]。因此,为开发VH / VL接口重新设计做出了巨大的努力。设计限制包括(i)在任何可能的情况下优先修饰保守残基,以增加设计适用于多个VH-VL种系的可能性,以及(ii)最小化对抗原结合的影响。三个变量重新设计(VRD):1)VL_Q38D / VH_Q39K / VL_D1R / VH_R62E; 2)VL_Q38R / VH_Q39Y和3)VL_K42D / VH_Q105R均提高了HC / LC的特异性[67,68]。仅当将这些VH / VL设计与CH1 / C-:或C-;组合使用时,多个亲本抗体对之间的正交界面接近完全HC / LC特异性[67,68](图2)。用这种方法产生的OrthoMabs表现出天然IgG的药代动力学和其他所需特性,但通过两种HC的异二聚化单价结合靶抗原。因此,这些双特异性试剂可能在许多生物技术应用中有用。例如,将HER-2 / HER-2(曲妥珠单抗/培妥珠单抗)OrthoBsAb IgG的活性与利用相同可变域的scFv-IgG BsAb进行了比较,发现IgG格式具有优异的拮抗活性[70]。另一个实例比较了EGFR / CD3 OrthoBsAb IgG和串联的OrthoFab2 BsAb与串联的scFvs作为双特异性T细胞衔接子(BiTE)[70]。两种基于Ortho Fab的BsAb均具有出色的生物物理特性和强大的肿瘤杀伤活性,尽管串联scFv由于其体积小而具有最高的效力[70]。
其他人已经发表了类似OrthoMab的方法来改善HC / LC配对(图2)。在VH-VL和CH1-CK:界面内的静电操纵方法已被用于在双特异性异二聚IgG组装过程中改善正确的LC / HC配对[71]。 Golay和同事使用了两个CH1-CL接口突变集,称为1)带电荷的CR3突变体(CL_N137K.S114A / CH1_T192E)和2)疏水性-极性互换UT4突变体(CL_V133T.S176V / CH1_L143Q.S188V)来强制正确结合两个不同的游离LC与它们的同源HC产生四价IgG1样BsAb [72]。另外两种使用静电和重新包装的方法已经成功地证明了同时共表达两个Fab的BsAb内正确HC / LC配对的改进[73,74]。 “ DuetMab”方法将天然HC / LC二硫键重定向到另一个Fab位置,以改善相关的HC / LC配对。这些分子保持天然IgG的结构和可显影性[75](图2)。
2.3.3 TCR-IgG嵌合双特异性抗体(C-1 / C-2 / Fab) TCR-IgG chimeric bispecific antibody (Cα/Cβ/Fab)
免疫球蛋白(Ig)和T细胞受体(TCR)具有共同的特征,包括它们的整体结构。 TCR Cα1和Cβ具有与Fab恒定域(Cα / Cβ和CH1 / CL域之间约20%的同一性)和正交异二聚体界面非常不同的一级序列[76]。在一个抗体臂中用TCR恒定α和β结构域替换CH1和CL,而在Fab-IgG BsAb中不影响其他Fab部分的方法已用于实现特定的HC / LC组装[77](图2)。 。通过在同一分子构建体中共表达天然Fab和IgG TCR Fab,可以生成一些BsAb。 TCR-IgG设计能够指导构建物中的每个LC与它们的同类HC对应物特异性配对[77]。 TCR-IgG BsAbs作为平台的实用性由几种几何形状各异的HER-2 x HER-2 BsAbs的新颖活性代表,这些活性证明了HER-2的激动和拮抗行为谱,包括一种具有明显更好的HER- 2抑制作用大于曲妥珠单抗/培妥珠单抗组合[77]。这些不同的几何形状对于实现所需功能至关重要,这些HER-2 x HER-2 BsAb证明了这一点。具有天然样IgG的TCR-IgG BsAb形式为产生新型BsAb提供了一种替代性架构,该新型BsAb可以用于治疗多方面和复杂的疾病。然而,为了使TCR-IgG Fabs能够牢固组装,必须进行额外的修饰,以优化Fv / TCR恒定域界面或稳定Cα/ β域本身,才能始终获得完整的HC / LC组装[ 76,78]。因此,即使使用TCR-IgG方法,VH / VL相互作用对HC / LC特异性的影响也会对配对特异性产生影响[78]。可变域设计,例如该研究中描述的那些[67],可以用于减少TCR-IgG BsAbs中的HC / LC错配[76]。
2.3.4 共有LC或HC Common LC or HC
生成正确配对的基于Fab的BsAb的另一种方法是使用具有两个不同HC臂的单个LC配对[79](图2)。据报道,大多数抗体的亲和力和特异性都在HC中,而用非同源LC取代抗体Ys同源LC并不能完全消除HC的结合特异性[80]。已经建立了抗体发现平台来生产具有常见LC的mAb,这些LC可以快速转化为BsAb [80]。基于普通LC的技术的优势在于,无需对Fab部分进行额外的工程设计即可避免HC / LC配对错误[80]。此外,只需要表达三个而不是四个肽链,从质粒复杂性的角度来看这是有利的[81]。 Chugai Pharmaceutical开发的第二个FDA批准的BsAb(和第一个完全IgG BsAb)利用通用LC来实现正确的HC / LC配对。 IXa因子(FIXa)和X因子(FX)的双特异性IgG抗体(ACE910)模仿FVIII辅助因子功能[82]。 REGN1979(Regeneron)使用了常见的LC IgG BsAb技术,靶向B细胞标志物CD20和T细胞受体的CD3成分,从而触发B细胞的重定向杀伤。在小鼠中,这种抗体阻止了B细胞肿瘤的生长,还导致了大型已建立的肿瘤消退[80]。靶向人EGF受体2和3的CLA-128(erus)使用常见的LC格式[83]。另一种常见的LC IgG BsAb ERY974(Chugai)靶向glypican-3(GPC3)和CD3,以重定向T细胞杀死GPC3 +实体瘤[84]。这些常见的LC IgG BsAb目前正在临床研究中。使用带有-的普通HC生成BsAb的单独方法。 k LC文库能够介导整个抗原结合[85](图2)
2.4 V域;基于Fv和Fab的三特异性抗体 V domain; Fv and Fab-based trispecific antibodies
最近已经描述了包含三个或更多个独特的抗原结合结构单元的构建体。这些基于V域,Fv和Fab的形式可通过在现有BsAb平台上再添加一个抗原结合构件来实现三特异性甚至更高的多特异性(图3)。三种dAb或scFvs通过各种接头的重组融合[3]可产生具有三特异性活性的单条多肽链。使用这种方法,重组双链scFvs重组结合使用双重抗原靶向和分别通过结合T细胞抗原CD3或NK细胞抗原Fc-3RIIIA的重定向裂解/ ADCC活性产生具有精致细胞特异性的三抗体。 (图3)。双重靶向策略用于特异性靶向CD33 + / CD123 +或HLA-DR + / CD19 +或CD33 + / CD19 +急性髓细胞白血病细胞[86-88]。在这些实验中,双重靶向分子产生的裂解作用明显强于单一靶向剂,以减少脱靶毒性。这些结果突出了双重靶向药物在白血病患者中进行有效和选择性免疫干预的潜力,并为在癌症治疗中使用双重靶向药物开辟了有吸引力的新前景[86]。
同样,scFv-IgG三特异性抗体可以通过在具有异二聚体化的Fc的标准IgG HCs的氨基或羧基末端添加2个具有不同抗原结合特异性的scFv来扩展[89](图3)。通过结合多种HIV-1包膜糖蛋白(Env)的能力,scFv-IgG三特异性形式已显示出在临床前对抗HIV的有希望的活性,该蛋白在单药治疗方案中迅速获得突变以逃避单个中和抗体(bNAb)[90]。使用scFv-IgG三特异性分子同时靶向不同的Env表位对于克服病毒多样性和针对多种HIV病毒株的保护是合乎需要的[89-91]。与单个亲本中和抗体(bNAbs)相比,这些三特异性分子显示出广泛的中和活性和增强的效力[89-91]。
此外,已经评估了基于Fab的三特异性抗体形式。在OrthoBsAb或串联OrthoFabs的N末端或C末端添加一个以上的OrthoFab会导致具有三特异性活性的XOrthoTsAbsY [92](图3)。与OrthoBsAbs相比,该方法需要同时共表达三个独立的Fab部分,并显着提高了LC错配的复杂性和潜力。在每个Fab部分中都没有正交Fab界面的情况下,正确配对的理论水平降至〜2-5%。但是,使用每个Fab部分中的正交Fab接口,可以将正确的配对驱动到更高的水平。很有希望的是,有一半的OrthoTsAb表现出> 80%的HC / LC正确组装[92]。在某些情况下,OrthoTsAb格式内的Fd / LC链交换可以改善正确的蛋白质装配。与每种抗原的单价结合限制了总分子量,并可能允许更精确地调节与每个靶标的亲和力,同时减少了形成大型免疫复合物的可能性。在一项研究中,评估了12种OrthoTsAb格式(6种HER2 / EGFR / cMet TsAb和6种PD-1 / CD137 / CTLA-4 TsAb)。所有的TsAbs都具有利用表面等离振子共振结合其3种不同抗原的能力[92]。由于OrthoTsAb的组装障碍要比OrthoBsAb的组装障碍高得多,因此可能需要在每个OrthoTsAb构建体甚至亲本mAb(尤其是表达和稳定性较差的mAb)中进行额外的工程或设计,以制备完全均质的OrthoTsAb [92]
三、关于活性和结合的接头长度/组成。 Linker length/composition on activity and binding
需要考虑将构建基与BsAb和TsAb融合蛋白的IgG连接的接头。接头必须稳定,无免疫原性,并且理想地具有足够的柔韧性,以使BsAbs和TsAbs内具有完全的抗原结合活性[93]。已知抗体分子中的天然铰链接头在结构域之间赋予柔性,这种柔性被认为对分子的物理性质以及抗原结合都是至关重要的[60]。已经利用了各种连接接头,例如短的丙氨酸接头,例如通过噬菌体展示鉴定的亲水性接头,富含甘氨酸-丝氨酸的接头(G4S)n以及衍生自各种免疫球蛋白和非免疫球蛋白分子的接头[3]。由来自人IgG的天然序列组成的接头消除了一些可能的免疫原性问题,这些问题可能是由于使用非Ig衍生的接头序列而引起的[94]。短接头可能会抑制抗原结合。应避免使用超长接头,因为它们可能会发生蛋白水解,并且可能不会限制某些结构域正确组装。连接接头的长度和组成也会影响分子的正确折叠,稳定性和抗原结合。分子建模策略被用于CODV-Igs中具有优良生化和生物物理特性的传统(G4S)n接头的接头设计[59]。此外,通过任意肽组成的序列或源自IgG CH1-CH2结构域转变或VL-CL结构域转变的序列来优化接头长度并替换全甘氨酸延伸序列,可以提高产量和聚集倾向[59]。 (G4S)n接头由于其柔韧性和对蛋白酶的抗性,通常用于BsAs和TsAb融合蛋白内的域间或分子内域相互作用。但是,翻译后修饰可能会发生,因为(G4S)n> 2个接头中丝氨酸残基的O-木糖基化会发生,应加以监测[95]。因此,接头组成仍然是BsAb和TsAb设计的重要方面。
四、异源二聚体Fc(重链配对)
具有天然全长IgG结构的双特异性单价抗体受益于具有类似抗体的PK和结构以及单价结合特性,从而可以更精确地调节抗原亲和力并潜在地降低抗体的亲和力和减少免疫复合物的大小。这两条重链的异二聚化是生成这些IgG BsAb的必要条件。在过去的二十年中,已开发出多种用于HC异二聚化的工程方法。多入孔技术(KiH)已被广泛用于产生双特异性IgG分子[96]。具有工程二硫键的CH3结构域突变(S354C:T366W和Y349C:T366S:L368A:Y407V)显示> 95%的异二聚体形成,并促进了双特异性IgG抗体的构建[97]。其他解决方案包括使用疏水性空间转向(例如HT-AF_S364H:Y349T / F405A:T394F [98]),静电转向(例如DD-KK_K409D:K392D / D399K:E356K [99])或两种力的组合(例如7.8.60_K360D:D399:Y407A / E345R:Q347R:T366V:K409V [69])诱导异二聚。 IgG-Fc异二聚体的设计多种多样,最近已进行了综述[3,16,100],在本综述中不再赘述
五、结论
基于抗体的构件的大小和稳定性各不相同。构建块的链接方式可能会影响其组装,总体几何形状,药代动力学和药效学。设计BsAb和TsAb时需要考虑所有这些变量,因为所有这些因素都会影响它们的整体功能。这些因素决定了哪种格式可能适用于特定的生物学应用,例如将免疫细胞重定向到靶标肿瘤或实现细胞选择性靶标。另外,可制造性或developability [101]是其他重要参数,直接受BsAb格式选择的影响。满足可开发性标准的BsAb应该稳定(例如,抗热变性),聚集趋势低,化学修饰的积累很少,并且(取决于施用方式)应具有高浓度配制的能力,而无需粘度问题[101]。但是,必须通过生成和比较不同格式的功能来确定合适的格式。有了许多可用的BsAb格式,构建模块和几何形状的选择可能是BsAb治疗候选药物最终获得治疗成功的关键组成部分[9]
参考资料
- X. Wu, S.J. Demarest, Building Blocks for Bispecific and Trispecific Antibodies, Methods (2018), doi: https://doi.org/10.1016/j.ymeth.2018.08.010
