【2.4.3.1】免疫球蛋白Fc异二聚体平台技术
Fc 编号规则
-
http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html
-
查看fc的allotype https://www.uniprot.org/uniprot/P01857#sequences
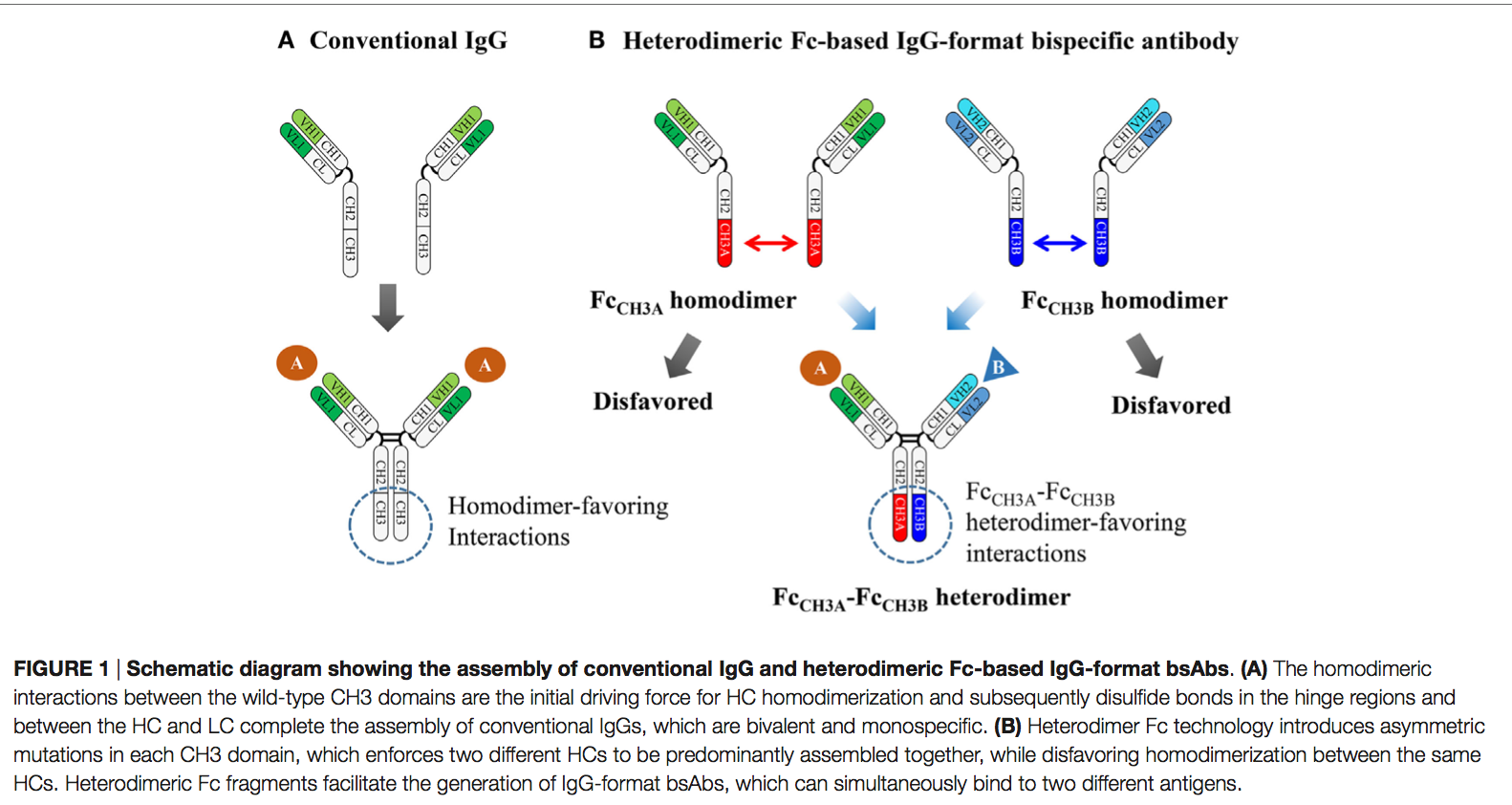
天然存在的免疫球蛋白G(IgG)抗体的单特异性(monospeci)和二价(bivalent)特征取决于两个相同重链(HC)的可结晶片段(Fc)片段的均二聚化(homodimerization),以及两个相同轻链(LC)的后续组装,它们通过各自之间的二硫键连接HC和LC。免疫球蛋白Fc异二聚体是通过对CH3结构域界面进行修饰而进行工程改造的,每个结构域具有不同的突变,从而使携带CH3变异对的工程化Fc片段优先形成异二聚体(heterodimers)而不是同源二聚体(homodimers)。许多研究小组已经采用了不同的策略来生成Fc异二聚体,目的是高异二聚体产率,同时保留野生型Fc的生物物理和生物学特性。基于它们在两种不同HC之间强制异源二聚化的能力,已建立的Fc异源二聚体已被广泛用作支架,以生成全长IgG和IgG样形式的双特异性抗体(bsAbs)。它们具有天然IgG抗体的许多有利特性,例如高稳定性,长血清半衰期,低免疫原性和免疫效应子功能。截至2016年7月,正在临床试验中评估7种以上基于异源二聚体Fc的IgG格式bsAb。除bsAbs外,异源二聚体Fc技术对于产生Fc融合蛋白和肽以及细胞因子(免疫细胞因子)非常有前途,可以天然的单体或异二聚体形式呈现融合伴侣,而不是具有野生型Fc的人工同二聚体形式。在这里,我们介绍了异二聚体Fc蛋白的产生及其在bsAbs的开发中以各种形式获得最佳生物活性的相关概念和策略。此外,我们描述了野生型Fc融合的单体和异源二聚体蛋白,以及与其制备相关的困难,并讨论了使用异源二聚体Fc作为野生型Fc对天然单体或异源二聚体蛋白的替代支架的用途,具有新型治疗方法的Fc融合蛋白。
一、介绍
双特异性抗体(bsAbs)结合两个不同的抗原或同一抗原上的两个不同的表位;它们不同于天然存在的免疫球蛋白G(IgG)单特异性抗体(mAb)(1、2)。由于具有额外的靶向能力,bsAb常常可改善治疗复杂疾病(如癌症和免疫紊乱)的临床益处,其中涉及多种细胞表面受体或配体(1-3)。为了将mAb工程化为bsAb,已经做出了许多努力,从而产生了60多种不同的bsAb格式(3-5)。通过连接抗体片段,例如单链可变片段(scFv),抗原结合片段(Fab),重链(VH)和轻链(VL)可变域,以及它们与IgG的附件,可以改造许多bsAb格式的单克隆抗体(3–6)。但是,这些不同于常规IgG结构的新形式通常具有较差的理化特性,例如溶解度和聚集度低,大规模生产困难,药物动力学差以及潜在的免疫原性(3-6)。为了提高可开发性,已广泛开发了完整IgG或类似IgG(包含Fc)结构的形式的bsAb(5-7)。
常规IgG抗体是二价和单特异性的,其组装取决于两个相同重链(HCs)的体内均二聚化,这是由CH3域之间的同二聚体缔合介导的,随后是每个HC与每个轻链(LC)之间的二硫键 ,在B细胞中(8-11)。 因此,使用具有野生型HC和LC的完整IgG格式开发bsAb时,将面临HC-HC和HCVH-CH1-LC配对错误的问题(5、7)。 已经使用了基于野生型同型二聚体Fc区的基于IgG的bsAb的一些方法,例如双作用Fab(DAF,two-in-one antibody)(12),κλ抗体(13), 和大鼠/小鼠嵌合抗体(14)。 但是,DAF和κλ抗体技术需要大量的抗体工程设计和筛选,并且不容易通过以前建立的mAb生成。 大鼠/小鼠嵌合抗体需要多个纯化步骤,纯化产率低,并且面临潜在的免疫原性。
为了解决HC配对错误的问题,已经开发了异二聚体Fc技术,该技术可使两个不同的HC优先组装在一起,而不是使用相同的HC(5、7、15)。已使用CrossMab技术(17)和邻位Fab IgG技术(18)与常见的LC方法(16)或与两个不同的LC结合开发了基于二聚体,基于Fc的完整IgG格式bsAb。通过附加抗原结合抗体片段,例如VH,VL,scFv,Fab和单链Fab(scFab),已广泛地利用其他异二聚Fc支架来生成IgG样bsAb。根据设计的架构,所得的bsAb在抗原特异性(从单特异性到四特异性)和抗原结合价(从单价到四价)方面有所不同。除了用于bsAbs的异源二聚体IgG支架外,异源二聚体Fc片段现在也以优异的支架形式出现,可产生Fc融合的单体或异源二聚体蛋白或细胞因子,这是通过野生型同源二聚体Fc实现的挑战性形式。
在这篇综述中,我们首先关注异二聚体Fc的设计和产生,及其在多种形式的治疗性bsAbs开发中的应用。 然后,我们描述了同型二聚体Fc融合的单体蛋白和多肽的当前状态,并提出异二聚体Fc片段可以将融合伴侣呈现为天然样单体或异二聚体形式,代表了下一代Fc融合蛋白和细胞因子的有希望的支架 。
二、异二聚体Fc工程 Heterodimeric Fc Engineering
野生型Fc均二聚化最初是通过两个紧密亚纳米摩尔亲和力相同的CH3域之间的紧密连接的大界面(〜2469Å2埋入表面积)介导的,随后通过铰链区的二硫键介导(图1A)。 由于这个原因,主要通过在CH3结构域界面处的同源二聚体亲和性相互作用替换为异源二聚体亲和性相互作用来设计异源二聚体Fc变体。 这是通过在每个CH3域中引入不对称突变来实现的,该突变促进了两种不同抗体的HC组装(图1B)。 使用CH3变异对的这种异二聚体Fc工程已经通过两种策略进行了研究:
- 基于结构的合理设计和
- 定向进化。
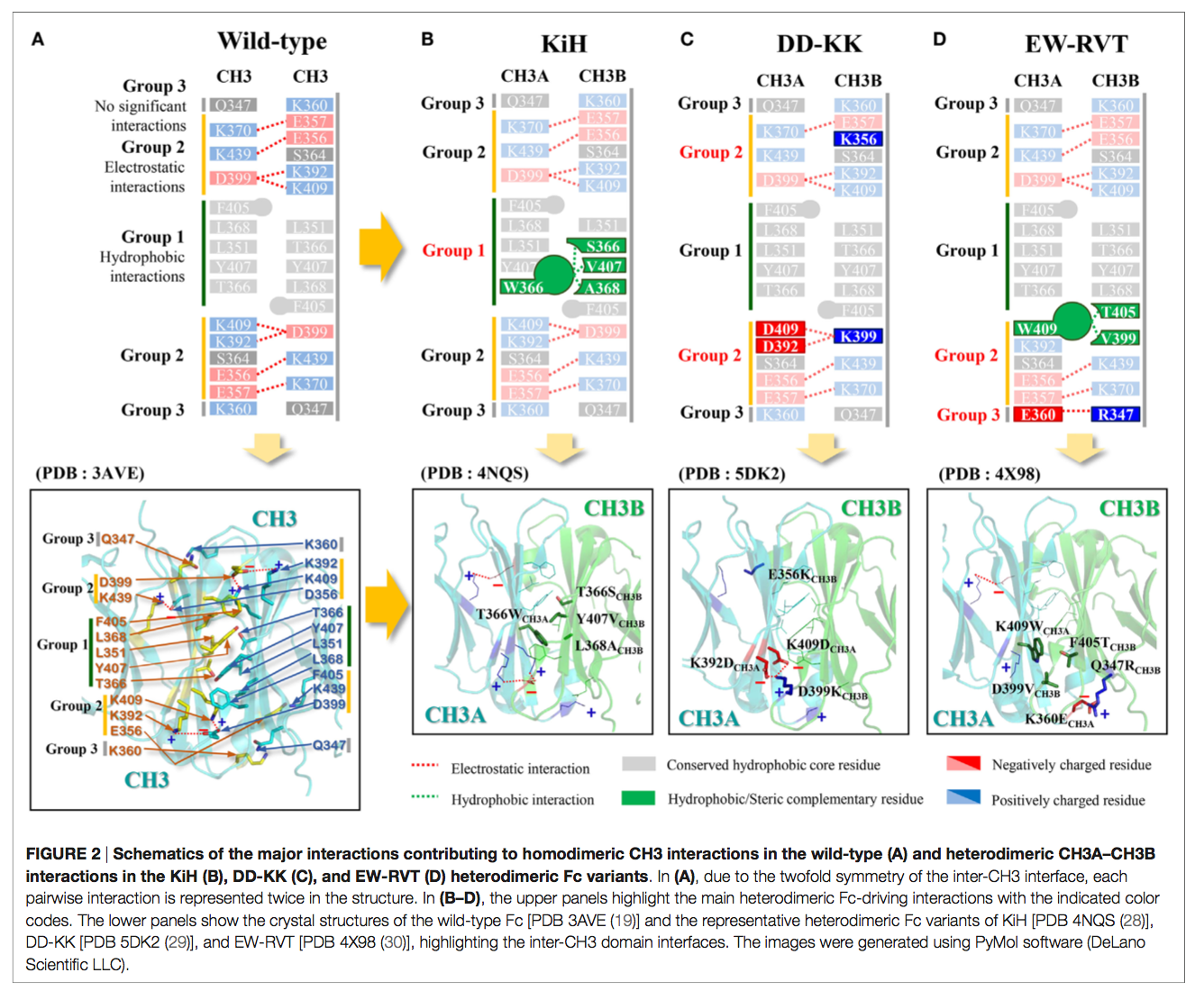
人IgG1 Fc的X射线晶体结构表明Fc均二聚化是由CH3界面核心中心的疏水相互作用和围绕疏水核心边缘的对称静电相互作用(19、20)驱动的,如图2A所示。因此,已经利用基于结构的异二聚体Fc片段的合理设计来生成在CH3界面核心的每条链中具有不同突变的异二聚体CH3变体对(CH3A:CH3B),使得该变体对在热力学上比异二聚体更倾向于形成异二聚体。此类异二聚体CH3变异对的基于结构的合理设计可分为四种策略:
- 对称至非对称空间互补设计(例如KiH,HA-TF和ZW1)(21-24),
- 电荷对电荷交换(例如DD-KK)(25),
- 电荷对空间互补交换以及其他远程静电相互作用(例如EW-RVT)
- 同种型链交换[例如,链交换工程结构域(SEED)](7,24),如表1所示。
异二聚Fc工程设计中的关键参数包括在不需要的同二聚Fc contaminants上形成异二聚Fc的产率,稳定性损失最小相对于天然Fc,并保持天然Fc类特性,例如血清半衰期和效应子功能。通过共表达两种基于异源二聚体Fc的抗体,异源二聚体Fc定向的bsAb的形成通常可产生超过90%的所需产物。这使得大规模生产和质量控制满足临床需求变得可行。与异源二聚体Fc工程技术相反,通过在CH3界面处引入四个突变探索了一种生成单体Fc片段的方法(27)。
2.1 对称到非对称立体互补设计 Symmetric-to-Asymmetric Steric Complementarity Design
Genentech公司的Carter及其同事以一种开创性的方法构思了异二聚体Fc变体,并发明了所谓的“Knobs-into-Holes(KiH)” Fc技术(21、22)。其概念是在一个CH3域(CH3A)中引入“knob”,方法是将一个小的残基替换为一个大的残基(即EU编号中的T366WCH3A)。为了适应“knob”,通过用较小的旋钮(例如,T366S / L368A / Y407VCH3B)替换旋钮附近最接近的残基,在另一个CH3域(CH3B)上创建了一个互补的“hole”表面(图2B)(15 )。通过结构指导的噬菌体文库筛选优化了“孔”突变(21)。 KiH Fc变体的X射线晶体结构(28,33)表明,CH2域间核心界面处的空间互补性驱动的疏水相互作用在热力学上有利于异二聚化,而knob–knob和 hole–hole界面则不利分别由于空间位阻和有利相互作用的破坏而发生同源二聚化。通过引入额外的CH3域间二硫键对S354CCH3A–Y349CCH3B,进一步生成KiH Fc,以提高纯度和稳定性,从而生成KiHS-S Fc变体。这显示出较高的异二聚化收率(〜95%),并在6至〜78°C时提高了CH3域的热熔解(Tm)(16)。目前在临床试验中评估的大多数基于KiH Fc的bsAb已采用KiHS-S Fc作为支架(表2)。
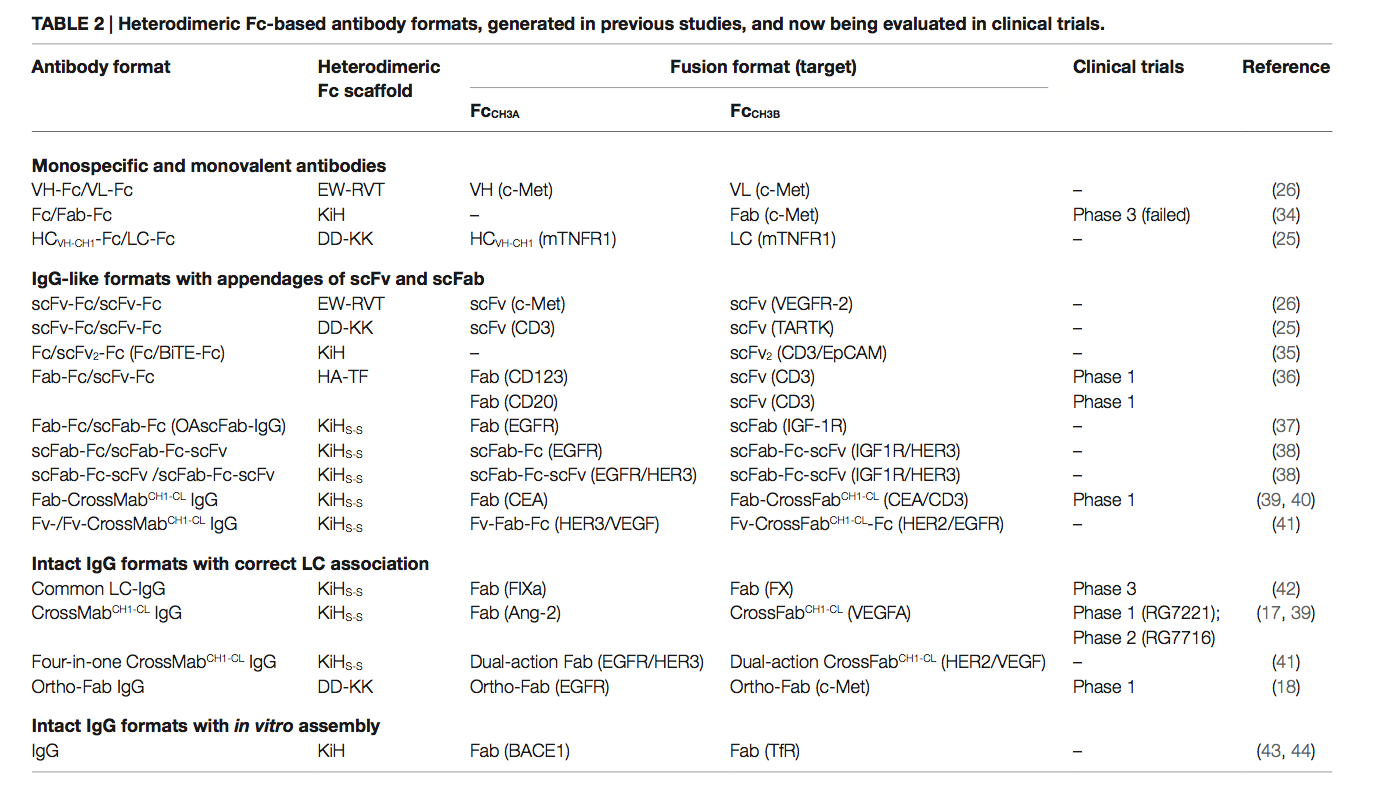
已采用广泛的策略,将许多变体的基于结构的计算设计与随后的实验验证相结合,以评估异二聚化产率,以生成具有空间互补突变的其他异二聚体Fc变体。这些包括来自Xencor(23)的HA-TF Fc和来自Zymeworks(24)的ZW1 Fc。尤其是,ZW1是通过两步法生成的,结合了阴性设计,首先破坏了CH3-CH3界面上天然的Fc同源二聚体的亲和力,然后对先前设计的变体进行了阳性设计,以增加其生物物理稳定性(24、45)。阴性设计可最大程度提高潜在同二聚体之间的不利相互作用,同时提高异二聚体物种之间的特异性,从而生成F405A / Y407VCH3A–T366L / T394WCH3B的Fc变体,异源二聚化率约为95%(24)。但是,CH3域的Tm为〜72°C,与KiH Fc(22)相似,但比野生型CH3域的Tm(30)低〜10°C。随后的阳性设计在第一个变体中添加了T350V / L351YCH3A–T350V / K392LCH3B突变,产生了ZW1(T350V / L351Y / F405A / Y407VCH3A–T350V / T366L / K392L / T394WCH3B),保留了约95%的高Fc异二聚化产率,并表现出与野生型CH3域相似的Fc稳定性,Tm值为81.5°C(24)。 ZW1的高异源二聚体纯度已通过在中国仓鼠卵巢(CHO)细胞中稳定表达而得到证实,并且良好的生物物理特性可以改善基于ZW1的bsAb的可制造性(45)。
最近,Leaven-Fay等人(29)使用显式多态设计(explicit multistate design)(序列优化)与否定设计相结合,通过计算产生了异二聚体Fc变体,从而破坏并消除了对同二聚体有利的CH3间相互作用。最佳克隆之一7.8.60 Fc,是通过引入D399MCH3A–K409VCH3B的突变来消除野生型CH3界面中D399-K392 / K409保守的静电相互作用而设计的。在下一轮中,计算优化顺序确定了以下取代:Y407ACH3A–T366VCH3B以最大程度地减少CH3B同二聚体并改善异二聚体形成,K360DCH3A – Q347RCH3B以消除CH3B同二聚体,最后是E345RCH3B以增强K360DCH3A−Q347RCH3B相互作用(表1) 。确定的晶体结构清楚地分辨了界面,表明模型非常准确。 7.8.60异源二聚体Fc与正交Fab接口突变技术(18)结合产生了纯度约为93%的完整IgG格式bsAb(29)。
2.2 充电对换设计 Charge-to-Charge Swap Design
作为替代方法,来自Amgen 的Gunasekaran等(25)的人试图通过反转CH3结构域界面上的对称电荷互补性来设计异二聚体Fc,同时保留疏水核心的完整性(图2C)。由于在CH3间的界面处具有双重对称性,因此在疏水核的两个外围侧面上对称地复制了目标静电相互作用对(图2A)。他们首先通过设计K409DCH3A–D399KCH3B对变异体,然后通过实验评估异二聚化产率进一步筛选其他电荷对突变,将对称的电荷对残基转化为不对称的电荷极性。这导致DD-KK具有K409D / K392DCH3A–D399K / E356KCH3B突变对。不对称电荷突变对驱动异二聚化,而不利的排斥电荷相互作用则抑制了“正电荷”和“负电荷”同二聚体。特别是,引入E356KCH3B试图抑制FcCH3B-FcCH3B均二聚,以提高FcCH3A-FcCH3B异二聚体的纯度。 DD-KK设计导致了大于90%的异二聚化,具体取决于两条链的转染率。
2.3 电荷间互补交换和远距离静电相互作用设计 Charge-to-Steric Complementarity Swap and Long-Range Electrostatic Interaction Design
KiH和DD-KK Fc设计的概念可以概括为用相同但不对称的相互作用代替CH3界面上保守的对称疏水和静电相互作用。与基于空间的KiH设计和电荷交换DD-KK设计相反,Choi等人(26)用不对称的疏水相互作用代替了在CH3结构域的掩埋界面上保守的对称静电相互作用。这导致产生具有K409WCH3A–D399V / F405TCH3B突变的W-VT Fc变体,由于互补的疏水相互作用而促进Fc异二聚体形成(〜77%纯度),同时由于K409–D399静电相互作用的丧失和K409WCH3A–F405CH3A的空间碰撞而不利于同二聚体。为了提高W-VT的异二聚化产量,他们用可忽略的相互作用取代了K360-Q347对,这是由于CH3界面边缘(19)的长距离(4.61Å)被K360ECH3A-Q347RCH3B不对称突变对所取代。之所以偏爱异二聚体,是因为其在3.45Å距离处具有长距离静电相互作用(30)。组合的异二聚体Fc被称为EW-RVT(图2D),显示异二聚体产率为〜91%,CH3域Tm值为〜77.5°C,与KiH和DD-KK Fc变体相当(26) 。 EW-RVT Fc异二聚体的X射线晶体结构导致CH349间的二硫键与Y349CCH3A–S354CCH3B对的加成,产生了EW-RVTS-S Fc。通过解析晶体结构(30)来确认不对称的二硫键。与亲本EW-RVT Fc的那些参数相比,EW-RVTS-S Fc显示出提高的异二聚体产率(约3%)和更高的CH3域热力学稳定性(约2.8°C)(30)。为确定CH3A / CH3B界面的分子细节而获得的EW-RVT和EW-RVTS-S Fc片段的晶体结构表明,突变并未引起Fc结构的任何显着变化(30)。与晶体结构一致,EW-RVT Fc异二聚体显示出与天然IgG1相同的天然IgG1样,pH依赖性,新生Fc受体(FcRn)结合模式和Fcγ受体(FcγR)相互作用。 (先前报道)(46,47)。这表明基于EW-RVT的抗体将具有与常规人IgG1相似的血清半衰期和效应子功能。
2.4 同型链交换设计 Isotype Strand Swap Design
来自Merck Serono(31)的Davis等人通过将人IgG和IgA CH3域片段混合以创建互补的CH3异二聚体(称为SEED Fc)来设计异二聚体Fc。 人IgA和IgG的天然CH3结构域在结构上相似(10),但由于界面残基内同源性较低而无法二聚。 他们分析了每个同种型CH3域中的结构二聚化基序,并通过交换每个同种型CH3域中的一些β链段来设计SEED,以驱动通过空间互补接触表面形成异二聚体。 基于SEED的抗体(例如SEEDbody)用蛋白A树脂纯化,并具有与野生型基于人IgG1 Fc的抗体相当的血清半衰期和效应子功能(48)。 但是,由于SEED CH3异二聚体的人工序列,潜在的免疫原性尚未确定。
2.5 异二聚体Fc的定向进化 Directed Evolution of Heterodimeric Fc
通过基于结构的合理设计或计算模型已经产生了上述Fc异二聚体。最近,Choi等(32)通过定向进化结合酵母表面展示和高通量筛选产生了异二聚体Fc变体(49,50)。通过使两个单倍体酵母细胞系交配,开发了组合异源二聚体Fc文库展示系统。一个单倍体细胞系展示了一个在酵母细胞表面一个CH3域中具有突变的Fc链文库(展示了FcCH3A),另一个细胞系分泌了另一个CH3域中具有突变的Fc链文库(分泌的FcCH3B)。在交配的细胞中,分泌的FcCH3B通过与展示的FcCH3A的异源二聚作用而展示在细胞表面上。基于荧光的这种相互作用的检测使得能够通过流式细胞术筛选文库中的异二聚体Fc变体。为了进行概念验证,他们基于W-VT Fc变体的模板构建了在CH3A和CH3B的目标残基上同时发生突变的组合异二聚Fc文库,并筛选了这些文库以分离出许多具有异二聚化产率〜90%的异二聚Fc变体。 这种定向进化方法确定了CH3界面上意想不到的异二聚体偏好突变对,例如氢键或阳离子-π相互作用,以及同二聚体不利配对,这些均未通过结构指导的合理设计进行测试。最好的克隆A107表现出〜93%的异二聚化产率,远高于亲本W-VT Fc变体的异二聚化产率(〜77%)。
三、多种形式的基于异源二聚体的Fc抗体 Heterodimeric Fc-Based Antibodies in Diverse Formats
异二聚体Fc与两个不同的抗原结合单元,独立融合到每个Fc链的N和/或C端。 如图3和表2所示,这有助于创建具有不同特异性,结合价,靶结合位点几何形状等差异的异源二聚Fc基抗体。
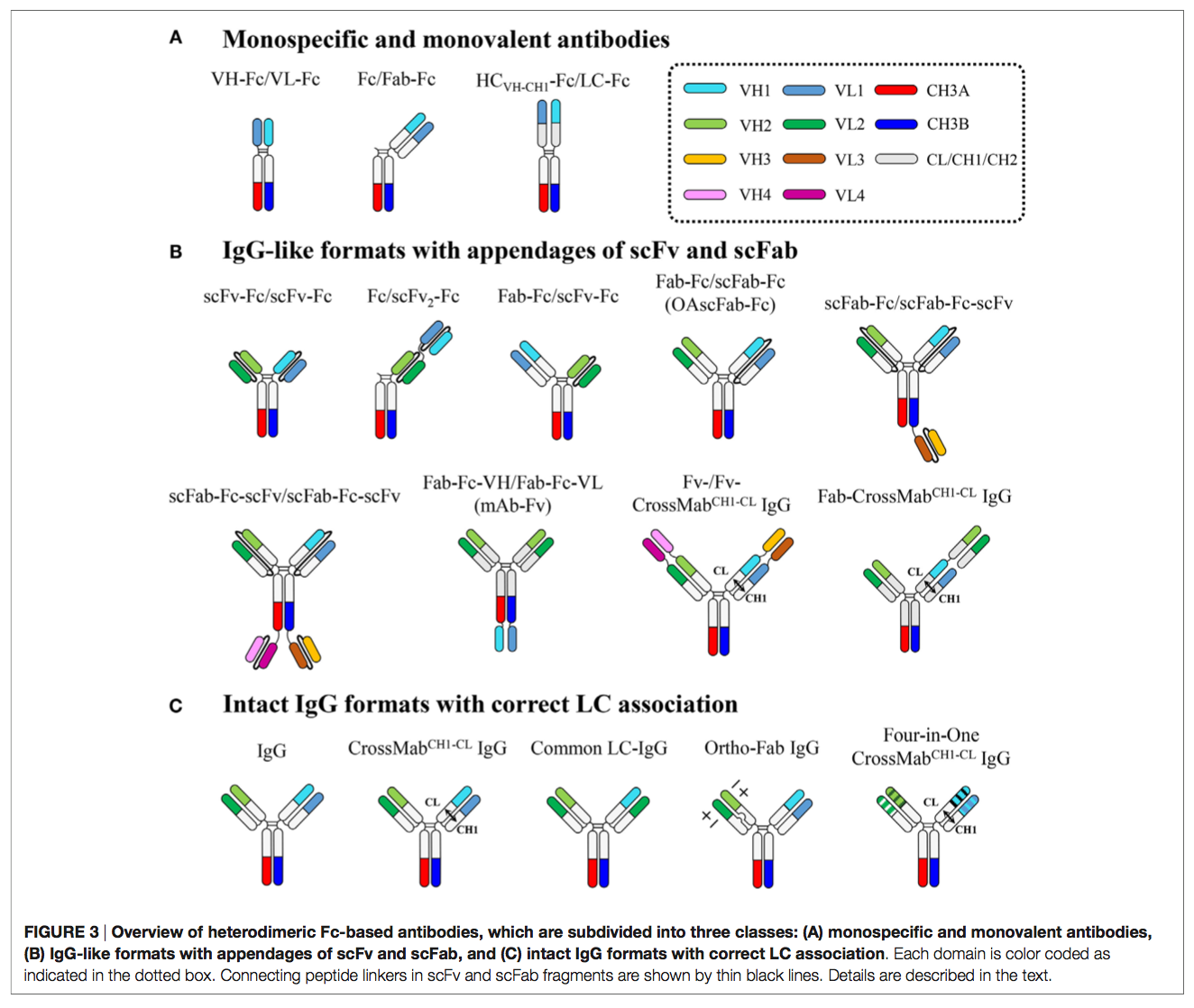
3.1 单特异性和单价抗体 Monospecific and Monovalent Antibodies
通过将Fab与仅一条Fc链(Fc / Fab-Fc)的N末端,scFv与仅一条Fc的N末端融合而产生了具有单价抗原结合的异二聚体Fc单特异性抗体(mAb) 链(Fc / scFv-Fc),VH-CH1(HCVH-CH1)和VL-CL到每个异二聚Fc链的相应N末端(HCVH-CH1-Fc / LC-Fc)或VH和VL 每个异二聚体Fc链(VH-Fc / VL-Fc)的相应N-末端连接(图3)。
典型的IgG抗体的Y形通常会限制其对某些靶标的效用,从而使二价靶标结合使目标靶标二聚化并激动,而不是拮抗目标靶标。例如,用二价抗体靶向c-Met受体酪氨酸激酶可以通过受体二聚化模拟配体肝细胞生长因子(HGF)介导的激动作用(51)。为了解决这个问题,Genentech开发了基于KiH Fc的单臂Fc / Fab-Fc格式单价抗体onartuzumab(MetMab), 通过将人源化的抗c-Met 5D5 Fab融合到Fc链“孔”的N端(34)。二价抗c-Met 5D5 IgG抗体起激动剂的作用,引起c-Met激活的肿瘤细胞生长,而不是生长抑制,而单价MetMab则以一对一的方式结合受体以抑制HGF结合并阻断受体激活,从而充当拮抗剂。在单个质粒上从三个相应的顺反子共表达三条链,特别是Fc,HCVH-CH1-Fc和LC,并将这些链靶向大肠杆菌的周质空间,有效地产生了MetMab。通过尺寸排阻色谱法纯化获得〜95%的纯度(34)。 MetMab联合表皮生长因子受体(EGFR)激酶抑制剂厄洛替尼阻断非小细胞肺癌转移的临床试验最近在第3阶段中止,但有望进行MetMab的其他临床试验。 EW-RVT Fc变异体也用于制备VH-Fc / VL-Fc形式的MetMAb样单价抗体,称为msMet,其中MetMab的VH和VL与每个异二聚Fc链的N端融合(26)。作为单一试剂,msMet抗体抑制了人类胃癌异种移植物在小鼠体内的肿瘤生长。
利用DD-KK Fc产生HCVH-CH1-Fc / LC-Fc格式的单价14D2抗体,通过连接抗-HCV的VH-CH1和VL-CL来靶向肿瘤坏死因子受体1(TNFR1)。 每个异二聚体Fc链N端的TNFR1 14D2抗体(25)。 亲本二价14D2抗体显示出不良活性,特别是通过受体的交联低剂量激活TNFR1,这与TNF配体所观察到的相似。 但是,单价抗体没有激动活性,并在小鼠中阻断了TNF介导的趋化因子诱导。 重要的是,当在小鼠体内注射时,单价14D2抗体表现出与全长IgG相似的药代动力学特征。
3.2 类似于scFv和scFab的IgG样格式 IgG-Like Formats with Appendages of scFv and scFab
异二聚体Fc技术可以解决HC错配问题,但仍然面临LC配对问题的挑战,特别是在Fab区中同源HCVH-CH1-LC配对,以生成完整IgG格式的bsAb(5,7)。 为了解决HCVH-CH1-LC配对问题,单链抗原结合单元(例如scFv和scFab)已分别连接到每个异二聚Fc链或串联连接到一条异二聚Fc链,从而产生IgG样 以scFv-Fc / scFv-Fc,scFab-Fc / scFab-Fc,Fc / scFv2-Fc,Fab-Fc-VH / Fab-Fc-VL,Fab-Fc / scFv-Fc,Fab-Fc / scFab-Fc和scFab-Fc-(scFv)/ scFab-Fc-scFv(图3)。
利用EW-RVT Fc生成bsAb,称为bsVeMet,同时靶向c-Met和VEGF受体2(VEGFR-2), 具有两个分别以scFv-Fc / scFv-Fc形式与每个异二聚体Fc的N末端融合的抗原特异性scFv。 与两种亲本mAb相比,bsVeMet更有效地抑制了HGF和VEGF刺激的细胞增殖,下游信号传导和体内血管生成。
此外,bsAb已被广泛设计为将免疫效应细胞(例如T细胞)募集到肿瘤细胞中(52、53)。通过串联连接两个scFv构建双特异性T细胞融合蛋白(BiTE),其中一个对T细胞上的CD3具有特异性,而另一个对肿瘤细胞表面上与肿瘤相关的抗原具有特异性。这种策略的目标是使细胞毒性T细胞裂解表达抗原的靶向癌细胞,这是由Mack及其同事首先开发的(54)。后来,Micromet开发了CD19×CD3 BiTE blinatumomab,并于2014年获得临床批准,用于治疗复发/难治性B细胞急性淋巴细胞白血病(55)。但是,基于串联scFv的BiTE在小鼠中的血清半衰期仅为5–6 h(56),比含Fc的抗体的半衰期短得多。 blinatumomab的快速清除需要输注或重复注射以维持更长的治疗有效剂量,特别是在临床试验中每天输注8周(57)。为了改善此类基于scFv的BiTE的药代动力学,通过融合具有不同结合特异性的两种scFv,一种针对人CD3,另一种针对肿瘤,将scFv-Fc / scFv-Fc形式的DD-KK Fc型bsAb生成。与每个Fc异二聚体链相关的受体酪氨酸激酶(TARTK)(25)。由于Fc区的存在,与其他类型的CD3双特异性scFv片段相比,scFv-Fc / scFv-Fc抗体在小鼠体内表现出更长的体内半衰期,并且给药频率较低。在异种移植小鼠模型中,CD3×TARTK bsAb完全抑制了TARTK阳性神经胶质瘤的生长。
Sutro Biopharma的Xu等(35)使用基于大肠杆菌的无细胞表达系统生产了基于KiH Fc的BiTE bsAb。他们设计了两臂scFv-Fc / scFv-Fc形式或单臂Fc / scFv2-Fc(即Fc / BiTE-Fc)形式的上皮细胞粘附分子(EpCAM)×CD3 bsAb,然后进一步颠倒了两者通过交换“knob” Fc和“hole” Fc融合伴侣形成不同格式。他们发现表达产量和生物学活性(例如双重靶向和通过接合T细胞杀死肿瘤细胞)高度可变,并取决于形式。这表明,对于两个scFv或串联scFv BiTE,为了确定Fc融合伴侣的无细胞表达增强的两个表达质粒的最佳比例,需要更复杂的优化过程。有趣的是,基于KiH Fc的bsAb(100 kDa)的血清半衰期(T1 / 2≈4.9–5.2天)比BiTE对照(50 kDa)(T1 / 2≈0.2天)明显更长。与曲妥珠单抗IgG(150 kDa)(T1 / 2≈25天)和scFv-Fc(100 kDa)(T1 / 2≈9.1天)相比。这可能归因于KiH Fc的CH3域中的不稳定突变(35)。
Xencor使用HA-TF Fc支架通过融合CD3或CD16抗体的VH和VL结构域以Fab-Fc-VH / Fab-Fc-VL(配成mAb-Fv)格式生成了Her2×CD3或Her2×CD16 bsAb两个不同HC的C末端(23)。与单价靶标结合形式(例如scFv-Fc / scFv-Fc和scFab-Fc / scFab)相比,mAb-Fv形式的优势是由于通过IgG mAb的两个完整臂进行的二价抗原结合,提高了肿瘤靶向性-Fc。然而,与母体Fab相比,mAb-Fv显示出非天然寡聚物种,并且C端Fv显示出对CD16或CD3抗原的较弱亲和力。这很可能是由于空间位阻,并建议需要对C末端融合的Fv进行优化。由于这些原因,Xencor采用了基于HA-TF Fc的Fab-Fc / scFv-Fc bsAb格式(dubbed “plug-and-play” platform),该格式显示出天然的mAb样稳定性和不受影响的抗原结合活性( 36)。例如,Fab-Fc / scFv-Fc格式的bsAb,例如CD123×CD3(XmAb14045)和CD20×CD3(XmAb13676),预计将开始急性髓细胞白血病(NCT02730312)和B细胞恶性肿瘤的临床1期试验。分别在2016.1年,Glenmark Pharm公司还在开发基于异二聚体Fc的Fab-Fc / scFv-Fc格式的bsAb(Glenmark称为“ BEAT”),其中异二聚体Fc是通过引入突变来设计的,模仿了异二聚体T细胞受体(TCR)的α和β链进入IgG的两个CH3结构域之间的界面(58)。
来自Roche(37,59)的Schanzer等人以Fab-Fc / scFab-Fc的形式生成了基于KiH Fc的bsAb XGFR,以Fab形式在一只手臂中靶向EGFR,并且胰岛素样生长因子受体I型(另一臂中具有scFab格式的IGF-1R)。设计了XGFR bsAb的格式,即所谓的单臂scFab IgG(OAscFab-IgG),以防止LC的错误配对,同时保持与完整IgG最接近的格式。产生XGFR的高表达产量可与各自的亲本IgG mAb媲美。但是,其他测试过的bsAb形式的IgG-scFv(IGF-1R IgG具有C端连接了二硫键稳定的EGFR scFv)和双变量域(DVD)-IgG(IGF-1R IgG具有EGFR N端连接HC和LC中的VH和VL分别比OAscFab-IgG格式的表达产量低约2倍和16倍(37、59)。为了进一步增加由XGFR bsAb触发的免疫效应子功能,对异二聚体Fc部分进行了糖基化处理以去除岩藻糖基化,从而导致强烈的抗体依赖性细胞介导的细胞毒性。所得的XGFR在多种小鼠异种移植肿瘤模型中显示出有效的抗肿瘤功效(37、59)。此外,Castoldi等。 Roche(38)制备了一种基于KiHS-S Fc的三特异性抗体(称为TriMAb),其结构为scFab-Fc-(scFv)/ scFab-Fc-scFv,其中抗EGFR和抗IGF-1R scFab处于将具有抗-Her3 scFv的IgG的相应臂融合至两条链或仅一条链的C末端。在模型细胞增殖试验中,EGFR×IGF-1R×HER3 TriMAb的生长抑制作用可与每种单亲本抗体的组合媲美。
3.3 具有正确LC关联的完整IgG格式 Intact IgG Formats with Correct LC Association
基于将scFv和scFab添加到异二聚Fc片段上的IgG样bsAb克服了Fab区域内的HCVH-CH1-LC错配问题,但它们在连接子(linkers)的使用方面受到限制,其长度和组成通常需要优化。欠佳的接头可能会导致不良问题,例如由于结合位点障碍,表达水平低,免疫原性,药代动力学差和体内裂解而导致的抗原结合丧失。因此,已经进行了许多尝试来开发在不使用人工接头的情况下最小限度地偏离天然IgG抗体的bsAb。由于抗原特异性通常位于由VH和VL组成的Fv链中,因此在bsAb的共表达和组装过程中同源HC和LC之间的正确配对对于确保抗原结合特异性和亲和力至关重要。发生LC错误配对是因为两种不同抗体之间VH–VL和CH1-CL的Fab异二聚化界面几乎相同,尽管VH和VL的互补决定区(CDR)完全不同。因此,为了使用全长IgG格式生成bsAb,除了通过异二聚体Fc技术进行正确的HC配对外,还应确保相关的HCVH-CH1-LC配对。通过使用通用LC(15,16),域交叉(CrossMab)(17)和设计的正交Fab接口(18)解决了LC配对错误的问题(图3)。
使用与两种不同的HCVH-CH1s兼容的通用LC是构建具有完整IgG格式的bsAb的直接方法(15)。可以首先从共享相同VL的人scFv噬菌体文库中分离出两个mAb,然后使用基于KiH Fc的HC异二聚化将其组装成单个IgG格式(16、60)。但是,这种方法用单个LC限制了两个不同靶标的抗体发现,或者需要新的抗体库,并且在使用两个不同的先前建立的抗体时很难采用。将普通LC与KiH Fc结合使用的IgG格式bsAb的一个显着例子是Chugai开发的艾米珠单抗(ACE910),其靶向因子IXa和因子X(FIXa×FX)(61,62)。他们首先通过用人FIXa和FX抗原免疫小鼠来产生各种FIXa和FX特异的mAb,然后基于保留的生物学活性和仅使用一个LC的可行性来产生先导嵌合bsAb(62)。 FIXa和FX与辅因子FVIII形成复合物,但该复合物在A型血友病患者中缺乏。该疾病的标准治疗方法包括频繁注射重组或血浆来源的VIII因子(62)。 Emicizumab通过允许FIXa和FX紧密结合形成复合物来模拟FVIII功能。这是因为FVIIIa的FIXa和FX结合位点之间的距离类似于Y形IgG的两个抗原结合位点臂之间的距离。 Emicizumab克服了重组FVIII的短半衰期(T1 / 2≈0.5天),并有望降低免疫原性。 Emicizumab现在处于A型血友病患者(NCT02622321)的3期临床研究中(42)。
为了促进普通LC抗体的产生,Merus开发了一种转基因小鼠(MeMo),其经过工程改造可产生具有单个人类普通LC和多种人类HC的抗体(63)。 MeMo技术与他们自己的CH3域工程化异源二聚体Fc技术相结合,使他们能够生成完整的IgG格式bsAb(Merus称为Biclonics)。 现在正在1/2期临床试验中针对实体瘤患者评估针对Her2×Her3的基于Biclonics的bsAb MCLA-128(64)。
Roche(17)的CrossMab技术是结合HC Fc技术解决HCVH-CH1-LC缔合问题的另一种策略。此技术使一个Fab保持不变,而另一个Fab的VH或CH1域则与伙伴VL或CL域切换。在CrossMab的概念验证的早期阶段,根据交叉区域以三种格式对它们进行了评估:(1)CrossMabFab,完整的VH-CH1和VL-CL域的交叉,(2)CrossMabVH-VL,交叉(3)CrossMabCH1-CL,仅CH1和CL域的交叉。尽管这三种CrossMab变体显示出与亲本IgG mAb相当的热稳定性,但CrossMabCH1-CL格式仅显示出极少的不需要的副产物。然而,其他两种形式生产了副产品的一部分(17)。因此,与其他两种格式相比,主要使用了CrossMabCH1-CL格式。基于CrossMab的bsAb可以很容易地使用结构域交换从既存的抗体对衍生而来,而无需鉴定正确的LC关联所需的常见LC和Fab接口突变(39)。已经产生并评估了许多CrossMAb,目前有四种不同的基于CrossMab的bsAb正在1/2期临床试验中(39)(表1)。例如,目前正在临床试验中评估两种版本的VEGF×Ang2 CrossMabCH1-CL:(1)患有癌症的患者(NCT01688206)和(2)处于阶段1的RG7221(Vanucizumab),一种VEGF×Ang2 CrossMabCH1-CL。 )RG7716,另一种特制的VEGF×Ang2 CrossMabCH1-CL,在2期针对黄斑变性患者的试验中(NCT02484690)。
通过将Fab融合到N端,进一步扩展了CrossMabCH1-CL格式,以生成三价bsAb的Fab-CrossMabCH1-CL格式(图3)。使用这种格式,开发出了被称为CEA-TCB的与癌胚抗原(CEA)具有二价结合的基于IgG的T细胞bsAb(TCB)(40)。目前,正在进行CEA-TCB的1期临床试验(NCT02324257),用于治疗表达CEA的实体瘤(39)。此外,两种不同DAF(双重作用Fab,two-in-one antibody),一种EGFR×Her3 DAF和另一种Her2×VEGF DAF的基因融合到KiH-的每条臂的N端。基于四合一的CrossMabCH1-CL格式产生了靶向四特异性IgG格式抗体的EGFR×Her3×Her2×VEGF(41)(图3)。同一小组还通过结合CrossMabCH1-CL和DVD-IgG技术(65)产生了靶向四特异性四价EGFR×Her3×Her2×VEGF的抗体,产生了Fv- / Fv-CrossMabCH1-CL IgG格式(41)(图3)。
强制正确的HCVH-CH1-LC关联的另一种方法包括在异二聚体VL-CL和VH-CH1接口处引入一组突变(18、66、67),类似于为异二聚体Fc设计修改CH3接口 。 在邻-Fab IgG方法中(18),基于结构的区域设计仅在一个Fab中的LC和HCVH-CH1界面处引入了互补突变,而对另一Fab没有任何改变(图3)。 基于ortho-Fab IgG格式与异二聚体Fc技术相结合,产生了来自礼来公司的EGFR×c-Met bsAb(LY3164530),目前正在对晚期或转移性癌症患者进行1期临床研究(NCT02221882) )。 Zymeworks目前还正在开发通过结合邻-Fab IgG和ZW1 Fc技术生成的完整IgG格式bsAb。
3.4 完整IgG格式的体外组装 In Vitro Assembly of Intact IgG Formats
单独使用异二聚体Fc技术,而不结合HCVH-CH1-LC缔合技术,可以通过分别表达两个亲本半抗体[HC-LC(HL)对],并随后在体外重组为理想的bsAbs来产生完整的IgG格式bsAb。 其组装是由受控的生化条件下有利于异二聚体的Fc相互作用驱动的(60)。这种方法可在亲本半抗体的表达阶段实现正确的HCVH-CH1-LC缔合,并在下一步的体外组装步骤中保持相关的HCVH-CH1-LC配对。 来自Genentech的Spiess等(68)的方法进一步通过将两个转化的大肠杆菌细胞系共培养,每个表达一个半抗体,将两个单独的过程组合为一个步骤。他们通过生产28种独特的IgG bsAbs证明了该技术的鲁棒性。但是,该大肠杆菌表达系统限于非糖基化抗体的产生。 Shatz等(69)将该技术应用于哺乳动物表达系统以产生糖基化抗体。使用上述制造系统制备的bsAb的一个显着实例是靶向TfR(转铁蛋白受体)和BACE1(β位淀粉样前体蛋白裂解酶)的TfR×BACE1 bsAb(43、44)。在人类TfR敲入小鼠中,bsAb可能穿过血脑屏障并积聚在小鼠大脑中,从而抑制BACE1减少大脑Aβ的产生(44)。该bsAb已在临床前模型中进行了验证,目前正在走向临床试验。
与人IgG1同型不同,已显示IgG4在体内和体外均经历Fab臂交换(FAE,Fab arm exchange ),其中一个半抗体(HL对)与来自其他IgG4分子的其他半抗体重组(10,70, 71)。用于FAE的IgG4的结构基础位于IgG4核心铰链区(226Cys-Pro-Ser-Cys-Pro230),尤其是Ser228残基和CH3域(关键是R409残基)(70、72)。为了赋予FAE IgG1的能力,两组通过在核心铰链区和CH3间界面引入FAE相关的IgG4特异性突变对(例如D221E / P228E / L368ECH3A–D221R / P228R / K409RCH3B)来设计具有FAE能力的IgG1。 (Rineat-Pfizer(73)的产品(称为EEE-RRR),或仅在CH3间接口上,如Genmab(72)的K409RCH3A–K405LCH3B(称为Duobody)。在Duobody技术中保留稳定的野生型IgG1铰链可能有益于bsAb的生成,该bsAb在体内在生理条件下具有抗还原性,并且在FAE介导的生产后的储存过程中更加稳定(74)。应该注意的是,与KiH,DD-KK和EW-RVT异二聚Fc技术不同,当两个HC共表达时,CH3界面上的上述两个突变对不足以主要产生异二聚Fc片段。取而代之的是,分别表达和纯化两种基于具有FAE功能的IgG1的mAb,然后在温和的氧化还原条件下将它们混合在一起,从而获得高产率(大于90%)的稳定IgG1 bsAb(72-74)。通过Duobody技术生成的EGFR×c-Met bsAb(JNJ-61186372)对小鼠的EGFR耐药性肺肿瘤有效(75)。
四、Fc-Fused Proteins with the Natural Monomeric or Heterodimeric Form 具有天然单体或异二聚体形式的Fc融合蛋白
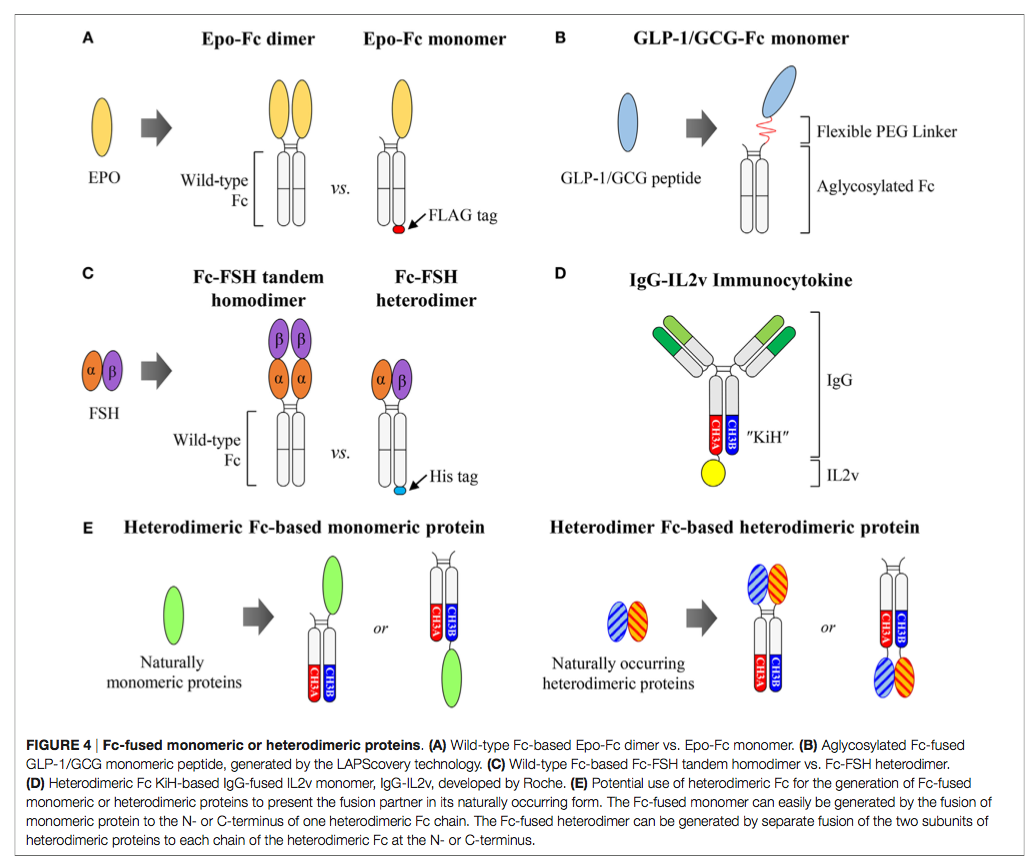
蛋白质(例如配体结合性可溶性受体,细胞因子,生长因子,酶和肽)与人IgG1 Fc结构域的遗传融合是一项成熟的策略,可以延长血清半衰期并经常通过融合伴侣的二聚化(76–78)。与Fc的缀合还可通过FcRn介导的胞吞作用增强融合伴侣的组织渗透(79、80)。此外,在许多情况下,Fc部分可改善其融合伴侣的生物物理特性,例如蛋白质的溶解性和稳定性(81)。到2015年底,临床上已经批准了约11种Fc融合蛋白(82)。所有市售的Fc融合蛋白以及许多其他在临床试验中均基于野生型人IgG1 Fc,由于同型二聚体Fc结构,其将融合伴侣呈现为同型二聚体。但是,当自然以单体或异二聚体形式存在的某些细胞因子和激素,以天然形式与Fc融合时,则显示出显着改善的药代动力学甚至生物学活性(83)。因此,对于那些蛋白质而言,在保持融合伴侣的原始构型的同时,Fc融合是理想的。但是,如下所述,基于同型二聚体结构,基于野生型Fc生成此类Fc融合的单体或异二聚体蛋白并不简单(图4A–C)。解决该局限性的一种有希望的解决方案是使用异二聚体Fc作为野生型Fc的替代支架(图4D,E)。
4.1 野生型Fc融合蛋白单体 Wild-Type Fc-Fused Protein Monomers
天然存在的单体细胞因子和激素,例如促红细胞生成素(Epo),干扰素α/β(IFNα/β)和因子IX(FIX),以天然单体形式存在的Fc融合蛋白,被称为Fc融合单体,显示出改善的药代动力学与Fc融合的二聚体相比,甚至还有生物学活性(83)。 Epo是一种〜34 kDa的糖蛋白激素药物,通过与Epo受体结合来刺激红细胞产生而发挥作用(84)。 Bitonti等(85,86)证明,以单分子形式结合到野生型Fc二聚体上的单分子Epo组成的人型IgG1 Fc融合Epo(Epo-Fc单体)(图4A)具有增强的药代动力学和药效学特性,与食蟹猴和人类的Epo-Fc二聚体相比。 Epo-Fc二聚体的劣质活性可能归因于与二聚体Fc连接的两个Epo分子引入的位阻。这可能会对与各自受体的结合产生不利影响(83)。为了制备Epo-Fc单体,首先将在C端编码FLAG标签的Epo-Fc和未标签的Epo-Fc的两个质粒共转染到CHO细胞中。细胞产生三种蛋白质产物:Epo-Fc / Epo-Fc同型二聚体(Epo-Fc二聚体),EpoFc / Epo-Fc-FLAG异二聚体(Epo-Fc单体)和Epo-Fc-FLAG / Epo -Fc-FLAG同二聚体。使用蛋白质A色谱,尺寸排阻色谱和随后的FLAG亲和色谱(85、87)的组合纯化Epo-Fc单体。
与Epo-Fc单体相似,与相应的Fc融合二聚体相比,IFN-β,IFNα和FIX的Fc融合单体形式在猴模型中表现出更好的生物学活性(83)。有趣的是,就IFNα而言,IFNα-Fc单体的药代动力学与IFNα-Fc二聚体非常相似。然而,与IFNα-Fc二聚体相比,IFNα-Fc单体的体内功效要好得多(83)。 IFNα-Fc单体的这种增强的功效还取决于IFNα和Fc区之间的接头的长度。较长的接头长度导致IFNα-Fc单体的比活性增加,表明IFNα及其受体之间可能存在某些位阻。然后如先前针对Epo-Fc单体所述制备Fc融合单体。因此,理论上可以制备所需的Fc融合单体,其至多仅占总表达产量的33%。尽管Fc融合单体具有许多理想的特性,但野生型基于Fc的单体的开发仍面临着使用稳健的纯化步骤从其他形式的混合物中分离所需Fc融合单体的困难, 而且还受到固有的最高33%的不良产量的限制。
对于Fc融合的单体肽, Hanmi Pharm(88)的Kang等研究开发了一种胰高血糖素样肽1(GLP-1)/胰高血糖素(GCG)双重激动剂,可通过激活基于LAPScovery™的GLP-1和GCG受体来治疗肥胖症和糖尿病(Long-代理蛋白质/肽发现)技术。他们将GLP-1 / GCG肽化学缀合到人IgG1无糖基化Fc片段的仅一个臂上,该片段是通过柔性聚乙二醇(PEG)接头从大肠杆菌产生的(图4B)。与GLP-1 / GCG-Fc二聚体相比,GLP-1 / GCG-Fc单体具有显着改善的药代动力学和更高的体内生物学活性(89)。但是,GLP-1 / GCG-Fc单体的制备很复杂,需要单独的Fc制备,GLP-1 / GCG肽通过PEG接头与Fc的体外化学偶联,最后是多步纯化从反应混合物(89)得到所需产物。基于LAPScovery技术,开发了用于胰岛素,人类生长激素和粒细胞集落刺激因子的无糖基化Fc融合单体,目前正在欧洲进行临床试验。
4.2 野生型Fc融合蛋白异二聚体 Wild-Type Fc-Fused Protein Heterodimers
对于由两个不同亚基组成的异二聚体蛋白质,与通过串联亚基与野生型Fc连接的同二聚体形式相比,通过每个亚基独立地融合成独立的Fc片段而实现的Fc融合形式可能是维持生物学活性所希望的。促卵泡激素(FSH)是由α和β亚基组成的非共价连接的异二聚体蛋白,其重组蛋白通常用于治疗男性和女性不育症(90)。但是,由于其半衰期短(在人类中为35小时),它需要每天注射几天,长达数月之久(90)。为了制备长效FSH,Low等人 (91)设计了两种不同形式的人IgG1 Fc融合FSH。一种是单链连接的FSH-Fc(Fc-FSH串联同源二聚体),具有串联连接的α-β亚基,与Fc片段的N端融合。另一个是异二聚FSH-Fc(Fc-FSH异二聚体),其α和β亚基分别与Fc片段各臂的N-末端融合(图4C)。他们发现Fc-FSH异二聚体比Fc-FSH串联同二聚体具有更高的活性,而两种Fc融合蛋白在啮齿动物和猴子中具有相似的终末血清半衰期。 Fc-FSH异源二聚体的结构可能以比Fc-FSH串联同二聚体更有利的构象呈现α和β亚基。为了纯化Fc-FSH异二聚体,他们仅将6×His-tag插入融合了β亚基的Fc片段的C末端。结果,尽管在单个蛋白A色谱步骤后Fc-FSH串联同源二聚体的纯度约为90%,但Fc-FSH异源二聚体需要通过nickel亲和色谱法进行额外纯化才能获得相似的纯度。但是,除了多步纯化外,与总表达产率相比,此类Fc-FSH异二聚体制剂的纯化产率更低(33%)。
4.3 抗体融合的细胞因子,免疫细胞因子 Antibody-Fused Cytokines, Immunocytokines
细胞因子是控制生理和病理生理过程中免疫反应的关键因素(92)。临床上已经批准了多种细胞因子用于多种免疫相关疾病,包括白介素2(IL2)和肿瘤坏死因子(TNF)以及用于恶性癌症治疗的INFα(92,93)。然而,细胞因子的治疗功效通常由于其全身给药相关的不良药代动力学和显着毒性而受到阻碍。为了克服这种局限性,已设计出抗体-细胞因子融合蛋白,即所谓的免疫细胞因子,以增强抗体介导的肿瘤组织对细胞因子的靶向作用,并增加血清半衰期(93、94)。然而,最近在小鼠中进行的一项研究显示,小鼠使用IL2免疫细胞因子与IgG-IL2形式的肿瘤抗原特异性IgG融合,其生物分布和药代动力学完全由细胞因子IL2部分控制,而不是预期的靶向抗体的抗原特异性(95)。不论抗原特异性或FcγR相互作用如何,IgG-IL2主要保持全身性并与表达IL2受体的先天免疫细胞相关,而亲本IgG抗体则优先积累在靶向抗原的肿瘤中(95)。而非IgG-IL2免疫细胞因子,已寻求抗肿瘤抗原IgG抗体和未靶向的Fc-IL2单体的组合进行协同抗肿瘤免疫治疗(96)。
此外,抗体与细胞因子的比例极大地影响了免疫细胞因子的生物分布。 IL12是一种异质二聚体(〜70 kDa),由重链(p40)和轻链(p35)亚基组成,它们通过二硫键共价连接(97)。为了开发基于IL12的免疫细胞因子并结合靶向纤连蛋白EDB结构域的L19 scFv,Gafner等人。 (98)构建了三种不同形式的免疫细胞因子,其抗体与细胞因子的比例不同。他们发现,p40-L19 scFv / L19 scFv-p35的抗体与细胞因子之比为2:1,这是一种异二聚体融合蛋白,其中IL12的二硫键连接的p35和p40亚基与L19 scFv融合,显示出最高的肿瘤生物分布研究中的靶向性能。因此,当与抗体与细胞因子之比为1:1或2:2的其他两种形式相比时,观察到增强的治疗活性。用不同的F8 scFv抗体产生的IL12免疫细胞因子也获得了相似的结果(99)。使用IL7(〜20 kDa)的单体细胞因子,同一小组评估了三种不同形式的IL7融合的F8 scFv免疫细胞因子的生物分布,其抗体与细胞因子的比例不同(100)。他们发现,与IL12一样,抗体与细胞因子比率为2:1的形式与其他两种比率为1:1和2:2的形式相比,具有最高的肿瘤定位。
4.4 异二聚体Fc融合免疫细胞因子
以上结果表明,通过降低细胞因子介导的靶向作用,提高抗体与细胞因子的比例可以改善肿瘤组织的定位,从而有可能降低剂量相关的毒性。基于IgG的免疫细胞因子通常是通过将细胞因子与HCs的同型二聚Fc片段的C末端融合而产生的,后者以同型二聚体的形式呈现细胞因子(31)。但是,这种基于IgG的免疫细胞因子可能表现出较差的药代动力学和分布,如IgG-IL2格式所示(95、101)。为了生成单体(例如,IL2,IL4,IL7,IL9,IL15和IL21)和异二聚体细胞因子(例如,IL12,IL23,IL27和IL35)的基于IgG的细胞因子单体形式,异二聚体Fc是有吸引力的支架呈现具有天然结构的细胞因子。罗氏(102,103)通过将工程化的IL2变体(IL2v)与抗体的Ki端与KiH异二聚体Fc融合获得2:1的CEA靶向IgG融合的IL2单体免疫细胞因子(CEA-IL2v)。抗原结合价与细胞因子之比(图4D)。同样,他们还开发了成纤维细胞活化蛋白(FAP)定向的IgG-IL2v单体免疫细胞因子(FAP-IL2v)(103,104)。现在正在1期临床试验中评估CEA-IL2v(NCT02004106,NCT02350673)和FAP-IL2v(NCT02627274)。
五、结论与展望 Conclusion and Prospects
总之,免疫球蛋白Fc异二聚体技术在生成具有各种抗原特异性和全长IgG和IgG样形式的结合价的bsAb时非常有用,同时保留了天然IgG抗体的许多有利特性。截至2016年7月,目前正在临床试验中评估7种以上基于异源二聚Fc的IgG格式bsAb(表2)。尽管如此,对于基于异二聚体Fc的bsAb,仍有一些问题需要考虑。所有基于异源二聚体Fc的bsAb都需要装配三个或四个独立的链,这通常会阻碍细胞系发育以实现高产量表达。由于每个异二聚体Fc链在每个CH3域中都有不同的突变,因此表达水平和稳定性彼此之间有些不同,通常需要优化流程以鉴定异二聚体Fc链与融合伴侣之间的最佳配对(35)。此外,由于到目前为止开发的Fc异二聚体尚未达到100%的异二聚化产率,因此应从基于异源二聚Fc的bsAb设计的初始阶段考虑确保高bsAb纯度以满足临床需求的下游工艺。
除了bsAbs以外,异二聚体Fc技术现在正在作为有前途的支架出现,用于产生单体或异二聚体形式的Fc融合蛋白和细胞因子。不再需要具有野生型Fc片段的Fc融合单体蛋白的产生,因为它需要其他人工序列,例如用于选择性亲和色谱的额外标签,以及需要有限纯化率(最大33%)的多个纯化步骤。与异二聚体Fc片段的融合可以融合蛋白的天然形式出现于单体蛋白和肽,以及异源二聚体蛋白的天然异源二聚体形式,而不是野生型Fc片段的人工同二聚体形式(图4E)。这种异源二聚体Fc功能将促进下一代Fc融合蛋白的开发,该蛋白可保持融合伴侣的全部功能,同时保留Fc介导的延长的半衰期和免疫效应子功能。降低的结合价可能进一步帮助减少靶受体介导的清除。特别地,在靶向肿瘤的基于IgG的免疫细胞因子中,其天然形式的异二聚体Fc融合细胞因子通过减少与免疫细胞的结合来改善肿瘤组织的积累,从而使全身毒性最小化。这促进了它们作为治疗剂的发展。一些基于异二聚体Fc的IgG融合免疫细胞因子目前正在临床试验中,并且有望开发出更多的抗体。
参考资料
- Ha, J. H., Kim, J. E., & Kim, Y. S. (2016). Immunoglobulin Fc heterodimer platform technology: From design to applications in therapeutic antibodies and proteins. Frontiers in Immunology, 7(OCT), 1–16. https://www.frontiersin.org/articles/10.3389/fimmu.2016.00394/full
