【8.2】五种用于治疗性抗体分析的计算可开发性指南
治疗性mAb不仅必须与其靶标结合,还必须没有“可开发性问题(developability issues)”,例如稳定性差或聚集程度高。虽然小分子药物的发现得益于Lipinski的五法则指导选择具有适当生物物理特性的分子,但目前还没有用于抗体设计的计算机模拟。在这里,我们模拟大量后期I期临床阶段抗体治疗(post-phase-I clinical-stage antibody therapeutics,CST)的可变域结构,并计算计算机指标以估计其典型特性。在每种情况下,我们将CST分布与人抗体基因库的快照相关联。我们描述了被认为与可开发性差有关的五个指标的准则值:互补决定区(CDR)的总长度,表面疏水性的程度和大小,CDR中的正电荷和负电荷,以及重链 和轻链表面电荷的不一致性。每个属性的指南阈值来自CST中的值,并且建议使用标记系统来识别不合格的候选者。在两个mAb药物发现集中,我们能够选择性地突出显示具有可开发性问题的序列。我们提供了Therapeutic Antibody Profiler(TAP),这是一种计算工具,可构建可变域序列的可下载同源模型,根据我们的五个可开发性指南测试它们,并报告潜在的序列责任和规范形式。 OPAP可在 http://opig.stats.ox.ac.uk/webapps/sabdab-sabpred/TAP.php
免费获取。
一、前言
单克隆抗体(mAb)越来越多地用作靶向多种膜结合或可溶性抗原的治疗剂; 自1986年以来,欧洲药品管理局或食品药品管理局批准的73种抗体疗法(自2018年6月12日),其中10种于2017年首次获得批准。 除了实现对抗原的所需亲和力之外,治疗性mAb发展存在许多障碍。 这些包括内在免疫原性,化学和构象不稳定性,自缔合,高粘度,多特异性和差表达。 现在,在工业管道中对这些负面特征进行体外筛查是常规的
虽然一些可开发性差的案例来源微妙,但其他案例则不那么模糊。 高水平的疏水性,特别是在高度可变的互补决定区(CDR)中,已经反复涉及聚集,粘度和多特异性。 重链和轻链可变结构域的净电荷中的不对称性也与高浓度下的自缔合和粘度相关。 CDR中的阳性和阴性电荷的patches与高清除率和差的表达水平相关。 产物异质性(例如,通过氧化,异构化或糖基化)通常由易于翻译后或共翻译修饰的特定序列基序产生。
对控制这些生物物理特性的因素的更好理解使得能够开发计算机测定,其比实验等同物更快且更便宜。计算工具已经有助于鉴定序列倾向性,例如赖氨酸糖基化,天冬氨酸异构化,天冬酰胺脱酰胺和半胱氨酸或N-连接糖基化位点的存在。近年来,主要关注的是设计能够更好地预测聚合倾向的软件。为此目的设计的许多算法仅使用抗体序列,尽管有些建议在结构可用时使用类似的方程。一种纯粹基于结构的方法是结构聚合倾向(tructural Aggregation Propensity,SAP)度量,后来包含在可开发性指数中。已经显示这已经检测到聚集倾向区域,例如surface patches ,并且能够使用紧密相关的抗体晶体结构相对于已知抗体可显影性谱对候选物进行排序。考虑到结构预测的当前准确性,SAP的原子分辨率分析可能过于敏感而不能用于比较不同抗体的静态同源模型。
预测可能具有较差可发展性特征的抗体的另一种方法,是突出那些特征与临床测试的治疗性mAb差别很大的候选者; 药代动力学领域的类似策略导致了Lipinski对小分子药物设计的规则。 在这里,我们建立了大量的I期后疗法的3D模型,并调查它们的序列和结构特性。 然后将这些值与人免疫球蛋白基因测序(Ig-seq)序列和模型进行背景化,以观察治疗剂在何处共享和偏离人mAb的特性。
使用这些属性的分布,我们构建了治疗抗体分析谱(Therapeutic Antibody Profiler,TAP),这是一种计算工具,突出了与治疗相比具有异常值的抗体。 TAP构建抗体可变结构域序列的可下载结构模型,并根据可能与可开发性差相关的五个计算测量的指导阈值进行测试。 它还报告了潜在的序列倾向和所有非CDRH3环规范形式。
二、结果
2.1 序列数据
作为不太可能患有可开发性问题的mAb数据集,我们使用了137种临床阶段抗体治疗剂(137 CST)的可变结构域重链和轻链序列。为了对CST集的性质进行语境化(contextualize),我们从Observed Antibody Space database(人VdH Ig-seq)中检索了Vander Heiden最近对人抗体库的快照。我们还使用了由UCB Pharma Ltd.(人类UCB Ig-seq)的更大的专有数据集。本文中的所有比较都是针对Vander Heiden数据进行的,在SI附录中提供了UCB比较。将每个人Ig-seq数据集分析为一组非冗余的重链或轻链(人Ig-seq非冗余链)和一组非冗余CDR序列(人Ig-seq非冗余CDR)。我们选择这些Ig-seq数据集,因为它们包含同时测序的重链和轻链,因此是实现计算机配对的有希望的起点,需要制作完整的结构模型。
2.2 模型结构
高质量的结构信息对于准确预测抗体的表面特性至关重要。由于晶体结构通常不可用或难以获得,精确建模是有效抗体分析的必要步骤。因此,我们所有的比较都是在模型之间进行的,即使在晶体结构可用的情况下,也可以避免结构质量方面的偏差[建模引入了对我们的表面疏水性(patches of surface hydropho- bicity ,PSH)度量标准的更高值的系统偏差;见SI附录,图S9和S10]。 ABody-Builder在56个CST上运行,具有参考蛋白质数据库(PDB)结构(截至2018年5月4日)。不包括序列相同的模板,并且将每个得到的模型与其参考对齐以评估跨所有IMGT(国际ImMunoGeneTics信息系统)区域的骨架rmsd(SI附录,方法)。平均框架和CDR rmsds(SI附录,表S1)与现有技术水平相当。对于我们的结构性质计算,我们将表面暴露的残基分类为具有相对可及表面积(ASArel,X)≥7.5%的侧链,与每个残基X的丙氨酸-X-丙氨酸相比。使用此定义,我们确定了模型和PDB结构中的所有暴露残基。在7,057个暴露的晶体结构残基中,仅有265个(3.76%)错误地被指定为埋藏在模型中。
由于这些结果表明ABodyBuilder模型足够准确用于我们的分析,我们使用该软件模拟所有137个CST(137个CST模型)和配对的人VdH Ig-seq链的不同子集(14,072个人VdH Ig-seq模型)并配对 人UCB Ig-seq链(19,019人UCB Ig-seq模型)。 配对和建模协议旨在捕获每个数据集中的序列和结构多样性,在可建模性和计算费用的约束下(SI附录,方法)。 然后,我们进行了一系列计算机模拟分析,以确定TAP指标。
2.3 IMGT CDR长度
环长度对抗原结合的性质具有重要影响。 例如,如果抗体具有长的CDRH3环,则其倾向于形成与抗原的大部分相互作用,而较短的CDRH3环有助于凹形结合位点,其中其他CDR更经常有助于结合。
137个CST和人Ig-seq序列是IMGT编号的,并且IMGT CDR定义用于按区域分裂序列。 137个CST CDRH3环的中位长度为12,而人VdH Ig-seq数据集的中位长度为15(图1)。 在CDRL3的情况下,分布更接近,137个CST和人VdH Ig-seq数据的中值长度为9(SI附录,图S1E)。
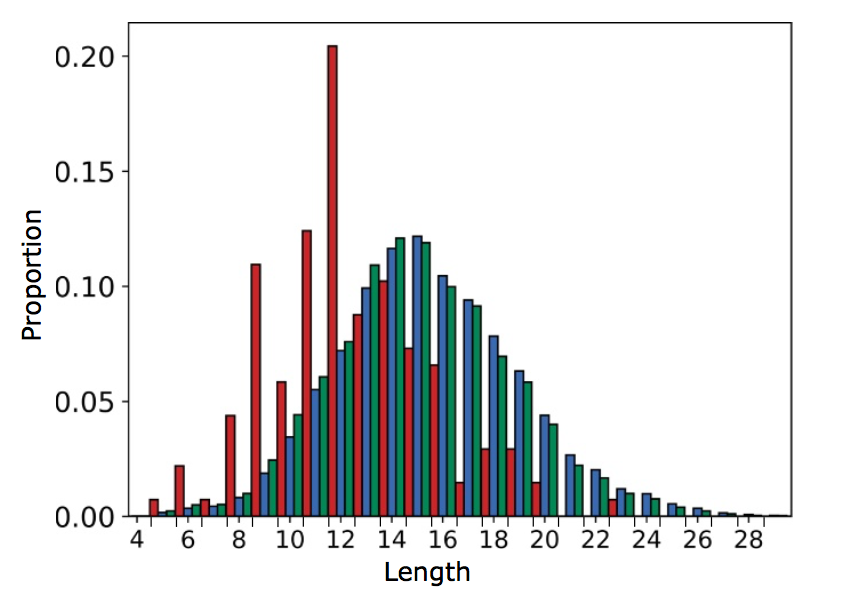
图1 比较137 CST(红色),105,458个人VdH Ig-seq非冗余CDRH3(蓝色)和551,193个人VdH Ig-seq非冗余重链(绿色)的CDRH3长度分布。 CST具有较低的CDRH3中位长度。
为了测试杂交体发育是否可能解释这些发现 - 因为已知小鼠抗体倾向于具有比人抗体更短的CDRH3环 - 我们通过发育起源分裂137 CST数据集(SI附录,图S3)。与嵌合,人源化或完全鼠治疗相比,完全人类治疗不成比例地代表更长的CDRH3(平均值:13.21,中位数:12)(平均值:11.91,中值:12)。然而,两种治疗子集仍然具有比人表达的抗体更短的CDRH3。
137 CST数据集中每种抗体的所有CDR的组合长度具有中值48(SI附录,图S4)。 137 CST总CDR长度与CDRH3长度高度相关(Pearson相关系数为+0.77, two- tailed P值为2.44e-28)。虽然人类Ig-seq数据集都不是原生配对,但我们的人工配对人Ig-seq模型的总CDR长度分布与CST类似(SI附录,图S4),因此CDR长度不应偏向其他指标的比较。由于CDR的总长度捕获结合位点形状(较低值和较凹)和CDRH3长度(通常在CST中比我们的人Ig-seq重链短),选择该指标以包括在最终的五个TAP指南中。
2.4 规范形式 (
Canonical Forms)
在天然抗体中,除了CDRH3之外的所有CDR环被认为属于称为经典形式的结构类。 我们将长度无关的规范形式分配给137 CST和人Ig-seq模型。 所有可分配的CST模型CDR用也存在于至少一个人Ig-seq模型数据集中的规范形式标记(SI附录,图S5和S6)。 少于19%的CST CDR在每个环区域中保持未分配,表明尽管是工程化的,但绝大多数非CDRH3治疗性CDR环采用了良好表征的规范形式。 TAP报告每个建模循环的规范形式,突出显示是否有任何无法分配。
2.5 疏水性
CDR区中的疏水性已经与mAb中的聚集倾向重复相关。 使用我们的同源模型,我们通过不仅考虑其极性程度而且考虑它是否是溶剂暴露的[侧链ASArel≥7.5%]来估计每个残基的有效疏水性。 由于疏水效应的能量与界面面积大致成比例,我们开发了一个度量标准PSH,如果疏水性残基倾向于在一个区域中彼此相邻而不是均匀分离,则会产生更高的分数。 我们评估了两个区域[CDR附近和整个变量(Fv)区域]的137 CST和人Ig-seq模型的PSH以及五种不同的疏水性标度。
所有疏水性标度的结果高度相关(例如,在CDR附近的所有标度之间R2≥0.91),因此我们使用Kyte和Doolittle标度进行所有后续比较。 CST和人VdH Ig-seq分布的平均CDR附近PSH值分别为123.30±16.60和133.76±21.08(图2A)。在较高的CDR PSH值下,CST明显不足; galiximab是具有高价值的治疗性抗体的罕见例子(图2B)。在整个Fv区域发生类似的差异,平均值分别为357.69±22.95和370.56±24.45(SI附录,图S7),暗示主要差异发生在CDR内。这支持了这样的理论:储存治疗剂的高浓度条件可能使它们对高度暴露的CDR附近的大片疏水性的耐受性降低,并且还表明天然人抗体的子集将是不适合的治疗候选物。因此,我们将CDR附近的PSH评分作为TAP指标。

图2 (A)137 CST(蓝色)和人VdH Ig-seq(红色)模型的CDR附近PSH评分。 在较高的PSH值下,CST的代表性不足。 (B)Galiximab(Kyte和Doolittle CDR附近PSH评分为167.89)在其CDRH3环中具有大的表面暴露的疏水性贴片。 CDR附近外部的重链和轻链表面以白色着色。
2.6 电荷
正电荷或负电荷的表面斑块也与负面生物物理特征有关。 我们计算了两个旨在突出密集电荷区域的指标:正电荷贴片( patches of positive charge ,PPC)和负电荷贴片(patches of negative charge,PNC)测量。 最初为所有表面残基指定其平均pKa值的适当电荷,因为相邻残基似乎在pH 7.4下具有有限的作用。 然后将发现参与盐桥的残基的电荷修正为零。
137 CST模型倾向于避免其CDR附近的电荷碎片,其中88.32%和80.30%分别具有低于1的PPC(图3A)和PNC(图3B)值。 人类VdH Ig-seq模型显示出类似的PPC和PNC分布。 PPC和PNC测定均作为TAP指标进行。
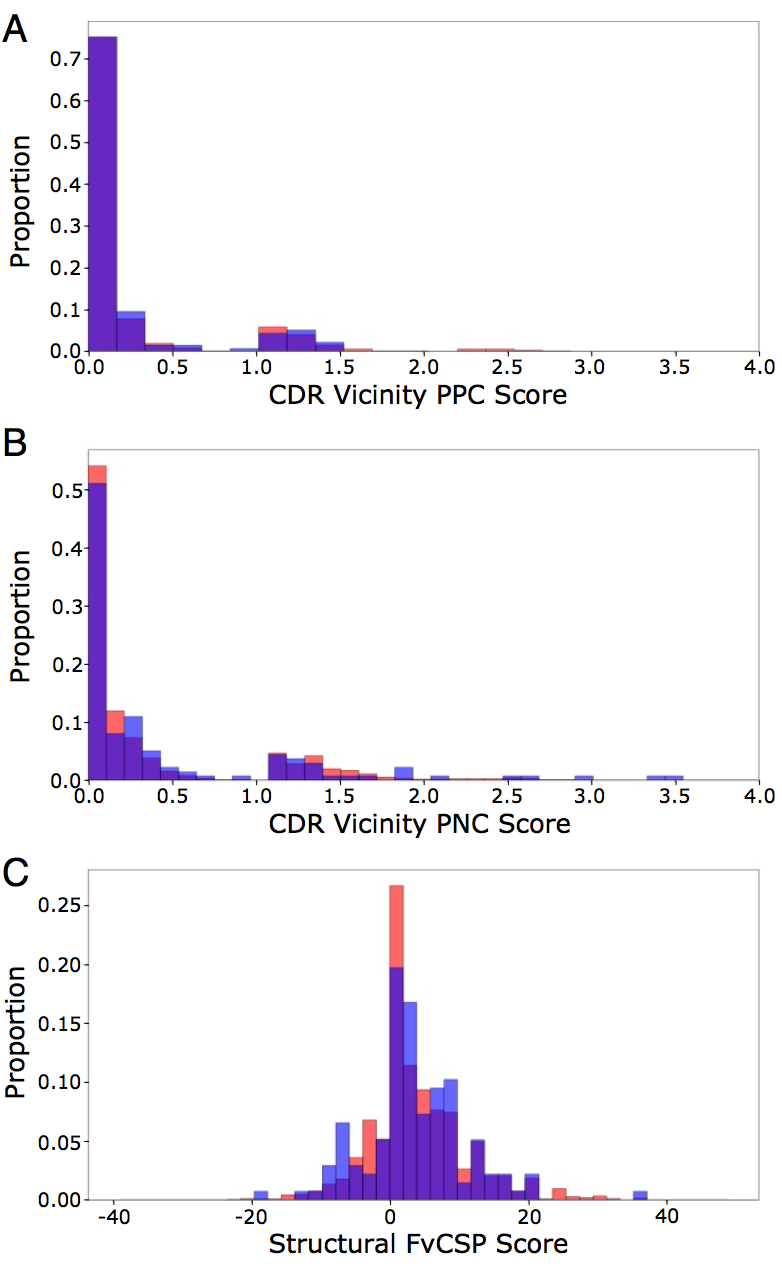
图3 137 CST(蓝色)和人VdH Ig-seq模型(红色)的直方图评估(A)PPC和(B)CDR附近的PNC指标。 在这两个度量中,数据集偏离较高分数。 (C)结构Fv电荷对称参数值的直方图。 两个数据集都显示偏离负值的偏差。
当mAb具有带相反电荷的VH和VL链时,它们通常具有更高的体外粘度(viscosity)值。通过Fv电荷对称参数( Fv charge symmetry parameter,FvCSP)度量在序列水平捕获这种聚集诱导的静电吸引力 - 如果净VH和VL电荷的乘积是负的,则mAb倾向于更粘稠。利用我们的结构模型,我们计算了一个变体(结构Fv电荷对称参数,SFvCSP),其中仅包括表面暴露的残基,并且在净电荷的评估中没有锁定在盐桥中。例如,在galiximab中,我们将精氨酸H108和天冬氨酸L56的电荷“校正”为0,因为模型表明它们形成盐桥(salt bridge)。 H6位的谷氨酸,位置H107,L98和L108的天冬氨酸以及L40位的组氨酸的电荷被忽略,因为它们的侧链被掩埋。该抗体的FvCSP评分为0(净重链电荷为0,净轻链电荷为2.9),而SFvCSP评分为+2.0(净重链电荷为+2,净轻链电荷为+1) )。同样低百分比的CST模型(21.9%)和人类VdH Ig-seq模型(20.8%)具有负的SFvCSP评分(图3C),平均值分别为3.34±7.44和3.67±7.40。由于偏离了负面产品,我们选择SFvCSP作为我们的最终TAP属性。
2.7 建模的重要性
然后我们采用SAbDab以找到PDB中所有人类,非工程化,非冗余(100%序列同一性)的X射线晶体结构。 我们发现只有33种这样的单克隆抗体(数据集S1中列出的身份),因为大多数人类单克隆抗体PDB条目涉及一定程度的工程。 计算它们的TAP度量值,我们发现治疗和人类晶体结构之间的平均CDR附近PSH评分的差异与治疗和人VdH Ig-seq模型之间的差异大致相同(分别为9.69和10.46;参见SI附录,表S2)。 然而,如果我们将人体结构与治疗模型进行比较,我们就不会发现显着差异(治疗模型:123.30±16.60;人体结构:124.61±16.54)。 当将CST晶体结构的值与CST模型(SI附录,图S9)进行比较时,可以最清楚地看到模型中更高PSH值的系统偏差。
2.8 可开发性指南
当比较针对56个CST结构及其相应模型获得的TAP度量值时,我们看到所有度量的正相关性(SI附录,图S10)。 这表明在ABodyBuilder模型上执行的计算通常预测将从晶体结构获得的结果,因此从模型得到的阈值是提供信息的。
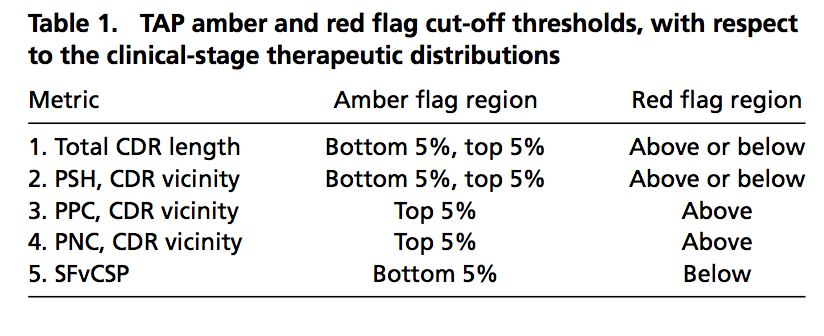
虽然CST可预测地与人抗体共有许多共同特征,但我们的CDR长度和疏水性分布意味着并非每种人类抗体都能产生良好的治疗效果。 因此,我们的可开发性指南仅由五个选定指标的CST值设定(表1)。 琥珀色标志表示抗体位于分布的极值范围内,而红色标志表示该属性的先前未观察到的值。
为了确认这些阈值定义通常不标记没有可开发性问题的mAb,我们确定了另外105 mAb治疗(105个CST,在数据集S2中列出),未包括在137 CST数据集中,已在临床中至少发展到II期发展。
根据137个CST设定的边界,该组中仅有8个(7.69%)被分配了红色可开发性标志,每个新测试的治疗剂平均为0.08 red flags(SI附录,表S3)。 Erenumab获得最多的red flags - 总CDR长度(60),CDR附近PSH(173.85)和CDR附近PPC(1.53)。所有其他red flags治疗药只接受一种:rafivirumab治疗总CDR长度(60); intetumumab用于CDR PSH(83.84); adacanumab,derlotuximab,lanadelumab和teprotumumab用于CDR PPC(分别为2.67,2.66,2.48和3.16);和quilizumab的Fv电荷不对称性(20.40)。低红度标记率证实这些指导特征在治疗样抗体中高度保守。将两组CST合并到一个更大的数据集(242个CST)中,导致表2中显示了新的准则值。虽然大多数指标仅略微调整,但PPC阈值发生了相当大的变化。因此,我们对TAP度量分布进行了统计抽样,以便了解这些新阈值中可能存在的错误(SI附录,方法和表S4)。数据集S3中列出了所有242个CST TAP度量标准值。

2.9 实例探究
我们通过构建模型并在MedImmune提供的两个数据集上,运行TAP来测试这些更新的指南值是否可以突出显示具有可开发性问题的候选者(图4)。 抗体NGF抗体MEDI-578在体外测试期间显示出微小的聚集问题,其可开发水平通常是可纠正的,而亲和力成熟的版本MEDI-1912表现出不可测量的高水平聚集。 通过SAP评分值使该观察结果合理化,表明表面上的大疏水斑块是造成的。 TAP在CDR附近PSH度量中为MEDI-578指定一个琥珀色标志,MEDI-1912为一个红色标记(图4A)。 本文描述了MEDI-1912中三个疏水残基的回复突变与MEDI-578的回归是如何导致MEDI-1912STT,在维持效力的同时解决聚集问题。 TAP指定MEDI-1912STT没有可开发性标志(图4A)。
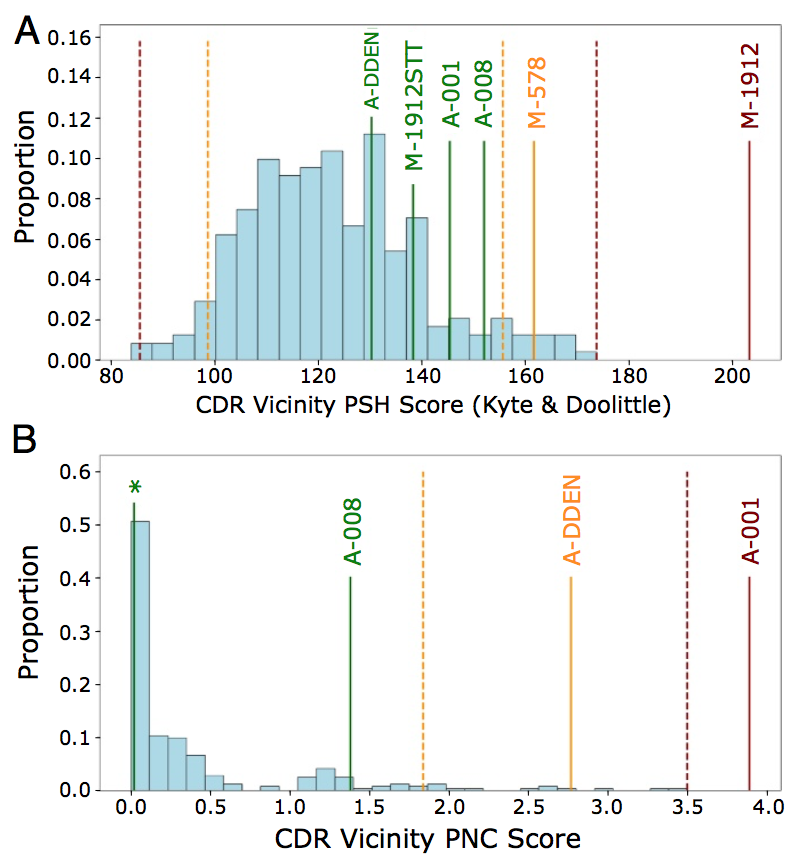
图4.(A)CDR附近PSH和(B)CDR附近PNC指标,用于组合的242个CST(浅蓝色)和MedImmune案例研究(由指定标志着色)。 MEDI-578,MEDI-1912和MEDI-1912STT都具有由星号标记的CDR附近PNC值。 琥珀色和红色虚线描绘了242 CST准则阈值。 具有过高可开发性问题的案例研究(MEDI-1912,AB001)分别针对PSH和PNC指标进行了红色标记。 没有可开发性问题的工程版本(MEDI-1912STT,AB001DDEN)返回到先前在CST中针对所有度量标准看到的值的范围。 MEDI-578/1912 / 1912STT标记为M-578/1912 / 1912STT,AB-001/008 / 001DDEN标记为A-001/008 / DDEN以便易读。
抗-IL13候选药物AB008没有可开发性问题,但亲和力成熟的AB001表达水平非常差(比AB008低7倍)。 作者强调了连续4个带负电荷的残基在第4个带负电荷的残基中性突变中性天冬酰胺(AB001DDEN)的作用能够稳定环骨架,减轻DDE基序的离子排斥,并恢复可接受的表达水平。 TAP没有向AB008分配可开发性标志,但是AB001的红色标志和AB001DDEN的琥珀色标志为其CDR附近的PNC度量标准(图4B),再次对候选物进行了红色标记,开发性问题令人望而却步。 AB001和AB008,溶液中确认的单体均未标记CDR附近的PSH评分(图4A)。
2.10 Web应用程序
我们已将TAP打包到一个Web应用程序中,可在 opig.stats.ox.ac.uk/webapps/sabdab-sabpred/TAP.php 中找到。 TAP仅需要重链和轻链可变结构域序列作为输入,返回抗体的详细信息,其典型运行时间小于30秒。 标志(绿色,琥珀色或红色)分配给每个TAP指标,并附有直方图。 交互式分子观察器允许用户在抗体模型表面上可视化疏水性(SI附录,图S11A),电荷和可能的序列倾向。 可以轻松访问估计的模型质量,以帮助指导结果的解释(SI附录,图S11B)。 最后,将规范形式分配给每个非CDRH3环。 完整的样本输出显示在SI附录中,图S12。
三、讨论
我们已经分析了242个I期后疗法与差的可发性性相关的几个特性,假设已经达到临床试验阶段的mAb具有适合治疗发展的特征。
通过分析这些特性,我们发现有证据表明并非每种人类抗体都能产生良好的治疗效果。 这在某种程度上是直观的,因为治疗剂在人类表达的抗体未暴露的开发期间,会遭受一系列压力,包括pH和温度的变化,剪切力和高浓度储存条件。 因此,TAP指标取决于仅在CST上看到的值。
我们简单的TAP指南不会捕获整个可开发性问题的范围。 例如,他们不会检测到导致稳定性差的免疫原性来源或更微妙的机制。 尽管如此,我们已经证明TAP指南可以选择性地突出具有表达或聚集问题的抗体。
我们打算定期重新计算阈值,以包括已进入临床试验II期的新单克隆抗体。 它还将允许CST返回的PSH,PPC,PNC和SFvCSP值的不可避免的波动,因为随着PDB中抗体数量的增加,ABodyBuilder模型也会改善。
当有足够的CST可用时,可以将治疗指南分层为子类。 例如,对于涉及κ或λ轻链的mAb,可以考虑单独的阈值。 λ轻链倾向于在我们的242 CST,14,072人VdH Ig-seq和19,019人UCB Ig-seq模型中产生更高的平均CDR附近PSH值(SI附录,表S5); DeKosky等还发现,在其2,000个原生配对的mAb模型中,λ CDRL3环比它们的κ等价物显着更疏水。 由于我们目前只有25个λ轻链CST,我们没有足够的数据来安全地确定准则阈值。 然而,由于大约90%的I期后CST来自κ轻链,这可能表明当使用含有λ轻链的引线时,疏水性驱动的可开发性问题更为普遍。
其他亚类可包括临床试验进展,活性/停止试验状态或治疗性物种来源。 在此阶段,临床进展(SI附录,表S6)和药物活动状态(SI附录,表S7)之间的分裂都不会导致平均度量值的显着差异。 人和人源化mAb具有明显高于嵌合或小鼠mAb的平均PSH值(SI附录,表S8) - 需要注意的是后一类中仅有36个mAb。
与Lipinski的五条规则一样,阈值本身不应被解释为硬性规则,应考虑超出先前观察到的界限的red-flagged选者的距离。 过程开发和制定方面的进展可能很快重新定义允许值的限制。
四、方法
在数据集S2中提供所有242个CST序列,并且可以从Observed Antibody Space数据库获得551,193个重链和1,359,745个轻链非冗余的“健康”人VdH Ig-seq序列。 4,587,907个重链和7,120,000个轻链非冗余人UCB Ig-seq序列,可在 antibodiesmap.org/structure 中作为分离的CDR和框架区获得。 治疗模型和人类VdH Ig-seq模型可以从 opig.stats.ox.ac.uk/resources 下载。 用于推导人Ig-seq模型数据集的配对/建模协议可以在SI附录,方法中找到。
4.1 CSTs
最初的137个CST抗体序列来源于Jain等人的支持信息。。 通过对在线资源的广泛搜索,包括IMGT mAb(www.imgt.org/mAb-DB/)和抗体协会( https://www.antibodysociety.org/late-stage-clinical-pipeline/ ),找到了105个CST序列的测试集。 。 每个CST的名称,序列和元数据都在数据集S2中提供,PDB结构(如果可用)在 opig.stats.ox. ac.uk/webapps/sabdab-sabpred/Therapeutic.html 。
4.2 规范形式 Canonical Forms
从2017年9月26日开始,在SAbDab North-defined的CDR环上运行与长度无关的规范形式聚类协议。模型循环被推断为与ABodyBuilder使用的模板具有相同的规范形式。
4.3 表面暴露的残留物
定义为“表面暴露”的残基与侧链原子相比具有≥7.5%的相对暴露,与开链形式的丙氨酸-R-丙氨酸相比,用Shrake和Rupley算法计算。
4.4 CDR邻近 ( CDR Vicinity )
“CDR附近”包括每个表面暴露的IMGT定义的CDR和锚定残基,以及在4Å半径内具有重原子的所有其他表面暴露的残基。
4.5 盐桥 Salt Bridges
盐桥被定义为成对的赖氨酸/精氨酸和天冬氨酸/谷氨酸,其中N+- O-距离≤3.2Å。
4.6 疏水性
其中R1和R2是两个表面暴露的残基最近的重原子距离r12<7.5Å
H(R,S) is the normalized hydrophobicity score (between 1 and 2) for residue R in scheme S
$$ PSH = \sum_{R_{1}R_{2}}\frac{ H(R_{1},S)H(R_{2},S) }{r_{12}^{2}}$$
疏水性标度测试的是Kyte和Doolittle),Wimley和White,Hessa,Eisenberg和McLachlan,以及Black and Mold(35)。 在每个疏水性等级中,盐桥残基被指定为与甘氨酸相同的值。
4.6 电荷
按顺序分配下列电荷:天冬氨酸 -1; 谷氨酸,1-; 赖氨酸,+ 1; 精氨酸,+ 1; 和组氨酸,+ 0.1( Henderson-Hasselbalch方程应用:pKa 6,pH 7.4,并向上舍入到小数点后一位)。 未考虑酪氨酸羟基去质子化。 盐桥残留物被指定为0的电荷.PPC和PNC指标是类似于PSH,其中H(R,S)代入| Q(R)|,分配给残基R的电荷的绝对值。SFvCSP值计算为
$[ \sum_{R_{H}}Q(R_{H})][\sum_{R_{l}}Q(R_{L})]$,其中RH和RL分别是表面暴露的VH和VL残基。
参考资料
- PNAS | March 5, 2019. www.pnas.org/cgi/doi/10.1073/pnas.1810576116。 Five computational developability guidelines for therapeutic antibody profiling
