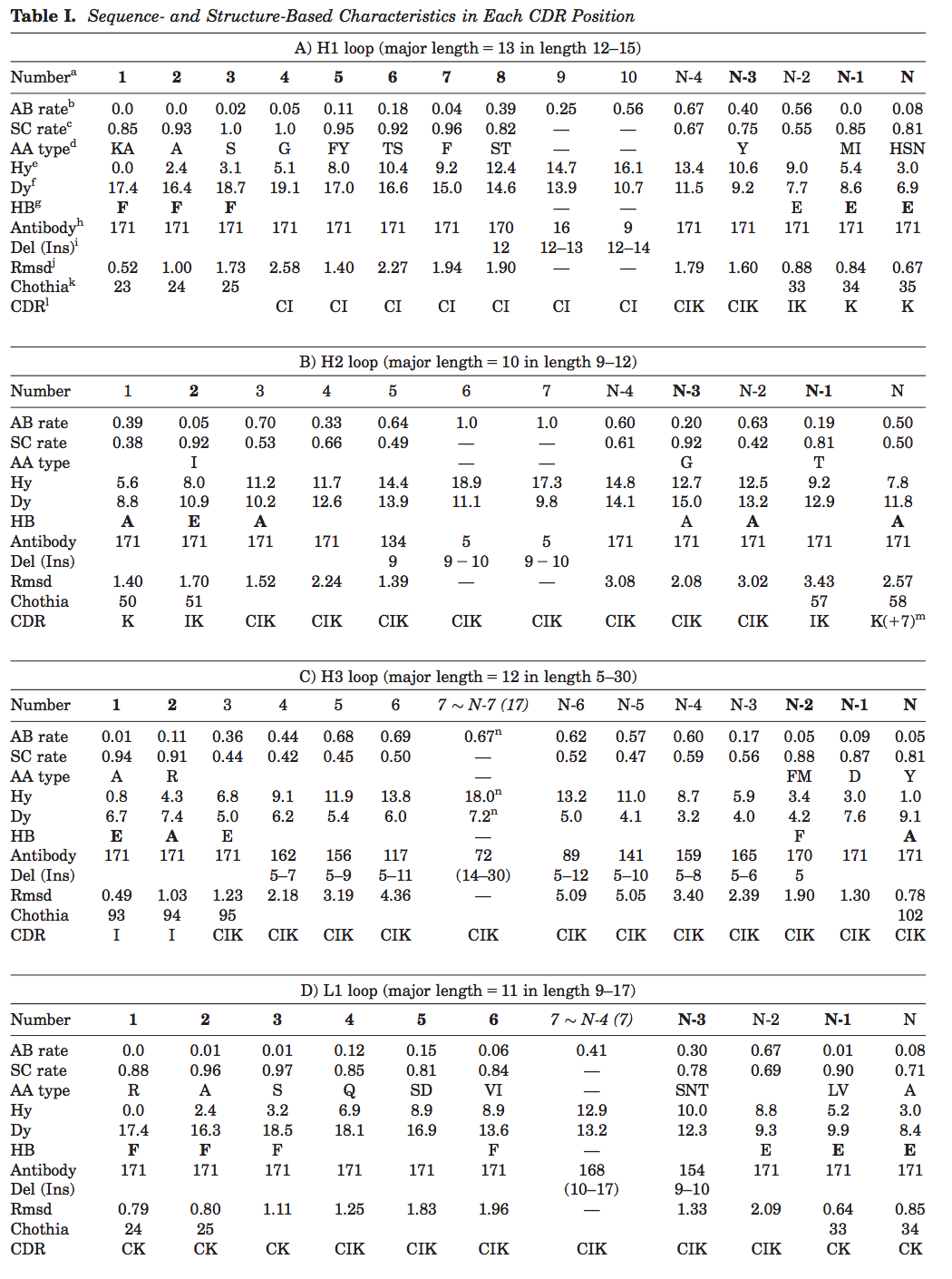
【4.5.4】H3环的多样性决定了抗体CDR环的抗原结合趋势
在抗体的互补决定区(CDR)中,具有不同氨基酸序列和环长度的H3环采用特别不同的环构象。 H3构象的多样性产生涉及所有CDR的一系列抗原识别模式,其中实际上与抗原接触的残基位置变化很大。 因此,为了更深入地理解抗原识别,有必要将每个CDR环中每个残基位置的序列和结构特性与其结合抗原的能力联系起来。 在本研究中,我们提出了一种表征CDR环结构特征的新方法,并获得了每个CDR环中每个残基位置的抗原结合能力。 该分析产生了一套简单的规则,用于鉴定可能的抗原结合残基。 我们还发现H3环长度和构象的多样性影响所有CDR环的抗原结合趋势。
前言
抗体的互补决定区(CDR)在抗原识别中起关键作用。 通常,重链中的CDR环比轻链中的CDR环更频繁地参与抗原结合。 在三个重链环中,H3被认为是抗原识别中最重要的。 六个CDR环中的每一个对抗原识别的贡献彼此不同,并且即使在单个CDR环内,每个残基位置在抗原结合中起不同的作用。 因此,有必要表征CDR环中每个位置的序列和结构特性,以估计抗原结合中每个位置的利用并更详细地理解抗原识别。
如上所述,H3环是六个CDR环中抗原识别的主要贡献者,因为其序列多样性和有利于抗原结合的位置。 序列多样性产生不同的构象,特别是在长H3环中,并且可能需要构象变体来维持抗原特异性和H3在抗原结合中的主要作用。 例如,蛋白质数据库(PDB)包括与包膜糖蛋白复合的抗HIV1抗体的几种晶体结构。 具有长H3环(> 514残基长)的抗体似乎利用它们的H3环来实现高特异性和亲和力(如在PDBID 1g9m中观察到的)。 另一方面,具有短H3环的抗体由于其CDR的完全不同的结构而显示出不同的抗原识别模式(如在PDBID 2vxt中)。 因此,具有不同H3环长度的抗体显示出不同的抗原结合特性。

参考资料
PROTEIN SCIENCE 2016 VOL 25:815—825. The diversity of H3 loops determines the antigen-binding tendencies of antibody CDR loops (IF:2.5)
