【1.6.2.1】白细胞介素Interleukin
白细胞介素(Interleukin)是一种细胞因子(cytokines),在免疫调节和体内平衡中起关键作用。 它最初是从白细胞中发现的。 目前,发现它由许多细胞产生,包括具有坚固结构和功能的巨噬细胞、淋巴细胞。 在本文中,我们从以下几个方面简要介绍白细胞介素,涉及家族和受体、信号通路、功能以及在炎症中的作用。
近年来,白介素的治疗潜力一直是肿瘤基础和转化研究的热点。目前正在进行的越来越多的临床试验凸显了它们作为治疗药物和靶点的价值。
一、 白介素家族和白介素受体 Interleukin Family and Interleukin Receptors
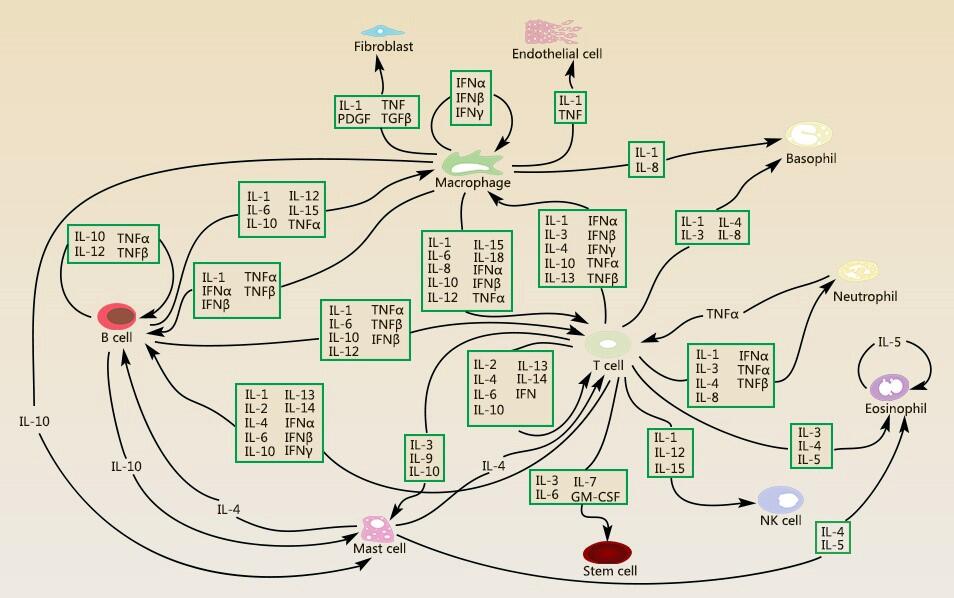
白细胞介素(interleukin,IL)(白介素)是由多种细胞产生并作用于多种细胞的一类细胞因子。由于最初发现是由白细胞产生又在自细胞间发挥调节作用,所以由此得名。IL现在是指一类分子结构和生物学功能已基本明确,具有重要调节作用统一命名的细胞因子:IL在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用,是淋巴因子(1ymphokins)家族中的成员,由淋巴细胞、巨噬细胞等产生。下图是各类细胞分泌各类白细胞介素以及各类白细胞介素调控各类细胞,体现了白介素作用的多样性以及体内炎症反应调控的复杂性。
根据细胞因子的结构同源性可将白介素分为几个蛋白质家族,如IL-1家族、IL-2家族、IL-6家族、IL-10家族、趋化因子家族等。

白细胞介素的成员很丰富,分别命名为IL-1~IL-38。
白细胞介素受体可分为I型、II型和其他类型。 II型白细胞介素受体包括白介素10、20、22、28受体,其他类型包括白介素1、8受体,其余为I型白介素受体。
Table 1. Interleukin Family and Receptors
Gene Name/Alias Uniprot ID Protein Name Receptors
IL-1 α P01583 Interleukin-1 alpha IL1R1, IL1R2
IL-1 β P01584 Interleukin-1 beta IL1R1, IL1R2
IL-2 P60568 Interleukin-2 IL2RA, IL2RB, IL2RG
IL-3 P08700 Interleukin-3 IL3RA, IL3RB
IL-4 P05112 Interleukin-4 IL4R
IL-5 P05113 Interleukin-5 IL5RA, IL3RB
IL-6 P05231 Interleukin-6 IL6R
IL-7 P13232 Interleukin-7 IL7R
IL-8/CXCL8 P10145 Interleukin-8 IL-8, IL8RB
IL-9 P15248 Interleukin-9 IL9R
IL-10 P22301 Interleukin-10 IL10RA
IL-11 P20809 Interleukin-11 IL11RA
IL-12 α P29459 Interleukin-12 subunit alpha IL12RB1
IL-13 P35225 Interleukin-13 IL13RA1, IL13RA2
IL-14/TXLNA P40222 Alpha-taxilin Unkown
IL-15 P40933 Interleukin-15 IL15RA
IL-16 Q14005 Pro-interleukin-16 CD4
IL-17 α Q16552 Interleukin-17A IL17RA
IL-18 Q14116 Interleukin-18 IL18R1
IL-19 Q9UHD0 Interleukin-19 IL20R
IL-20 Q9NYY1 Interleukin-20 IL20R
IL-21 Q9HBE4 Interleukin-21 IL21R
IL-22 Q9GZX6 Interleukin-22 IL22RA1
IL-23 Q9NPF7 Interleukin-23 subunit alpha IL23R
IL-24 Q13007 Interleukin-24 IL20R
IL-25 Q9H293 Interleukin-25 LY6E
IL-26 Q9NHP9 Interleukin-26 IL20R1
IL-27 α Q8NEV9 Interleukin-27 subunit alpha IL27RA
IL-27 β Q14213 Interleukin-27 subunit beta IL27RA
IL-28 Q8IU57 Interferon lambda receptor 1 IL28R
IL-29/IFNL1 Q8IU54 Interferon lambda-1 Unknown
IL-30 Q8NEV9 Interleukin-27 subunit alpha Unknown
IL-31 Q6EBC2 Interleukin-31 IL31RA
IL-32 P24001 Interleukin-32 Unknown
IL-33 O95760 Interleukin-33 Unknown
IL-35 Q14213 Consist of IL-12α and IL-27β chains Unknown
IL-36 α Q9UHA7 Interleukin-36 alpha Unknown
IL-36 β Q9NZH7 Interleukin-36 beta Unknown
IL-36 γ Q9NZH8 Interleukin-36 gamma Unknown
二、成药
2.1 治疗性中和抗体
IL-1
CANTOS研究为IL-1在癌症中的中和作用提供了最有力的证据。该研究纳入了接受标准治疗的稳定型冠心病患者,但高敏C反应蛋白(hsCRP)水平持续升高。患者在纳入时无癌症诊断,之后接受抗IL-1β抗体canakinumab的治疗。结果显示,与安慰剂组相比,canakinumab不仅降低了hsCRP水平,而且显著降低了癌症发生后总体癌症的死亡率,尤其是肺癌。
这一发现催生了一些阻断IL-1β的临床试验,2018年,canakinumab开始在非小细胞肺癌患者中进行单药治疗与安慰剂治疗的III期试验(NCT03447769)。同样,研究canakinumab单药治疗骨髓增生异常综合征和慢性粒细胞白血病的II期试验于2020年开始(NCT04239157)。 2018年,开始使用canakinumab联合pembrolizumab和化疗治疗非小细胞肺癌的III期试验(NCT03631199),并在2019年开始使用canakinumab和单独化疗的III期试验(NCT03626545)。
IL-6
IL-6可保护癌细胞免受治疗诱导的DNA损伤、氧化应激和凋亡,可诱导免疫抑制并维持高度抗治疗的癌干细胞群。因此,IL-6的中和作用可能逆转对传统癌症治疗的耐药性。
抗IL-6抗体siltuximab在异种移植胆管癌模型中减缓了肿瘤生长,但作为单一疗法在多发性骨髓瘤中仅取得非常有限的效果。Siltuximab作为单一疗法对实体瘤也无效,在前列腺癌中,获得的最佳结果是疾病稳定;在肾细胞癌(RCC)中,获得的最佳结果是1例PR,在一组混合实体瘤中未观察到临床疗效。此外,一些临床试验观察到了与治疗相关的副作用,如siltuximab治疗后感染率较高,这总体上不支持siltuximab的抗肿瘤治疗。
与化疗联合,抗IL-6R抗体tocilizumab首次出现阳性结果。然而,中和IL-6与免疫检查点抑制剂(ICIs)相结合引起了争议。虽然IL-6中和可能使患者通过减少细胞因子释放综合征而持续接受ICIs,但IL-6抑制可抑制PD1和PD-L1的表达,这可能会降低ICIs的有效性。由于临床前研究已经证明中和IL-6和ICIs之间的协同作用,一些临床试验已经开始在患者中测试这种组合。
IL-8
HuMax-IL-8是一种IL-8中和抗体,虽然单药治疗未见客观响应,但73%的实体瘤患者疾病稳定,并且未见剂量限制性毒性。IL-8会诱导多种化疗药物和ICI的耐药性,因此,一些临床试验正在探讨HuMax-IL-8联合Nivolumab(NCT03400332、NCT04123379和NCT04050462),联合Nivolumab和degarelix(NCT03689699)以及Nivolumab与放疗(NCT04572451)。
IL-17
在小鼠胃癌模型中,阻断IL-17可减缓肿瘤生长,结合抗PD1治疗可以清楚80%的肿瘤。在临床前小鼠前列腺癌模型中,中和IL-17同样也减缓了肿瘤的进展。另外,IL-17能加速多发性骨髓瘤的进展,临床前研究表明中和IL-17确实能导致多发性骨髓瘤生长的减少。一项始于2017年的临床试验目前正在探究抗IL-17A抗体CJM112在多发性骨髓瘤中的疗效(NCT031111992)。
IL-23
在去势抵抗性前列腺癌中,MDSC衍生的IL-23被证明能激活雄激素受体通路,从而支持雄激素缺乏条件下癌细胞的生存和增殖。在小鼠模型中,中和性IL-23抗体可显著降低肿瘤生长并延长生存期,这提示抗IL-23治疗可能支持抗雄激素治疗方案。为了评估这一潜力,抗IL-23抗体tildrakizumab目前正在一个I/II期试验中,用于去势耐药性前列腺癌患者与雄激素合成抑制剂abiraterone联合治疗(NCT04458311)。
IL-33
临床前研究表明,IL-33可直接作用于肿瘤细胞,诱导多倍体和快速增殖,并引起治疗耐药。使用特异性IL-33阻断抗体可恢复ICI耐药株B16F10黑色素瘤抗PD1治疗的疗效。
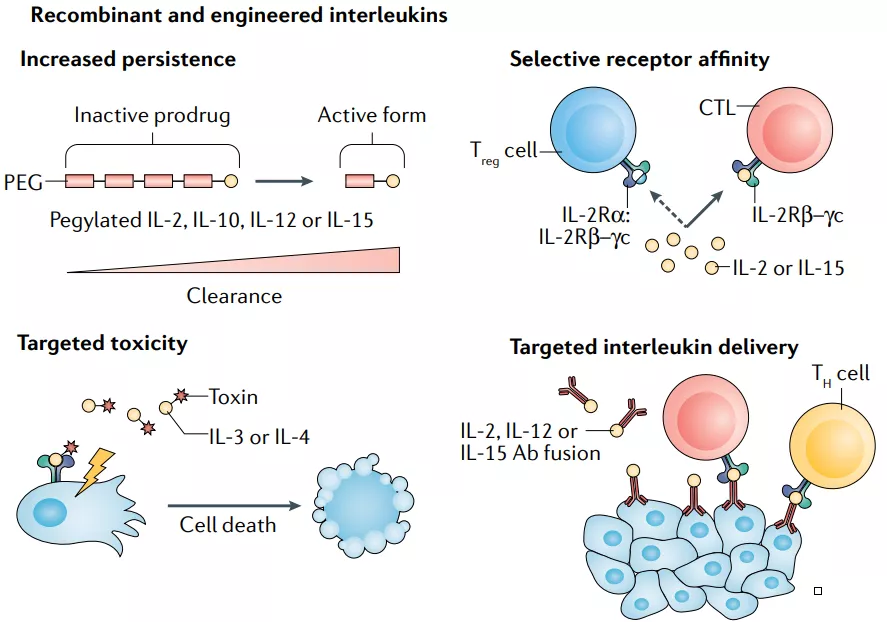
2.2 重组和工程化白介素
IL-2
尽管大剂量IL-2治疗在一些黑色素瘤和肾细胞癌患者中诱导了持久的完全反应,但它也伴随着潜在的危及生命的不良事件。因此,在一些试验中评估了低剂量IL-2方案, 然而,在低丰度时,IL-2优先与其在Treg细胞上表达的高亲和力受体结合,可能导致免疫逃避。因此,对CTL上表达的IL-2R亲和力增强的几种IL-2变体正在开发中。
Bempegaldesleukin是一种聚乙二醇化的IL-2变体,除了增加其半衰期,聚乙二醇偶联到IL-2阻断了其与高亲和力亚单位IL-2Rα的结合位点。随着时间的推移,PEG基团会丢失,并不断释放活性形式的Bempegaldesleukin,从而将过量用药的风险降至最低。 在一项针对转移性实体瘤(主要包括黑色素瘤或肾细胞癌)患者的I期临床试验中,bempegaldesleukin单药治疗观察到的最佳反应是疾病稳定,与的传统IL-2治疗在黑色素瘤和肾细胞癌分别取得7%和9%的持久CR相比,这是令人失望的。然而,bempegaldesleukin显示出良好的安全性,鼓励与ICIs联合使用。一项针对转移性实体瘤的的I期临床试验中,bempegaldesleukin联合nivolumab取得了19%的完全缓解率。其他一些与ICIs联合的临床试验,包括膀胱癌患者的III期临床试验(NCT04209114),RCC(NCT03729245)和黑色素瘤(NCT03635983)目前正在进行。
其他IL-2变体也正在与ICIs联合进行临床试验,如ALKS 4230,一种环状结构重组的IL-2和IL-2Rα ,设计用于选择性激活中间亲和力的IL-2R。目前,有四项临床试验正在晚期实体瘤或头颈部非皮肤鳞状细胞癌患者中评估单药治疗和与pembrolizumab联合治疗的效果(NCT04592653, NCT02799095,NCT03861793和NCT04144517)。THOR707是一个工程化的非α IL-2变体,正在实体瘤患者中评估单药治疗或与ICI或抗EGFR抗体联合治疗的疗效(NCT04009681)。
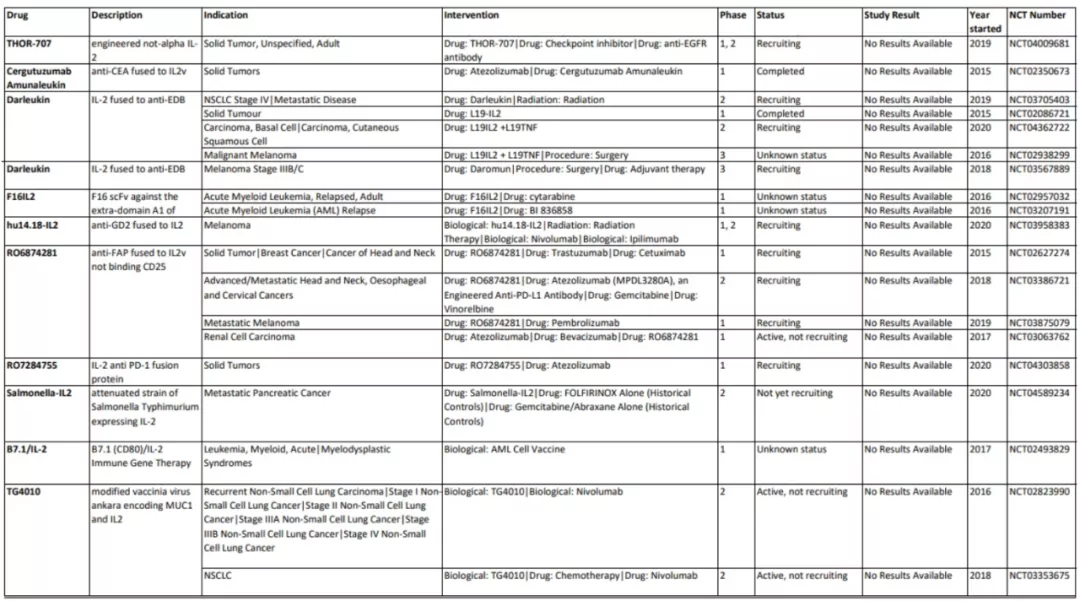
NARA1是一种融合蛋白结构,由IL-2与抗IL-2抗体NARA1融合而成。NARA1因此永久性地遮蔽IL-2的CD25结合位点,从而消除CD25介导的Treg细胞发育。其在小鼠黑色素瘤模型中表现出有效的抗肿瘤反应。其他的一些IL-2变体还包括RO6874281,RO7284755,Darleukin等,这些药物的临床试验正在进行中,如下表所示。
IL-10
IL-10具有抗炎和刺激CTL的特性,这使得它成为一种潜在的抗癌药物。聚乙二醇化IL-10变异体pegilodecakin可诱导全身免疫活化,增加免疫刺激性细胞因子水平,降低TGF-β 在实体癌患者中的表达。 在临床试验中,pegilodecakin治疗可观察到PR和长期的疾病稳定。在一项随访的临床研究中,观察到治疗后肿瘤内CTL的扩增和激活。此外,pegilodecakin与ICIs联合应用的第一个临床试验也展现了富有希望的结果;然而,由于不良的风险-收益比,两项联合使用nivolumab(NCT03382912)和pembrolizumab(NCT03382899)的随访试验提前终止。 CmAb-(IL-10)2是一种融合蛋白,由抗EGFR得西妥昔单抗与IL-10二聚体的融合,目前仍处于临床前研究阶段,显示出优越的抗肿瘤活性。
IL-12
IL-15
IL-18
IL-18治疗的临床前疗效有限,这可能是由于IL-18BP,一种高亲和力的IL-18诱饵受体。目前,研究人员利用直接进化技术,开发出抗诱饵IL-18(DR-18),它维持信号传导潜能,并且通过支持效应器T细胞的发育、减少T细胞衰竭、增强NK细胞的活性和成熟等途径,在小鼠体内发挥出强大的抗肿瘤作用。
IL-23和IL-36
IL-36γ 与IL-23和OX40配体联合应用,在临床前动物模型中成功用于促进急性炎症,以有效控制肿瘤,目前正在临床试验中进行研究(NCT03739931)。
2.3 过继性细胞疗法的补充
过继性细胞疗法(ACT)是近十年来癌症治疗领域的重要突破。IL-2、IL-7和IL-15等白介素已被广泛用于改善过继细胞的体外扩增和分化,并通过联合给药或通过基因工程将其导入转移细胞来辅助ACT的治疗。
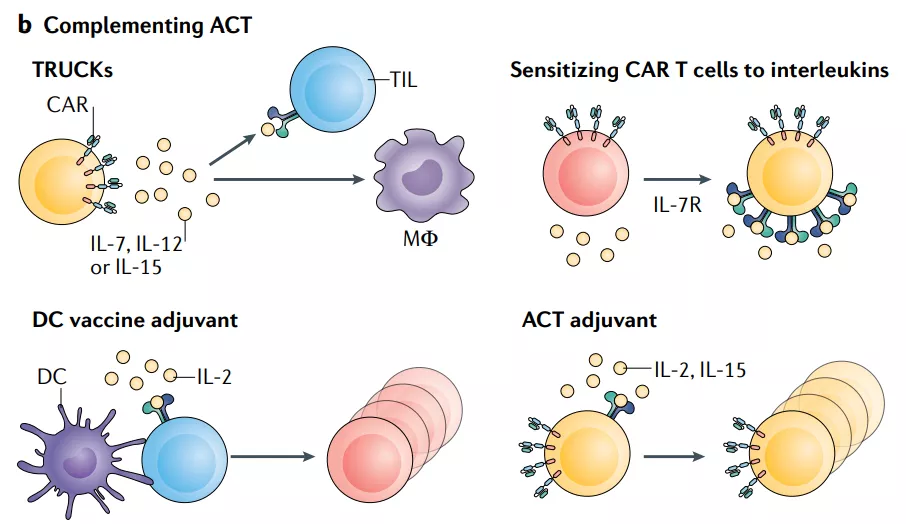
IL-2
用IL-2支持ACT的治疗在几种癌症类型中取得了不同的成功。例如,IL-2在黑色素瘤中与TIL联合。此外, CAR-T细胞与IL-2的联合也在一些试验获得了益处,但这种方法仍然面临着与单独使用白介素类似的毒性问题。 克服全身性IL-2治疗的毒性作用,同时保持其支持ACT治疗的能力的策略是设计的IL-2与IL-2R配对。经过设计的IL-2不能与野生型IL-2R结合,但可与设计的IL-2R结合,传递天然IL-2信号。这种设计避免了全身毒性。在小鼠黑色素瘤模型中显示出增强的ACT产品功效和可忽略的毒性作用。
IL-8
另一种完全不同的方法是使用肿瘤相关的白介素,如IL-8,通过过度表达相应的受体来改善CAR-T细胞向肿瘤的浸润。在胶质母细胞瘤、卵巢癌和胰腺癌的临床前模型中,IL-8受体CXCR1或CXCR2在CAR-T细胞中的表达显著增强了在肿瘤中的迁移和持久性,并诱导了肿瘤的完全消退和持久的免疫记忆。
IL-12
IL-7
IL-15
IL-23
IL-23是最近报道的一种替代IL-12和IL-15等具有潜在毒性的白介素的方法。一项临床前研究表明,含有IL-23亚基p40的工程化CAR-T细胞可产生自分泌IL-23信号,促进活化T细胞的选择性增殖,提高抗肿瘤能力。此外,与使用IL-18或IL-15相比,副作用似乎减少了。
2.4 总结
总的来说,白介素单一疗法仍然面临着很大的局限性,最近出现了许多新的策略来解决这些问题。这一趋势正在从应用白介素的天然形式转向复杂的工程化方法,涉及改变靶细胞群的受体亲和力或设计肿瘤靶向融合结构以提高疗效和减少全身毒性作用。
此外,为了提高白介素治疗的应用率,联合治疗越来越重要。对白介素如何影响组织修复、癌症进展和免疫逃避的新见解将大大有助于确定白介素如何参与对化疗或ICI治疗等既定疗法的抵抗。因此,白介素治疗可以释放其他疗法的潜力,从而帮助耐药患者从中受益。
总之,白介素是协调TME和控制肿瘤-免疫细胞相互作用的关键元素,白介素治疗癌症已经在临床前和临床研究方面取得大量令人兴奋的新进展,这些研究将在未来几年更多有趣的结果。
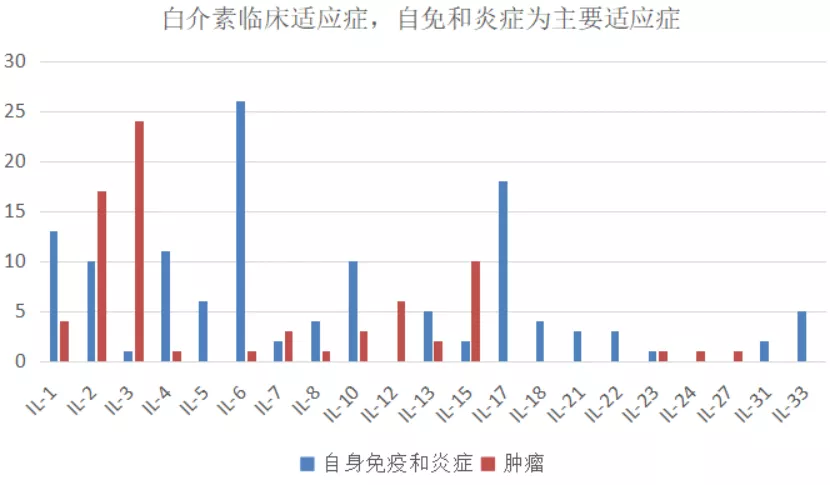
三、各类白介素的功能和相关疾病
每种类型的白介素来自不同的细胞,作用于不同的目标细胞,大部分白介素参与自身免疫、炎症疾病,部分白介素对部分癌种具有特异性:
- IL4、IL5、IL13和IL33等与哮喘疾病发展具有重要联系,针对这些靶点已有药物上市、临床中也有很多管线在布局;
- IL3在血液瘤中起着重要作用,临床较多管线在布局IL3靶点项目;
- IL2和IL15在自免和肿瘤中都均有较多临床管线布局;
- IL1、IL6、IL10和IL17等主要参与自免和炎症疾病,已有药物上市,临床管线密集。

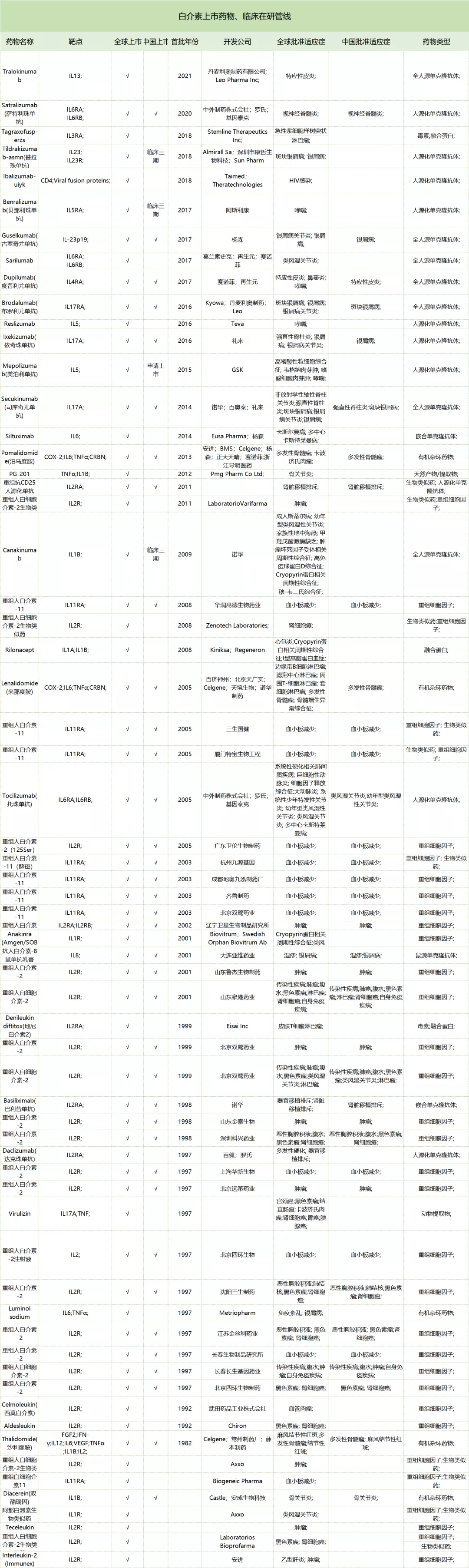
五、上市药物和临床在研管线
5.1 上市药物
截止2021年6月,以白介素为靶点的上市药物共64个(含生物类似物)。按照药物类型分,重组细胞因子25个、单抗19个、融合蛋白3个、生物类似物10个。已上市药物的适应症集中在肿瘤、自身免疫和炎症疾病,以IL2为靶点的上市药物数量最多主要适应症为黑色素等肿瘤,其次为IL11为靶点的上市药物主要适应症为血小板减少症。
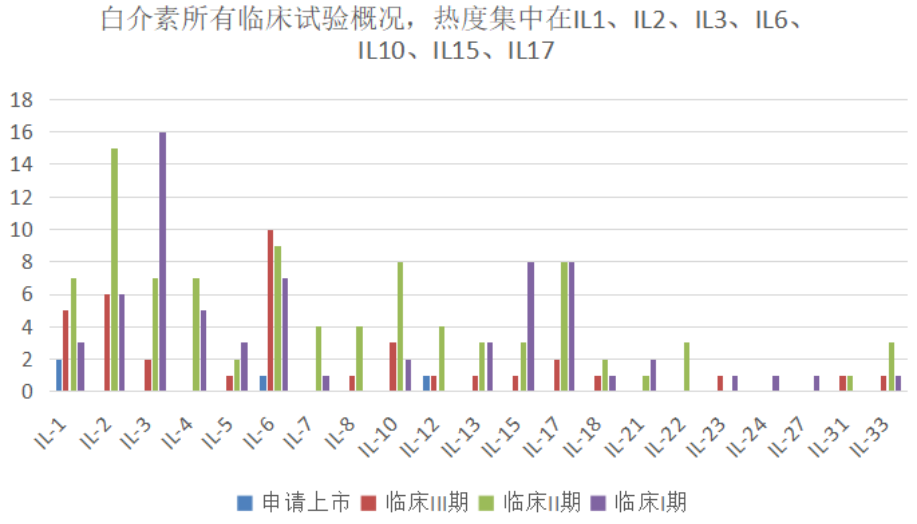
5.2 临床在研管线
截止2021年6月,白介素临床在研项目近200多项,最热门的项目靶点集中于IL1、IL2、IL3、IL6、IL10、IL15和IL17,其中IL2、IL3和IL15靶点主要集中肿瘤疾病,IL1、IL6、IL10和IL17靶点主要布局自免和炎症领域。
资料来源:药渡数据库,数据截止至2021年6月
参考资料
- https://www.cusabio.com/c-20630.html#:~:text=Interleukin%20is%20a%20kind%20of,a%20solid%20structure%20and%20function.
- https://mp.weixin.qq.com/s/_x83HGtWXqbW1tSZ-jULVQ
- Interleukins in cancer: from biology to therapy. Nat Rev Cancer. 2021 Jun 3 : 1–19.
- https://mp.weixin.qq.com/s/SL18koHxeRtJZDDpNk0AAQ
- Akdis M, Burgler S, Crameri R, Eiwegger T, Fujita H, Gomez E, Klunker S, Meyer N, O’Mahony L, Palomares O, Rhyner C, Ouaked N, Schaffartzik A, Van De Veen W, Zeller S, Zimmermann M, Akdis CA. Interleukins, from 1 to 37, and interferon-γ: receptors, functions, and roles in diseases. J Allergy Clin Immunol. 2011 Mar;127(3):701-21.e1-70. doi: 10.1016/j.jaci.2010.11.050. Erratum in: J Allergy Clin Immunol. 2011 Oct;128(4):739. Quaked, Nadia [corrected to Ouaked, Nadia]. PMID: 21377040.
