【2.7.6】人源化VHH库(NaLi-H1)
抗体的体外选择允许快速且低成本地获得功能强大的结合剂(binders)。在这里,我们描述了人源化的美洲驼单域抗体的第一个完全合成的噬菌体展示库(NaLi-H1:Nanobody Library Humanized 1)。基于针对细胞内稳定性优化的人源化合成单结构域抗体(hs2dAb, humanized synthetic single domain antibody)支架,高度多样化的文库无需动物免疫即可提供高亲和力结合剂。根据多种选择方案针对各种靶标(荧光蛋白,肌动蛋白,微管蛋白,p53,HP1)筛选NaLi-H1。还获得了针对活性RHO GTP酶的构象抗体。选定的hs2dAb被用于各种免疫测定中,通常被发现是功能性抗体,能够追踪或抑制内源性靶标。体内抗体的功能性使活细胞中的特定蛋白敲低。最后,针对肿瘤细胞表面的直接选择产生了针对肿瘤特异性抗原的hs2dAb,进一步突显了该文库在治疗应用中的潜在用途。
一、eLife摘要
抗体是构成动物免疫系统一部分的蛋白质,可以识别并帮助消除感染。这些蛋白质在生物学研究的许多阶段也都需要,并且代表了从诊断到治疗的医学应用中最有前途的工具之一。
传统上,已经从动物中收集了抗体,这些动物先前已经注射了抗体必须识别的靶分子。几十年前开发了一种使用细菌和感染细菌的病毒代替动物的替代策略,它使研究人员可以更快地获得抗体。但是,大多数科学界认为这些“体外选择的抗体”不如通过传统方法产生的抗体。
Moutel,Bery等开始使用一种称为纳米抗体的较小类型的抗体来挑战这一广泛的观点。这种蛋白质最初是在骆驼和骆驼等动物中发现的,现已广泛用于生物学研究。选择了一种特别稳定的纳米抗体以形成体外抗体的骨架,并改变了编码该纳米抗体的DNA,使蛋白质与人抗体更相似。 Moutel,Bery等然后进一步改变DNA序列,以制造数十亿个不同版本的纳米抗体,每个纳米抗体在与靶分子结合的区域中与下一个略有不同。
将该DNA转移到细菌中,产生了一个细菌克隆文库(称为NaLi-H1文库),该文库产生了在感染细菌的病毒表面展示的纳米抗体。 Moutel,Bery等然后针对各种靶分子(包括一些来自肿瘤细胞的靶分子)筛选了该文库,并表明在许多分析中,完全体外选择的抗体的作用与天然抗体一样。体外抗体甚至可以用来追踪或灭活活细胞内的蛋白质。
NaLi-H1文库将帮助其他研究人员获得与目标紧密结合的新抗体。开发用于创建文库的方法还可以使更多的人决定创建自己的合成库,这将以更便宜的方式加速对新抗体的鉴定,并且需要使用动物进行的实验更少。这些体外选择的抗体可能有助于推进基础研究和医学研究。
二、前言
抗体作为标记细胞或组织中抗原的生化工具而发展。在过去的20年中,已经开发了重组方法,可以从高度多样化的文库中快速选择和改进单克隆抗体。重组抗体可以选自免疫或纯天然文库。免疫文库通常提供高亲和力的结合物,但根据抗原的不同,多样性有时会受到限制。由于天然抗体的选择需要动物免疫,因此应避免非常保守或有毒的抗原,并且通常只能有限地控制免疫反应。相反,即使对于哺乳动物中高度保守的抗原,非免疫(天然)文库也提供了更高的结合物多样性,但只有从非常大的功能文库中进行选择时,才能达到高特异性和亲和力。免疫和天然文库基于抗体片段的操作,该片段保留了整个免疫球蛋白G(IgG)的结合能力和特异性。
能够以高特异性结合抗原的最小IgG部分是由可变重链(VH)和可变轻链(VL)域组成的Fv片段。在单结构域抗体(sdAb)的情况下,单独的VH或VL能够结合其靶抗原。每个可变结构域包含四个保守的框架区(FRW或框架)和三个称为CDR(互补决定区)的区域,它们对应于确定抗原特异性的高变序列。可以使用合成接头将VH和VL融合在一起,并以单链Fv(scFv)的形式产生为单个蛋白质。它们易于操作,可以在多种细菌或真核细胞类型中产生,并融合到各种标签或功能域中。有趣的是,在骆驼科中被称为HCAb的抗体(Hamers-Casterman等,1993)或在鲨鱼中被称为IgNAR的抗体(Greenberg等,1995)具有仅由VH结构域组成的抗原识别部分。骆驼科天然单结构域VH(称为VHH或纳米抗体)可以表达为重组片段,并代表了经典抗体片段(如scFvs)的诱人替代品,因为它们易于操作,并且不受两个结构域潜在错误折叠的限制(Wörn和Plückthun,1999年)。值得注意的是,VHH FRW与III族的人VH结构域具有高度的序列和结构同源性(Muyldermans,2013),并且VHH的免疫原性与人VH相当(Bartunek等,2013; Holz等,2013)。因此,它们进一步构成了用于治疗应用的非常有趣的药物,其中一些目前处于II期和III期临床试验中(Ablynx纳米抗体; http://clinicaltrials.gov/ct2/results?term=ablynx )。
重组抗体片段不仅可以加速独特结合物的鉴定,而且还可以开发新型工具:在这种情况下,抗体在活细胞中直接表达为细胞内抗体(体内抗体),以追踪或干扰内源性靶标在蛋白质水平上。实际上,某些scFv或sdAb已作为真核抗体直接在真核细胞中表达,可靶向具有高特异性的胞内抗原。几种体内抗体已被用作荧光蛋白融合体,以时空方式突出细胞中的内源性抗原(Nizak等,2003a; Rothbauer等,2006)。据报道具有内在阻断活性的体内抗体(Haque et al。,2011; Shin et al。,2005),并且已经开发了其他几种方法以允许将更大比例的体内抗体用作抑制因子:强制共定位( Tanaka等人,2007年),通过蛋白酶体靶向自杀(Joshi等人,2012年; Melchionna和Cattaneo,2007年),重新路由或隔离到细胞室中(Böldicke等人,2005年),降解(Caussinus等人,2011年) )。取决于靶标,此类抑制剂可能在人类治疗中具有潜力。功能性体内抗体的产生取决于抗体片段在胞质还原环境中的稳定性,该还原性环境不允许在保守的半胱氨酸之间形成二硫键。在这种情况下,已经报道了纳米抗体支架的许多优点,尤其是更高的溶解度,在还原环境中提高的稳定性(Wesolowski等,2009)以及更高的表达产量和热稳定性(Jobling等,2009)。 2003)。由于所有这些原因,纳米抗体支架代表了产生功能性体内抗体的有吸引力的选择。
因此,我们决定基于纳米抗体支架创建高度多样性的非免疫重组抗体文库,该文库能够针对几乎所有抗原进行有效的体外抗体选择。这种文库应提供可用于常规免疫测定的抗体,并富含在细胞内环境中活跃的抗体。首先,在大肠杆菌中使用融合测定法,发现了一个功能强大的VHH支架家族
三、结果与方法
3.1 文库设计 Library design
我们认为这些非免疫文库的通常较低质量可能归因于
- 可能无法稳固折叠和呈现CDR区的抗体支架,
- 缺乏CDR区多样性控制
- 由于意外突变或空克隆的存在,经常会出现不正确的克隆。
我们设计了用于开发功能性合成库的管道,旨在克服这些局限性(图1A)。
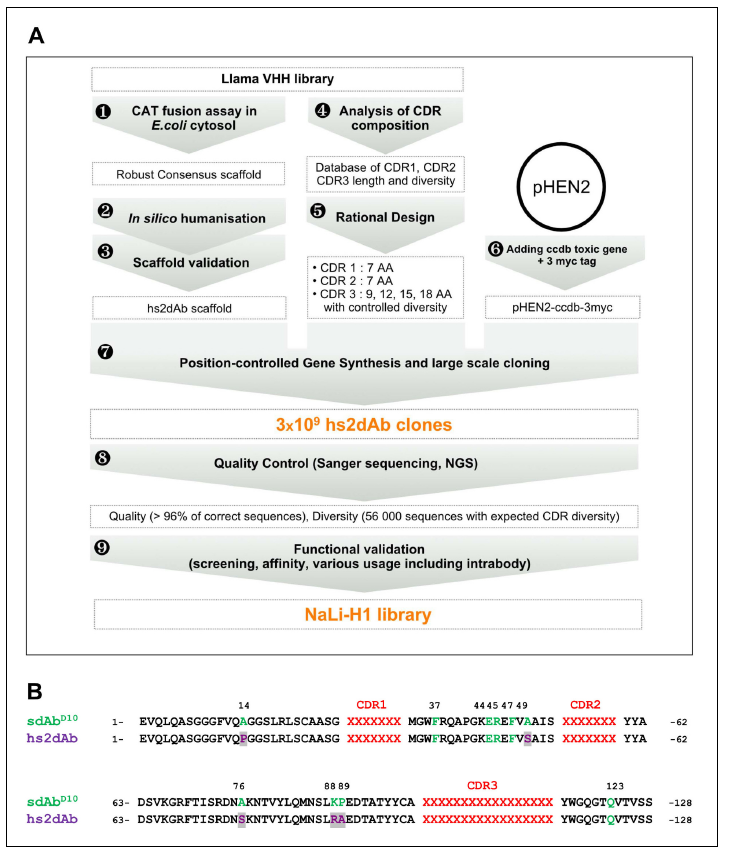
Figure 1. Overview of scaffold selection, diversity design, and synthetic production of the NaLi-H1 library. The development of the NaLi-H1 library followed three lines of optimization. (i) A novel scaffold was defined by selecting a set of robust nanobodies using a CAT fusion assay (1). A consensus was derived and mutations were introduced to humanize the scaffold (2). Usability and efficacy of the novel scaffolds (VHH and humanized) were then confirmed evaluating their display on phage, expression in CHO cells and use as intrabodies (3).In silico design was completed analyzing natural CDR diversity (4) and using this information to design synthetic CDRs. A fixed size of 7 aa was chosen for the CDR1 and CDR2. 4 sizes (9, 12, 15 and 18 amino acids) were chosen for CDR3. Finally, the pHEN2 vector was improved by implementing a triple myc tag and inserting a toxic gene (ccdb) to ensure low frequency of empty clones during library construction (6). Gene synthesis (using a tri-nucleotide approach) was ordered, synthetic sequences cloned into the novel pHEN2+ vector, transformed into bacteria and plated on 430 15 cm plates. 3 × 109 clones were obtained. Quality control was carried out using Sanger sequencing of 315 randomly picked clones and large scale sequencing of 56 000 clones. No redundant clone was found. The NaLi-H1 was then screened in various conditions and diversity, efficacy, versatility and affinity evaluated.
作为构建富含高稳定性和功能性抗体片段的单域抗体文库的第一步,我们筛选了robust的sdAb支架(图1-图补品1)。以前,我们从免疫或纯净的美洲驼VHH文库中选择了数百个克隆(Monegal等,2012; Olichon和Surrey,2007)。从这一人群中,我们使用一种测定方法鉴定了一组robust的支架,该方法将高度稳定的克隆与细菌细胞质中易于聚集或展开的克隆区分开来(Olichon和Surrey,2007)。该测定基于HA标记的氯霉素乙酰基转移酶(CAT)与VHH序列的羧基末端的融合(图1-图补充1A)。在这些条件下,只有在还原性胞质溶胶中表达功能性VHH融合的细菌(未聚集,未降解)才能在高抗生素浓度的情况下生长,从而过滤出可能的体内抗体亚库。进一步评估大肠杆菌中的表达产量和在哺乳动物细胞质中作为EGFP融合蛋白的表观溶解度,以选择一组robust的抗体支架。令人惊讶的是,共有支架与由单结构域抗体D10(以下称为sdAbD10)代表的最健壮的VHH框架序列匹配。与先前报道的热稳定的纳米抗体(Olichon等,2007a)或体内抗体(Rothbauer等,2006)相比,在氯霉素过滤器测定中发现sdAbD10具有更高的抗生素抗性(图1-图补品1A) )。它在大肠杆菌周质中的表达量在可溶性美洲驼VHH片段的较高范围内,可以进行有效且定量的纯化(图1-图补品1B)。纯化的sdAbD10在70°C处理后显示出极好的溶解性,稳定性,当在哺乳动物细胞中表达为融合到EGFP的体内时,我们没有观察到聚集(图1-图补充1C)。
为了测试由FRW 1-4组成的sdAbD10支架是否在CDR序列上独立存在,我们将针对laminB的lam1 VHH的CDR环(Rothbauer等人,2006)嫁接到了sdAbD10(sdAbD10-抗lamin)。同时,还对支架的部分人源化进行了测试,以确定其是否显着影响其内在特性。
- 合成支架sdAbD10的7个残基向人类VH3中最具有代表性的方向改变,而其他5个不同的残基保持不变。
- 保持了框架2区域(位置42、49、50和52)中对增加固有溶解度特性必不可少的四个美洲驼VHH特异性氨基酸标记以及位置103中的谷氨酰胺。我们将所得杂交单域VH hs2dAb(人源化合成单域抗体)命名(图1B)。
将抗lamin的CDR移植到这两个支架中后,我们分析了它们在M13表面上的展示(图1-图2A)和大肠杆菌和CHO细胞的产生(图1-2B)。两种支架均显示出相似的良好疗效。重要的是,sdAbD10和hs2dAb支架均能实现嫁接CDR的功能展示,并且通过Hela细胞的免疫荧光染色观察到了对内源性薄层蛋白的强力检测(图1-图补品2C)。最后,Rothbauer等。 (Rothbauer等人,2006)表明,原始的抗纤层蛋白VHH在细胞内表达时识别其靶抗原。类似地,我们观察到hs2dAb和sdAbD10支架均允许有效地体内使用合成的抗lamin抗体(图1-图2D)。这进一步表明,合成支架是robust的,非聚集的并且抵抗细胞溶质中的还原条件,同时允许CDR环的正确展示。由于部分人源化不会影响sdAbD10支架的特性,因此我们选择hs2dAb支架作为独特的框架,以构建具有这些单域抗体的特征稳定性,同时显示更接近人VH3氨基酸序列的合成纳米抗体库。
3.2 Library construction
通过使用一组氨基酸来合理地控制CDR1和CDR2的每个位置,从而在三个CDR中引入了合成多样性,这些氨基酸概括了部分自然多样性(请参见附录),同时减少了大多数疏水性残基的存在,从而避免聚集倾向(请参阅材料和方法)。为CDR1和CDR2选择了7个氨基酸的恒定长度。自然观察到广谱的骆驼科VHH CDR3长度,并且已知该环对抗原结合选择性有很大贡献。因此,我们选择使用四种不同长度的CDR3来覆盖该光谱(9、12、15或18个氨基酸),并在每个位置引入随机氨基酸(半胱氨酸除外)。
通过三核苷酸DNA组装产生合成DNA,并从2.10^11个不同分子开始进行扩增,仅使用几个PCR周期(Q-PCR验证的PCR线性)即可防止扩增过程中的漂移。将合成文库插入到修饰的pHEN2噬菌粒载体中,该载体包含三重myc-tag和自杀基因(ccdB),可对带有插入物的克隆进行阳性选择(Bernard等,1994)。使用大肠杆菌TG1细胞进行大规模电穿孔,并使用430个大型琼脂培养皿(140毫米)以确保文库的正确铺板。获得了约3.10^9个个体重组hs2dAb克隆。我们将此库命名为NaLi-H1(针对纳米抗体库人性化1)。我们首先通过对315个随机克隆进行测序来评估NaLi-H1文库的质量。仅发现13个序列不正确(带有框内终止密码子,缺少一个碱基,缺少大区域(CDR1或CDR1-FWR1-CDR2)或为空)。因此,观察到总共约潜在潜在违约的4%,与获得的3.10^9个克隆相比,这是相当低的,并且仅是微不足道的。然后通过使用离子激流芯片(Life Technologies)对5.6 10^5个插入片段进行测序来评估多样性。这证实了文库的质量,并表明四个CDR3长度(9、12、15或18个氨基酸)以相似的比例存在。发现CDR中氨基酸的多样性和统计分布符合预期(图1-图补充3)。为了评估库中存在的hs2dAb的整体折叠,我们随机选择了24个克隆,并测试了它们在分泌后在细菌培养基中的溶解度。将培养基以250000μg离心,分析上清液和沉淀。所有测试的克隆都显示出基本完全的溶解度,至少与天然喇嘛抗体(GFP4)一样好。即使在90°C加热10分钟后,hs2dAb仍显示出良好的溶解度(超过70%)(图1-图补品4)
- 基于对天然VHH中多样性的统计分析,旨在减少某些位置的疏水性。
- CDR1和CDR2的大小固定为7个氨基酸,而选择了4种CDR3的大小(9、12、15和18个氨基酸)
在分析了天然VHH上每个位置上存在的自然多样性并遵循以下所示规则后,确定了合成CDR环每个位置选择的氨基酸残基(参见图1-图3,天然VHH和hs2dAb之间的多样性比较)
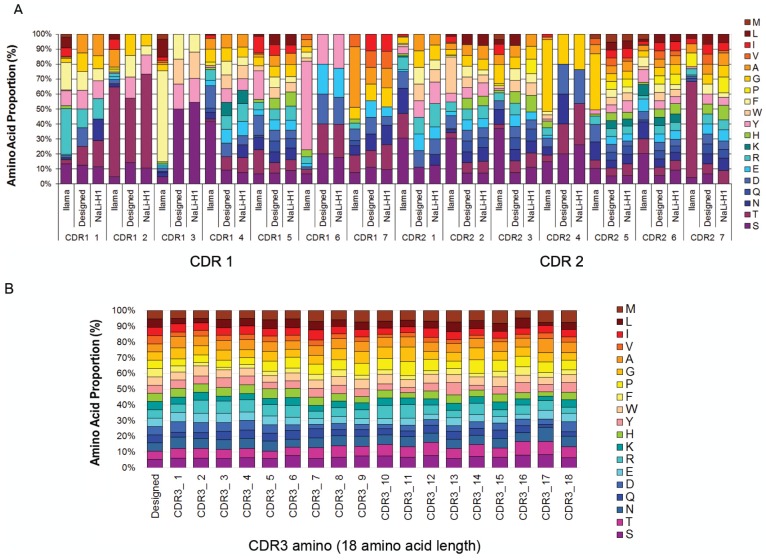
Nali-H1 library diversity. (A) Comparison between relative amino acid frequencies in CRD1 and CDR2 observed from 250 llama VHH isolated from a naïve library (llama), the rationally designed (Designed) and the effective diversity in the synthetic library (Nali-H1) as computed after sequencing of 2500 clones using NGS. The position of each amino acid is indicated (CDR1 1; CDR1 2; etc). Amino Acid are indicated in single letter code. (B) Comparison between the designed diversity set for every amino acid position in the CDR3 region with the effective diversity observed after sequencing 2500 clones using NGS. Note that various CDR3 amino acid lengths are present in the library. They were almost evenly distributed with a little bias for shorter CDR3s (9 aa: 26%; 12 aa: 27.2%; 15 aa: 23.7%; 18 aa: 23.1%). For simplicity, we report in the figure the diversity observed for up to 18 aa. Note also that although cysteine occurs in natural llama CDRs, they were avoided by design and, accordingly, not found in Nali-H1 CDRs.
at CDR1 position 1: Y, R, S, T, F, G, A, or D [Y,S, F were the most frequent amino acid]
at CDR1 position 2: Y, S, T, F, G, T, or T [T was the most frequent amino acid so we imposed a 3 fold higher stoichiometry for T at that position]
at CDR1 position 3: Y, S, S, S F, or W [S was the most frequent amino acid so we imposed a 3 fold higher stoichiometry for T at that position]
at CDR1 position 4: Y, R, S, T, F, G, A, W, D, E, K or N [natural diversity respected while avoiding hydrophobic residues]
at CDR1 position 5: S, T, F, G, A, W, D, E, N, I, H, R, Q, or L [natural diversity respected. Because the frequency of hydrophobic I was high at this position in natural VHH, some hydrophobic amino acids were accepted]
at CDR1 position 6: S, T, Y, D, or E [S, T, and Y were the most frequently found amino acids in natural VHH]
at CDR1 position 7: S, T, G, A, D, E, N, I, or V [a high frequency of hydrophobic I or V was observed in natural VHH but their proportion was reduced here by adding polar residues]
at CDR2 position 1: R, S, F, G, A, W, D, E, or Y [D and E were added to help for solubility and W for specific interaction in hydrophobic pockets]
at CDR2 position 2: S, T, F, G, A, W, D, E, N, H, R, Q, L or Y [introducing strong diversity]
at CDR2 position 3: S, T, F, G, A, W, D, E, N, H, Q, P [introducing strong diversity]
at CDR2 position 4: G, S, T, N, or D [G, S, T and N where the most frequent]
at CDR2 position 5: S, T, F, G, A, Y, D, E, N, I, H, R, Q, L, P, V, W, K or M [allowing full diversity]
at CDR2 position 6: S, T, F, G, A, Y, D, E, N, I, H, R, Q, L, P, V, W, or K [allowing strong diversity]
at CDR2 position 7: S, T, F, G, A, Y, D, E, N, I, H, R, Q, L, P, or V [allowing strong diversity]
at CDR3 for every position: S, T, F, G, A, Y, D, E, N, I, H, R, Q, L, P, V, W, K or M [introducing full diversity] CDR 3 length have been designed in order to produce 4 different subtype of hs2dAb with 9, 12, 15 or 18 residues in CDR3.
3.3 试验
略
四、讨论
在这里,我们报告了基于衍生自美洲驼VHH的人源化支架的第一个大型完全合成单域抗体文库的构建。首先使用大肠杆菌胞质溶胶中的阳性表达筛选来鉴定一组robust 的纳米抗体支架。鉴定了一种非常robust 的支架(sdAbD10),并将其用作基础。在引入了一些旨在使其一级序列人源化的修饰后,我们设计了hs2dAb支架,该支架与sdAbD10一样稳定,同时更接近人类VH3。我们的数据表明,hs2dAb在90°C处理10分钟后显示出部分电阻和/或重折叠。使用CDR接枝实验,我们证实了合成支架展示CDR区域的功效和稳定性。根据我们在噬菌体展示库,免疫或天然美洲驼VHH库(Monegal等,2012; Olichon和Surrey,2007)或scFv库(Dimitrov等,2008; Goffinet等,2008; Nizak)的先前经验等人,2003a),然后我们合理地设计了具有固定的CDR1和CDR2大小以及四个CDR3大小(9、12、15或18个氨基酸)的CDR多样性。现代基因合成方法的强大功能可在控制密码子偏倚和克隆特征的同时达到很高的遗传多样性。使用NNN或NNK三核苷酸的完全随机密码子组合不能防止终止密码子,不希望的半胱氨酸或疏水残基被掺入,并且不会导致在给定位置出现氨基酸的受控可能性。因此,与最近开发的Fab合成文库相比,采用了针对每个CDR氨基酸位置定义的密码子集的更合理的设计,以使其不模仿自然多样性(Prassler等,2011; Zhai等,2011) ,但针对固有亲水性或溶解性进行了优化。大规模克隆合成片段后,在细菌中转化了30亿个独立克隆。 Sanger和下一代测序证实了文库质量。
通过针对各种靶标进行筛选来验证该文库,并在每种情况下均获得了特异性和高度功能化的抗体(表1)。各种选择方案产生了大量的高亲和力和高选择性粘合剂。使用涂覆在聚苯乙烯上,磁珠上或直接在细胞表面上的纯化抗原进行选择。在许多情况下,两轮选择足以获得选择性粘合剂。我们通常只分析80个随机选择的克隆,因为特异性结合剂的多样性在系统上很高。只有少数选择导致可用于蛋白质印迹的抗体(抗肌动蛋白,抗微管蛋白),可能是因为大多数筛选是使用天然折叠的靶标进行的。因此,选择的hs2dAb在其他常规免疫测定如ELISA,FACS,免疫沉淀或免疫荧光中表现非常好。通过表面等离子体激元共振进行的亲和力测量揭示出KD值约为10纳摩尔,最高可达50皮摩尔。如此高的亲和力非常好,并且通常很少观察到未经体内免疫或体外亲和力成熟步骤而获得的单价结合剂(图6;表2)。
因此,NaLi-H1库可快速选择各种功能强大的粘合剂(binders)。因为它是完全合成的,非免疫的文库,所以它不依赖于动物实验,它不受天然免疫原性或抗原毒性的限制,并且可以在没有道德考虑的情况下进行开发和调整选择。此外,由于所有步骤均在体外进行,因此可以严格控制条件。这允许开发强大的差异选择并鉴定构象特异性抗体。这还允许直接筛选针对特异性存在于特定细胞类型表面的抗原的抗体。这种差异选择将是在肿瘤或受感染细胞表面鉴定新抗原的有效方法。这样的抗体也可以代表用于在人类病理学中对靶细胞进行诊断和治疗应用的有力工具。例如,在使用Fc结构域的二聚化之后,hs2dAb抗体可以用于靶向肿瘤细胞并且例如受益于抗体依赖性细胞介导的细胞毒性(ADCC)。它们也可以直接用作最小的抗体衍生结构域,作为激动剂或拮抗剂裸露,也可以增强毒性。类似地,可以使用放射性化合物(例如99mTc,111In,64Cu)标记它,并使用正电子发射断层扫描术对患者的肿瘤成像。总而言之,NaLi-H1文库可以加快对人类临床应用中使用的新型有效工具的鉴定。
我们定义的合成支架是基于一组能够在细菌胞质中正确折叠的VHH的选择。目标不仅是要定义一个robust而无需聚集的高效支架,而且要经常选择功能性体内抗体。已经从各种抗体文库中分离出了体内抗体(Nizak等,2003a; Rothbauer等,2006; Tanaka和Rabbitts,2010; Vercruysse等,2010)以及其他蛋白质支架,如Darpin(Tamaskovic等,2010)。 2012)或不含半胱氨酸的FN3(Koide et al。,2012)。 NaLi-H1文库的一个独特功能是它基于人源化的纳米抗体状robust支架,在还原环境中稳定,同时仍包含两个典型的半胱氨酸残基。以前曾报道过稳定的纳米抗体,人单结构域支架(Christ等,2007; Saerens等,2005)和文库(Goldman等,2006; Mandrup等,2013)。然而,据我们所知,在基于这种稳定的支架之前,尚未开发出产生高频功能性抗体的合成文库。我们在哺乳动物细胞质溶胶中表达的几乎所有hs2dAb抗体都没有聚集迹象,这进一步支持了我们设计的合成支架robust且高度抗还原的想法。先前的研究表明,功能性体内抗体鉴定通常依赖于蛋白质-蛋白质相互作用报告系统(例如PCA(Koch等人,2006)或细菌2杂种(Pellis等人,2012),酵母IACT(Tanaka)等其他选择步骤。和Rabbitts,2010)或F2H分析(Zolghadr等,2008)。使用NaLi-H1文库,我们观察到不使用特定的选择方案,就可以频繁获得功能性抗体。尽管我们没有正式将NaLi-H1文库与先前的美洲驼或半合成文库进行正式比较,但将选定的hs2dAb的功能与亚纳摩尔亲和力体内的GFP4纳米抗体进行了比较(GFP,纳米抗体,Caussinus等, 2011; Kirchhofer等,2010)。我们通过监测其信噪比(signal-to-noise ratio )并将其用于蛋白质敲低分析法观察到,NaLi-H1可以提供功能强大的hs2dAb,其表现与免疫文库的体内抗体一样好。
体内抗体可用于多种应用,例如跟踪内源性蛋白质的细胞内动力学(Nizak等,2003a,2003b; Rothbauer等,2006),但最吸引人的应用是将它们用于活细胞中快速的蛋白质灭活。体内抗体可用于直接阻断细胞中的靶蛋白。所选择的一种构象敏感抗体可用于抑制活细胞中的活性RHO GTPase信号传导,并且具有与C3外切酶毒素一样强大的功能。仅有少数体内抗体被描述为蛋白活性的内在抑制剂(Haque等人,2011; Vercruysse等人,2010),我们的结果表明NaLi-H1文库可以快速选择抑制性抗体。下一个挑战是选择专门针对密切相关的RHO亚型(RHOA / B / C)的特定成员的构象传感器,该亚型在一级序列中具有超过90%的相似性。但是无论如何,我们的结果表明,NaLi-H1文库可以选择有效的,构象特异性的抑制性抗体。
体内抗体可用于灭活活细胞中靶标的另一种方法是将体内融合到显性抑制域上。遵循Affolter和同事提出的想法(Caussinus等人,2011),我们在这里表明,可以将从NaLi-H1文库中选择的体内抗体融合到蛋白酶体靶向域上,以强行降解各自的靶标。使用抗EGFP hs2dAb验证了这种蛋白质干扰方法,我们相信该方法将带来破坏性工具,从而在细胞培养和动物体内产生快速的蛋白敲低。
总而言之,我们设计了一种具有更高稳定性的新型纳米抗体支架,并创建了一个高度多样化的文库NaLi-H1文库,该文库已成功筛选出可识别针对多种靶标的高功能结合剂。我们相信,该文库将允许快速,完全体外地鉴定可用于基础和医学应用的免疫学工具。
问题
- CDR1 和CDR2为啥定义7个氨基酸残基呢?
- CDR3定义不同长度,考虑的是结合的共享更大?
- 设计的序列可以下载么?
- 不同CDR氨基酸的倾向性的结果在哪看
参考资料
- Moutel et al. eLife 2016;5:e16228. DOI: 10.7554/eLife.16228. NaLi-H1: A universal synthetic library of humanized nanobodies providing highly functional antibodies and intrabodies. 网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4985285/
