【2.7.2】Nanobodies综述(HCAb,Nb,sdAb,VHH)
骆驼科动物的血清同时含有常规的异四聚体抗体和独特的功能性重(H)链抗体(HCAb)。这些同二聚体抗体的H链由一个抗原结合结构域,VHH和两个恒定结构域组成。由于第一恒定结构域的缺失和VHH侧的重塑表面(通常与常规抗体中的L链相关),HCAb不能掺入轻(L)链。已经鉴定了构成HCAb的遗传元件,但是仍在很大程度上对将这些抗体从其专用基因体内生成为抗原特异性和亲和力成熟的真正抗体进行研究。然而,由多个晶体结构支持的抗原特异性VHH的简便鉴定及其有益的生化和经济特性(大小,亲和力,特异性,稳定性,生产成本)鼓励了将这些单域抗体用作研究工具以及生物技术和医学的抗体工程化。
一、前言
由两条相同的重(H)链和两条相同的轻(L)链多肽组装而成的免疫球蛋白-γ(IgG)抗体的整体结构已在哺乳动物中得到了很好的确立和高度保守(图1)(1)。 这些免疫球蛋白的L链包含两个结构域,而H链折叠成四个结构域。 H和L多肽链的N末端结构域的序列在抗体之间变化(称为可变结构域,即VH和VL)。 配对的VH-VL结构域构成识别抗原的可变片段(Fv)。 其余的H和L序列更为保守(分别缩写为CH和CL)。 最后两个CH区域对于募集免疫细胞(例如巨噬细胞和天然杀伤细胞)或效应子功能(例如补体激活)很重要。
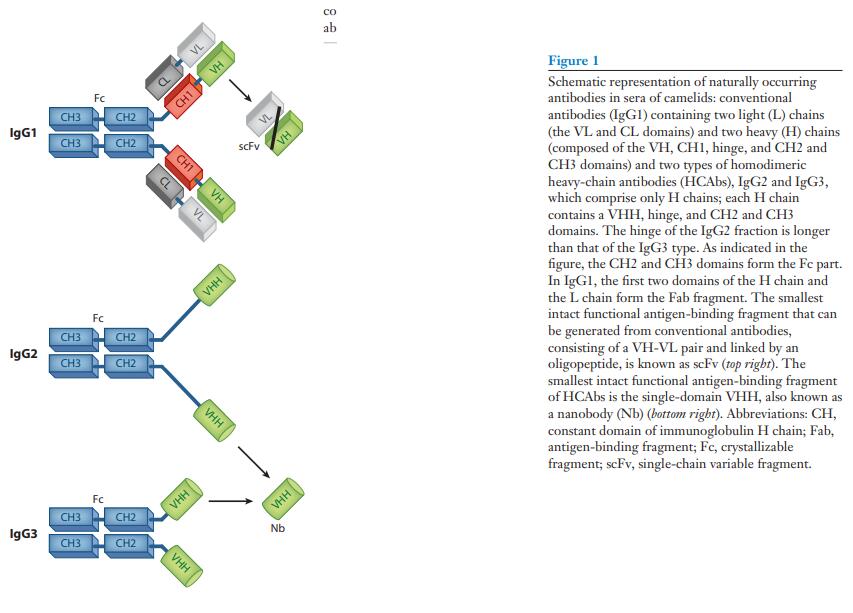
在骆驼科(2)的血清中发现了这种常规哺乳动物IgG结构的一个典型的例外。 除了常规的异四聚体抗体外,这些血清还具有特殊的IgG抗体。 IgG抗体被称为重链抗体(HCAb),不含L链多肽,并且由于缺乏第一个恒定域(CH1)而具有独特性(图1)。 同型二聚体蛋白的H链在其N端区域包含一个专用可变域,称为VHH,用于与其同源抗原缔合。 HCAb中的VHH与常规抗体的Fab片段(抗原结合片段)的结构和功能等效(图1)。
骆驼科生物家族包括:
- 骆驼(camels):驼峰骆驼和驼峰骆驼(one-humped Camelus dromedarius and two-humped Camelus bactrianus)
- 羊驼(llama ):美洲驼和骆驼鸟(Lama glama and Lama guanicoe)
- 骆马(vicugna ):骆驼属骆马和骆驼科(Vicugna vicugna and Vicugna pacos)
骆驼科是亚足类亚目( suborder Tylopoda)中唯一的现存家族,与反刍动物(Ruminantia )(牛,山羊,绵羊,羚羊及其他)和Soiformes(猪和河马科)一起构成木偶目( Artiodactyla)。尽管所有骆驼科动物的血清中均含有HCAb,但其他偶蹄动物(如Suiformes和Ruminantia)却没有这种功能性HCAb。然而,据报道,由VH和CH1区域的重要部分的基因缺失导致的HCAbs发生在患有病理性疾病的人类血清中(3,4)或在小鼠杂交瘤中(5)。由于截短的VH区和VL的缺失,这些HCAb在抗原结合中不起作用。引人注目的是,缺乏L链且缺乏常规CH1的免疫球蛋白也出现在哺乳鲨,沃伯贡(wobbegong)和可能发现的斑尾鱼( spotted ratfish)中(6)。这些Ig-NAR祖先抗体具有可变区,称为V-NAR,用于抗原识别。尽管Ig-NAR和骆驼HCAb的可变(V)序列非常不同,但它们显示出令人惊讶的结构和功能趋同进化(7)。
HCAb 的抗原结合片段包含一个单一可变结构域,可在对骆驼科动物进行免疫,克隆血液中循环的B细胞的VHH组成以及通过噬菌体展示淘选后,直接鉴定抗原结合的VHH(8)。 尺寸在纳米范围内的重组抗原特异性单结构域VHH也称为纳米抗体(Nb)或单结构域抗体(sdAb)。 在这篇综述中,我们总结了HCAbs和VHH结构域的主要结构特征,并提供了骆驼科中HCAbs可能产生机制的更新。 最后,我们回顾了Nbs的生化特性,这些Nbs构成了研究,生物技术和医学中各种常规应用和创新应用的基础。 铁汉 18:16:53
二、重链抗体和纳米抗体的结构特征
2.1 骆驼科动物血清中的重链抗体亚型
IgG中L链的缺失和H链中CH1的缺失是骆驼类HCAb的关键特征。 因此,其较小的分子重量为90,000,而不是常规抗体的150,000,而且其结构更为紧凑,可能更适合进入隐蔽靶标。 相反,尽管有人推测包含Pro-Gln重复序列的长IgG2长链可能形成结构上取代CH1区的延伸间隔子,但一个HCAb中两个互补位之间的较短距离可能会损害其交联抗原的能力。 (图1)
HCAbs和常规IgG在骆驼科动物血清中的百分比是可变的:在骆驼(camels)中,它可能达到50–80%,而在南美骆驼科动物(South American camelid species)中,它总计高达10–25%(9)。如此高的比例证明了HCAb在骆驼科动物的免疫保护中的重要性。
骆驼科动物的血液中循环着几种没有L链的IgG亚型,尽管由于将亚型纯化为同质性以及将亚型与同种型区分开来的困难,确切的数量仍存在争议。然而,同二聚体和异四聚体抗体很容易通过蛋白质G和蛋白质A的差分亲和色谱分离,其中常规抗体在较低的pH值下从蛋白质G柱上洗脱(2,10)。未保留在蛋白G上的单峰IgG组分被吸附在蛋白A上,仔细的pH控制洗脱可得到两个不同的HCAb-IgG2组分,分别为IgG2a和IgG2b(10)。研究人员表明,这些吸附剂的馏分可能仍含有几种亚型。针对不同蛋白A / G组分的IgG产生的单克隆抗体用于筛选美洲驼血清免疫球蛋白,证实了常规IgG的两种同种型以及IgG2和IgG3组分中分别存在三种和两种亚型(11,12, 13)。
对单峰骆驼B淋巴细胞的IgG cDNA的分析揭示了常规抗体存在两种IgG亚型,而HCAbs包含多种IgG亚型(14)。 各种cDNA序列仍需要与从蛋白A和蛋白G色谱或抗同型单克隆抗体获得的亚型(或同种型)匹配。 尽管不确定骆驼科动物血液中循环的IgG亚型的确切数目,但该数目仍在其他artiodactyls的IgG范围内。 已从牛中鉴定出三种IgG同种型(15),而猪含有无法通过蛋白A和/或蛋白G色谱法分离的六种IgG同种型(16)。
人类和小鼠抗体的研究表明,IgG亚型之间存在明显的分工。 尽管还尚不清楚各种骆驼科动物IgG亚型的确切作用和功能的知识,但受感染或接种疫苗的动物会在这三种同种型组分中引起免疫反应(不同动物在不同程度上,取决于实际的免疫原)。 值得注意的是,美洲驼IgG1和IgG3中和了西尼罗河病毒,而IgG2在这方面似乎不太有效(17)。 但是,同一项研究表明,来自所有三种同种型的IgG均与单核细胞和巨噬细胞的表面结合,表明它们能够募集免疫细胞。
2.2 VHH的结构
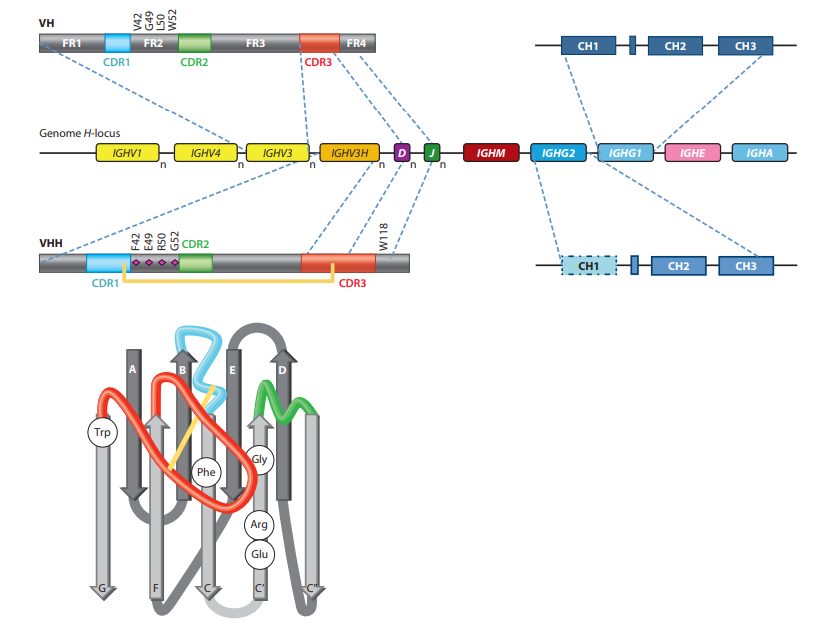
V域内的序列变异性位于三个更易变的框架(FR)区域包围的三个高变(HV)区域中(图2)(1)。折叠的V结构域包含九个β链(ABCC'-C” -DEFG),它们以四链β-折叠和五链β-折叠组织,通过环和通过Cys23和Cys94之间的保守二硫键连接,与保守的Trp相对。在此体系结构中,HV区位于分别连接BC,C'-C'‘和FG链的环H1至H3中,并且聚簇在域的N末端,形成连续表面与表位表面互补,因此命名为互补决定区(CDR)。尽管loop中的顺序为HV,但长度变化不受H3 loop的限制。令人惊讶的是,H1和H2 loop中的Cα位置占据限制性位置。显然,在人或小鼠的VH结构中仅观察到少数所谓的规范环结构,甚至loop结构组合的数量也受到限制(18)。因此,loop长度和loop中关键残基的存在可预测其实际架构。在常规抗体中,VH的三个HV环与VL的三个HV环并置,并提供约600–900Å2的平台(确切的相互作用表面取决于环的大小及其氨基酸,如以及用于计算的算法)。总体而言,常规抗体的互补位形成空腔,凹槽或平坦表面(突出了单个氨基酸侧链的微小起伏),这些结构已与识别小分子,线性肽和较大的抗原( (例如蛋白质)(19)。

-
VHH氨基酸序列的比对立即表明FR和HV区的结构组织类似于VH,在构架2(FR2)和CDR中有一些显着差异。 在FR2中,通常参与与VL结构域(20)相互作用的高度保守的疏水氨基酸(Val47,Gly49,Leu50,Trp52)在VHH中被较小和/或亲水的氨基酸(主要是Phe42,Glu49,Arg50,Gly52)取代(图2)(21、22、23、24)。重塑结构域的该VL侧可消除任何VL相互作用,并在不存在VL的情况下帮助该结构域的非粘性。确实,已经显示出缺少VL伴侣的小鼠VH是粘性的,而FR2的替代模仿骆驼科动物VHH的氨基酸使骆驼科结构域更可溶(25)。相反,在VHH中这些位置上的氨基酸取代以模仿人VH导致人源化VHH的二聚化,其中一个人源化VHH在结构上取代了VL结构域,就像常规抗体中的VH-VL配对一样(26) 。然而,在实际的二聚化基序中观察到较小的偏差(27)。值得注意的是,为了从单链可变片段(scFv)改造VH的自主V结构域,将突变引入人VH的前VL端,并筛选出最佳解决方案(就表达,单体状态和热稳定性)(28)。最佳取代的氨基酸位置和性质与骆驼科动物VHH进化的性质相同但不相同。这一发现表明,自然界从多种可能性中选择一种来形成自主运行的VHH。尽管V-NAR和VHH序列非常多样化,但在结构域VL侧极性残基和带电残基的频率增加,支持了这两个单个抗原结合结构域之间该区域的收敛进化(29)。
-
在HV loop中观察到VH和VHH之间的第二个区别:因为HCAb中的VHH自主起作用(独立于VL的存在,如常规抗体所示),所以抗原只能被三个 loop而不是六个 loop识别。为了提供足够大的600–800Å2(30)的抗原相互作用表面,VHH中的环要比常规抗体的VH长。从序列比对可以明显看出这一点,该序列比对表明H1环中的HV区域扩大,并且存在扩展的H3环(图2)(31)。扩大的HV环1起源于种系基因,而更长的H3环可能是由于V-D-J重组后选择了功能性VHH结构域。扩展的循环意味着更大的灵活性,并且这在绑定方面预期会适得其反。通过用二硫键约束长环解决了骆驼VHH中的问题(32)。的确,许多骆驼VHH序列在H1和H3环中包含一对额外的Cys残基,已知它们会形成环间二硫键(图2),显然限制了在不存在抗原的情况下环的柔韧性。出乎意料的是,在骆驼VHH中,这种额外的二硫键发生的频率较低,但平均而言,骆驼中的H3环也比单峰骆驼VHH短(22、23、24)。单峰VHH中的环间二硫键主要在H1和H3环之间形成;但是,在少量(约10%)的VHH中,在H3和FR2 50位之间也观察到了二硫键。此外,鲨鱼V-NAR进化为具有等价的二硫键,将抗原结合环束缚在一起(33, 34)。在美洲驼VHH中,以及在单峰VHH中偶发地,我们注意到H3环和H2环之间的环间二硫键(位置55)(22、23)。尽管H1 loop中Cys的位置限制在位置30、32或33(FR2中的位置50,H2中的位置55),但在H3 loop中,Cys几乎发生在N端的所有可能位置,H3循环的中间或C端(14)。 在有限数量的VHH中,H3环具有从结构域其余部分延伸的延伸构象(与常规抗体的VH一样)。主要是在VHH在第42位具有Tyr且比通常的H3环长度短时观察到的,如在绿色荧光蛋白(GFP)粘合剂中一样(35)。在带有Phe42的VHH中,长H3环采用特定的构型,称为延伸的扭曲匝,从而使环的基部扭曲,并且末端朝C’链折叠(从C端算起的第7或第8个氨基酸) H3环的“α”接近52位的FR2氨基酸,特别是当它是Gly时(36)。在这种H3配置中,Phe42被H3 loop屏蔽(避免与水接触)(图2)。由Trp118(FR4),Tyr93(FR3)和Phe117或Tyr117形成的芳香核可能稳定了这种H3环构象。
VHH结构域的扁长(橄榄球球形)结构形成凸的互补位表面,这使其非常适合插入抗原表面的腔中(30)。这种相互作用增加了互补位的实际相互作用表面。长的H3序列可以形成一个突出的环[如cAb-Lys3(37)中所示;然而,这似乎是特例,大多数Nb结构中的长环在FR2区域折叠,形成平坦的对位表面(38)。就像在HV4区(D-E链之间的环)积极参与抗原识别的V-NAR中一样,VHH中的该环通常也靠近抗原。尽管结构域中该位置的可变性有所提高,但其参与抗原结合的能力却相当有限。相反,扩展的H1环N端的氨基酸通常高度参与抗原识别(39)。总体而言,对位构架形成各种结构,范围从与V-NAR共享的突出环(33、37)到平坦表面(38),以及从反半抗原结合剂(40、41)看到的空腔。 铁汉 18:17:02
三、专用重链抗体基因 DEDICATED HEAVY-CHAIN ANTIBODY GENES
3.1 骆驼基因组中H基因座的组织
人类和小鼠的H基因位点在恒定免疫球蛋白基因IGHM,IGHD,IGHG,IGHE和IGHA的上游包含多个V元素,D元素和JH元素的顺序组织,尽管每个单倍体可以每个基因的可变拷贝数被发现在不同的动物中(42)。同样,产生常规抗体和HCAb H链的元件位于骆驼科动物基因组的同一基因座中(图2)(8、43)。很明显,单峰骆驼和羊驼使用专门的IGHG基因来产生HCAb。因此,某些IGHG基因专门用于常规抗体,而另一组IGHG基因将产生HCAb(44、45)。与常规抗体的IGHG基因相比,这些基因具有相同的外显子,内含子,开关区域和产生分泌和膜结合IgG分子的聚腺苷酸化位点的相同组织。 CH1外显子的核苷酸序列被嵌入;但是,它们携带一个核苷酸G-to-A点突变,该突变破坏了CH1铰链外显子之间内含子5’末端的共有剪接位点(GT),并通过剪接从mRNA中消除了CH1区域。 。最有可能的是,这种独特的剪接不需要骆驼特异性因子,因为单峰骆驼IGHG2a基因与上游启动子和重排的VHH-DJ基因片段互补并被引入到NSO小鼠细胞系或转基因小鼠中是适当的分别在培养上清液或血清中剪接并生成功能性HCAb(46,47)。相反,在人IGHG2和IGHG3基因中具有单峰骆驼特异性CH1突变的转基因小鼠不能产生功能性HCAb(48)。如果从相同基因中删除了整个CH1外显子,则可能产生成功的HCAb。这表明骆驼IGHG基因中CH1外显子/内含子剪接位点周围的核苷酸(未识别)可能对正确的VHH铰链剪接至关重要。对单峰骆驼基因组克隆的分析进一步确定了HCAb推定的IGHG基因的存在,该基因在cDNA序列中从未发现过,并且可能反映了假基因(29)。
羊驼基因组似乎仅包含一个具有功能性CH1剪接位点的IGHM基因(43)。另外,cDNA分析显示具有重排的VH-D-J和具有VHH-D-J区域的mRNA维持CH1外显子序列。
3.2 H基因座中的专用VHH基因 Dedicated VHH Genes in the H Locus
骆驼科动物基因组还具有专用的VHH种系基因(表示为IGHVH),其间散布有常规抗体(称为IGHV)的VH种系基因(图2)(43、49)。 IGHV和IGHVH基因易于区分,因为它们编码FR2的标志性氨基酸。单峰骆驼的基因组包含约50个IGHV和40个IGHVH基因(31),而羊驼编码71个IGHV和17个IGHVH基因(43)。在B细胞淋巴细胞生成过程中,IGHV或IGHVH基因参与V-D-J重排,分别形成VH或VHH结构域。由于D和J基因库对于VH和VHH都是共同的(图2),因此可能令人惊讶的是VHH的H3环(由V-D-J连接形成)平均比VH长。 VHH结构域中较长的CDR3可以用几种方法解释:(a)在V-D-J重排过程中,较高的脱氧核苷酸转移酶活性,但这不太合理,因为它暗示着B细胞的一个独特子集注定会产生HCAb。 (b)在前B细胞受体阶段的选择,是确保V-D-J重排产生适当折叠的V结构域的检查点;或(c)在功能上的选择,其中假设那些具有较短H3环的VHH结构域最有可能具有过小的推定抗原结合表面,这使得此类B细胞不太可能与抗原结合并在此过程中扩增免疫反应。有趣的是,IGHVH基因也不同于IGHV基因,因为在单峰骆驼(31)的CDR1区(或FR2区的50位)或羊驼VHH(43)的Cys55存在Cys密码子。在V-D-J重组期间或之后通过体细胞超突变引入H3环中的第二个Cys密码子。显然,如果VDJ重组产物仅包含一个单Cys(除了保守的Cys23-Cys94对),则B细胞如果无法通过突变Cys密码子替代该Cys或引入第二Cys,则将被反选。密码子在合适的位置形成胱氨酸。实际上,在互补位中存在一个单半胱氨酸可能会导致VHH二聚体(50),从而阻碍抗原结合。
IGHVH基因也以更微妙的方式不同于IGHV基因。显然,IGHVH基因而非IGHV基因通常包含被认为不稳定或易于发生不平等的DNA重组,基因转化或基因置换的奇怪序列(即Ig重组信号序列的回文或七聚体样序列)事件(31)。据推测,这些元素将导致更快的基因进化,从而导致IGHVH组库的更快扩展(29)。另外,这些元件也可能负责B细胞受体的编辑(通过具有位于上游的IGHVH基因的基因转换机制)。实际上,具有已知抗原特异性并在噬菌体展示后检索的VHH的cDNA序列分析通常会揭示具有相同H3环(相同VDJ重排)以及具有不同H1和/或H2环序列的序列,尽管不能排除这些粘合剂是通过聚合酶链反应(PCR)交叉人工生产的。
在编码H1环的区域中引入了另一个令人惊讶且微妙的VHH序列标记(31)。在人和小鼠的VH序列中,这个桥接V域两个β折叠的环在第25、27、28、30和39位含有保守的氨基酸。这些氨基酸(Ala,Gly,Phe,Phe,和Met)分别被认为是1型规范环结构的关键氨基酸(51)。在VHH种系基因中,它们具有一个显着的差异,即Phe28和Phe30(TTT和TTC密码子)被Tyr密码子(TAT和TAC)取代。据报道,TAY基本步骤是体细胞超突变的热点(即更倾向于多样化),实际上,这些密码子经常在亲和力成熟的VHH域中发生突变(31、43)。此外,这种密码子诱变是H1环中的HV区向N端环区延伸的主要贡献者,并且H1环结构经常偏离在人或小鼠VH中观察到的已知规范结构(52)。 。
3.3 混杂的VH基因有助于VHH曲目 Promiscuous VH Genes Contribute to the VHH Repertoire
由两个结构域形成的抗原结合位点,首先通过V-(D-)J基因重组独立组装,然后结合在一起,导致看似无限数量的可能的互补位结构,从而导致基于最小限度的钳工(fitter)免疫系统基因元件的数量。令人惊讶的是,缺乏VH-VL组合多样性的HCAb可以与常规抗体竞争。当显示在两个不同的单峰骆驼中饲养的两个VHHs(在摩洛哥和阿拉伯联合酋长国,在不同的时间用相同的抗原免疫)是由不同的IGHVH基因和不同的J小基因组装而成的,但具有相同的D元素时,VHH paratope 的结构库甚至比最初预期的要严格得多。另外,显示了由两个VHH中的D元素编码的环区采用相同的结构并且与相同的表位相互作用。然而,J和V基因元素显然经历了收敛的体细胞超突变。这一发现强调了在这些抗体的亲和力成熟过程中体细胞超突变和选择的强度和重要性。
可用的VH(或VL)家族的数量是可能的互补位多样性的另一个原因。<font color=‘red> 直到几年前,据报道所有IGHVH都属于IGHV3家族,这是人和小鼠基因组中最丰富和广泛的家族,并用于最通用的功能性抗体(18)。 然而,最近在羊驼中发现了IGHV1和IGHV4(家族II)的VH种系的出现(43)。 据报道这些基因产生常规抗体的VH结构域。 IGHV4基因也存在于单峰骆驼中,这些V元素令人惊讶地混杂在一起,因为它们可以产生VH结构域和VHH结构域,这是在没有VL伴侣的情况下在HCAb中的抗原结合中起作用的自治结构域(54)。 这些带有IGHV4印记的VH样单域在其FR3中具有略低的疏水性。
同样,还发现IGHV3基因(在FR2中具有疏水性GLEW基序)可产生HCAb(无CH1结构域)。因此,骆驼科动物中具有GLEW基序的IGHV3基因也可能是混杂的,并可能在V-D-J重排和表达后与常规抗体中的VL配对或在HCAb中自主地表达。实际上,已经从HCAb文库中反复分离出具有GLEW基序的多个抗原结合VH样结构域。有时,这些VH样结构域显然具有序列标记,可防止与可能的VL结合,因为它们缺少保守的Trp118。 Trp118由J元素编码(图2),在人和小鼠VH中100%保守,并且强烈参与VH-VL相互作用(20)。但是,在骆驼科动物的DJ重排以及伴随的核苷酸插入/缺失过程中,删除5’J序列可能会截断Trp密码子(TGG),因此该密码子变成了AGG,CGG或GGG密码子(如果仅删除T)。在这些情况的三分之二中,Trp被Arg(一次被Gly)取代,并且在骆驼科VHH(属于HCAb)中经常观察到这种突变。与是否使用VH或VHH种系无关,Arg(而不是Trp)的存在无疑会阻止与VL的正确结合。在没有HCAb IGHG基因的人或小鼠(或其他哺乳动物,骆驼科动物除外)中,从未观察到带有Arg118的VH,因为具有这种突变的B细胞可能在B细胞淋巴细胞生成过程中无法存活。
3.4 重链抗体个体发育 Heavy-Chain Antibody Ontogeny
HCAb格式的IgM阶段的出现是另一个谜。实际上,我们不知道如果在前B细胞中重新排列IGHVH基因,则如何从IgM切换到IgG。我们最好的猜测和当前的工作假设是,重新排列的IGHVH-DJ(或IGHV-DJ *,其中J *表示保守的Trp118密码子已被修饰)可能无法在pre-B细胞的表面上表达与替代的L链结合,形成VpreB和λ5的二聚体(55)。通常,在B前细胞中,建议在IGHVH-DJ重排后,VHH-IGMH翻译产物的未折叠CH1与BiP蛋白结合并保留在内质网中(56)。通过替代的L链(其中L5在重新排列L链之前,λ5充当CL,VpreB充当VL)进行交换,以用于H链的表面表达和前B细胞受体信号传导。 VpreB无法与VH结构域结合会干扰前B细胞受体及其信号的正确暴露,导致B细胞迅速消失(57),尽管可能存在逃逸途径。在前B细胞受体表面表达受阻的细胞通常被消融的情况下,在骆驼科动物中,可以通过立即将其从IGHM切换到HCAb专用IGHG基因之一来拯救它们。支持这种个体发育的迹象来自于(a)始终在完整的CH1外显子上观察到IGHVH-DJ与IGHM结合的转录本的事实,(b)IGHVH-DJ的比例极低(小于5%)与具有IGHM的IGHV-DJ相比,(c)与IGHM共表达时,IGHVH中不存在体细胞突变(43)。 铁汉 18:17:15
四、纳米生物化学特性
4.1 抗原特异性纳米抗体的鉴定
Nbs是骆驼类HCAbs的重组单可变结构域,通常在短暂免疫后即可轻松获得,然后从外周血淋巴细胞克隆V基因库,并通过噬菌体展示进行选择(58)。抗原特异性HCAb在短时间的免疫步骤中就已亲和力成熟,主要以蛋白质为免疫原,但也可以通过DNA初次免疫,蛋白质增强策略来获得抗体(59)。由于HCAb的整个抗原结合片段均由一个VHH结构域组成,仅由一个〜360 bp的基因片段编码,可通过PCR在一个单一的扩增子中轻松扩增,因此〜106个单独转化子的小文库已经可以代表免疫血液样本中约50 ml的B细胞的VHH成分。如果无法进行免疫接种(即没有可用的,有毒的或无免疫原性的分子),则可用天然,半合成或合成的V库(60、61)代替免疫VHH库,但此类库必须更大(约109个单独的克隆),以便检索高亲和力的结合物。
通过噬菌体展示或任何其他选择方案(包括细菌展示,酵母展示,细胞内2杂种选择(62、63),核糖体展示(64)等)从免疫库或其他库中检索抗原特异性Nb。但是,由于该技术的鲁棒性,克隆的V文库优选在噬菌体上表达并淘选在通过被动吸附固定在微量滴定板孔中的抗原上淘选,或者当抗原被链霉亲和素包被的固体支持物生物素化时( 65)。通常,两到三轮淘选足以富集克隆,以便可以在标准酶联免疫吸附测定(ELISA)中筛选单个克隆以生产抗原特异性Nb。 ELISA阳性克隆的核苷酸测序可用于推断Nb的氨基酸序列。鉴定有用的抗原结合剂的整个过程很快,因为可以在不到两个月的时间内使用多种免疫原甚至蛋白质组片段来免疫一只动物(66、67)。以此方式,免疫文库可用于并行选择各种抗原的结合物。因此,一位研究者每年可以鉴定出针对数百种抗原的Nb。
4.2 纳米抗体的亲和力参数 Affinity Parameters of Nanobodies
与scFv的克隆相反,在B细胞中亲和力成熟的VH和VL对由于随机组装的VH外显子和VL外显子的随机组装而变得混乱,这些VH外显子和VL外显子首先分别进行PCR扩增,存在PCR扩增和VHH克隆一个外显子中的一个允许整体从外周B淋巴细胞克隆完整,亲和力成熟的VHH。因此,来自免疫文库的Nb的抗原特异性和亲和力具有良好的质量。常规地获得分别在10^5至10^6 M^-1s^-1和10^-2至10^-4 s^-1范围内的动力学kon和koff速率常数,从而获得低纳摩尔或什至皮摩尔的平衡解离常数。这样的亲和力参数对于大多数应用程序都是极好的。然而,已经成功引入了体外亲和力成熟方法,如易错PCR,掺入突变诱变和核糖体展示(68)以及基于Ala扫描的突变以识别用于抗原识别的关键氨基酸,以提高结构域的稳定性。在替代方法中,在互补位的边缘引入了一些精心选择的突变,以测量其对抗原-Nb动力学和平衡亲和力值的影响。这些数据与突变和缓冲液的参数化定量描述子的多变量分析相结合,提出了一种定量预测算法,该算法可以模拟那些位置上所有其他可能突变体的亲和力参数(70)。
4.3 重组纳米抗体的表达 Expression of Recombinant Nanobodies
Nbs在微生物(71、72、73),哺乳动物细胞系和植物(74)中高水平表达。 对于细菌表达,优选在分泌信号后克隆Nb,以便在氧化环境适当形成二硫键的周质中产生Nb。 纯化是直接的,因为Nb通常是用His6标签在框架中克隆的,因此在周质提取(已经避免了细胞质蛋白的重大污染)之后,固定的金属亲和色谱和凝胶过滤可产生纯Nb。 通常从简单的培养瓶中获得每升培养物几毫克的产量。 对于需要不带任何标签的Nb的应用,建议选择与蛋白A结合的Nb。大多数VHH与人VH家族3的成员密切相关,此类蛋白通常保留在该亲和吸附剂上(75)。
4.4 纳米抗体的稳定性 Stability of Nanobodies
通过在标准磷酸盐或Tris缓冲液中进行超滤(使用mol wt截留值<5,000的滤膜)可以很容易地将Nb浓缩至1–10 mg ml-1,用作储备溶液。 Nbs的保质期极佳;它们在4°C下可以保存几个月,在-20°C下甚至可以保存更长的时间,同时保持了完整的抗原结合能力。在37°C下孵育数周似乎也可以耐受(76)。此外,Nbs在严格的条件下很坚固,并且可以抵抗化学和热变性。通常Nbs在约60-80°C时变性约2.3-3.3 M胍(77)。一些Nbs表现出异常稳定的行为,可抵抗90°C以上的温度(78),化学稳定性为60 kJ mol-1(62,77)。 Nb的稳定性可以通过在位置54和78(分别在C'‘和E链上)引入Cys形成额外的二硫键(79、80)来提高。事实证明,这些二硫键稳定的Nbs对胃蛋白酶或胰凝乳蛋白酶的降解具有很高的抵抗力(81),表明此类Nbs可以口服给药。通过DNA改组并选择胰蛋白酶抗性变异体随机诱变后,已获得了口服给药的抗胰蛋白酶Nb(82)。此外,在恶劣条件下(例如在去污剂或变性剂的存在下)用噬菌体展示的VHH进行淘选,并且有迹象表明此类选定的VHH也可抵抗其他变性条件,例如高尿素浓度(83)。还已经利用丝状噬菌体的高温和酸耐受性来选择在返回生理条件时具有增强的抗性或可逆重折叠能力的sdAb(84,85)。
由于Nb序列(VHH家族3)非常保守,因此已成功地使用一些高度稳定的Nbs支架移植了较不稳定的抗原特异性Nbs的抗原结合环,从而获得了具有环稳定性的嵌合Nb 受体Nb和环供体Nb的抗原特异性(86)。 但是,这种策略并不总是可行的,因为Nb的稳定性主要取决于CDR3序列(87)。 因此,嫁接CDR3环也将转移其固有的稳定性。 另外,由于CDR3氨基酸与抗原直接接触或维持并影响直接与抗原接触的CDR3氨基酸的构象,导致稳定性降低的CDR3氨基酸不能在不严重丧失亲和力的情况下被替换。 (88)。
4.5 纳米抗体是非免疫原性的 Nanobodies Are Nonimmunogenic
体积小,行为稳定,从血液中快速清除以及与人VH具有高度同一性的序列都是可预测Nb免疫原性低的特性。 实际上,在注射了含Nb的构建体的小鼠或人类中,没有产生针对Nb部分的免疫反应(89、90、91)。 此外,还开发了一种策略,可将人VH和骆驼科VHH之间的14种氨基酸中的12种人源化(92)。
4.6 纳米抗体和多价和/或多特异性构建体对独特表位的识别
sdAb的独特(凸,convex)paratope 结构更倾向于与sdAb抗原的凹表面(例如酶的活性位点)结合。因此,许多Nb会影响酶的催化活性也就不足为奇了(10,93,94,95)。在某些Nb明显充当变构抑制剂的情况下(96,97),其他Nb则可能激活酶的活性(98),因为它们将酶稳定在开放构象中。
Nb的严格单体行为与其最小尺寸相结合,使其成为开发多域结构的理想构件(99)。已经鉴定出几种二聚体Nb构建体:
- (a)二价单特异性构建体,通过该双价单特异性构建体,串联克隆的相同Nb的产物增加了对抗原的功能亲和力(亲和力);
- (b)通过串联克隆识别同一抗原上不同表位的两个Nb而获得的双对位(biparatopic),单特异性构建体(monospecific construct),这可能螯合该抗原并以更高的亲和力结合(100);
- (c)通过形成一对Nb串联形成的双特异性构建体,每个Nb识别不同的抗原,该过程用于束缚两个独立的抗原(101,102)。
在另一种方法中,将Nb克隆到具有自然二聚或多聚趋势的蛋白质部分,例如亮氨酸拉链基序或维毒素的五聚基序(103、104)。此外,已将抗原特异性Nb基因与人,小鼠或猪IgG的铰链,CH2和CH3外显子按框克隆,随后转染到骨髓瘤细胞系中以重建嵌合HCAb(104、105)。 铁汉 18:17:22
五、纳米抗体的应用 APPLICATIONS WITH NANOBODIES
可再生(或可持续)来源,经济生产,体积小,人为序列,水溶液中稳定和可溶的行为,可逆的可折叠性以及对一个同源目标的特异性和高亲和力是实用粘合剂的理想特性。通常,从免疫文库中选择的Nb可以满足所有这些要求,而无需其他改进。 Nbs可能会识别传统抗体非抗原性的抗原决定簇,并且其中许多抗原调节靶标的功能,这是补充资产。显然,这些有益的特性刺激了大学,制药和生物技术公司中的几个研究小组采用Nbs作为研究工具和/或开发未来的诊断和治疗应用。这导致了许多应用,从而成功地证明了原理证明。这些应用程序最近已在其他地方介绍(106、107、108)。在这里,我们集中于许多示例,其中Nb提供了优于其他等效粘合剂(binders )的特殊优势,并且Nb超过了“我也可以”(me-too)的资格。
5 .1 纳米抗体作为研究工具 Nanobodies as Research Tools
利用Nb鉴定技术可快速检索各种靶标的高亲和力结合剂,从而可为重要靶标(包括细胞内信号分子和癌症生物标记物)组装全面表征的试剂,作为后基因组时代的多功能工具(109) 。
荧光蛋白与Nb的遗传融合及其在细胞内的表达会产生有用的染色体抗体或荧光抗体,以在活细胞的各个细胞区室中追踪抗原(110、111)。此外,在任何带有GFP标记的构建体上,将GFP结合Nb与有机染料偶联使用,可通过超分辨率成像技术实现单分子定位(112)。 Nb对靶标特定构象变异的特异性及其诱导和报告构象变化的能力已被用于通过比例成像靶蛋白表达,其易位和最终亚细胞定位来进行监测(35、113、114、115)。在平行研究中,已经证实细胞内表达的sdAb保持可溶并显示出特定的抗原识别活性,从而消除了细胞内抗原的特定蛋白质功能。与正常原位蛋白相互作用的竞争性sdAbs的鉴定,为靶标验证提供了工具,并为研究困难的相互作用或被认为不可药物相互作用的先导分子提供了线索(116、117)。
除了阻断靶蛋白的表面以干扰适当的蛋白-蛋白相互作用外,还可以通过遍在蛋白途径触发抗原的消耗。通过在果蝇和Danio rerio模型中通过融合到F-box域的GFP特异性Nb的胞内表达来证明这一概念,以募集多泛素化机制并启动蛋白酶体介导的靶标降解,该靶标被泛素化的Nb捕获复杂(118)。
几年前,人们提出了抗体来辅助柔性或聚集的“高挂水果”(high-hanging fruit)蛋白的结晶过程和结构测定。除了少数几个孤立的案例,由于重组单域亲和试剂的可用性,直到现在才取得了快速进展。这些亲和试剂通过屏蔽疏水性抗原表面使其不与溶剂接触,从而形成有效的晶体接触,从而将高动态蛋白固定在结合剂偏爱的构象中,并稳定了固有的柔性区域或去污剂增溶的膜蛋白。再次,它是对抗原特异性Nb的快速鉴定以及高产量,小尺寸,坚固的结构和抗原表面的靶向裂口(通常与活性酶促位点或配体或受体结合相吻合)腔),使Nb能够解决这些具有挑战性的靶标(120、121、122、123)的结晶和结构确定。
5.2 纳米抗体作为诊断工具
用于定量检测或简单捕获其靶标的Nb的开发出奇地缓慢。 常规抗体的较大尺寸可能更适合随机偶联至固体表面。 但是,易于修饰的高亲和力Nb可以避免在对位附近产生化学反应性基团(主要是来自赖氨酸的胺),并且在域的另一端包含此类基团,可以将它们定向固定在传感器上 表面以获得最大的抗原捕获能力。 这允许使用Nb生成敏感的选择性生物传感器(124)。
在另一种情况下,将Nbs化学键合到分支的金纳米颗粒上,以在近生物学窗口中照射激光后产生有效的靶向抗原的光热治疗剂(125)。
Nb基因与磁小体蛋白MamC基因的融合以及在磁铁矿合成的Magnetospirillum gryphiswaldense细菌中的表达提供了一种生产与磁性纳米颗粒直接偶联的Nb的绝妙策略(126),可在复杂混合物中以低浓度捕获和富集分析物。 Nbs与固体,惰性或磁性载体的共价键连接似乎是产生亲和吸附剂的一种非常有价值的方法。通过开发纳米阱,固定的将GFP识别为靶标的Nb(115)和针对各种免疫球蛋白同种型的Nb(127)可以证明这一点。此类亲和吸附剂已分别由ChromoTek GmbH(德国Planegg-Martinsried)和BAC BV(荷兰Naarden)商业化。后者最近向他们的产品组合中引入了标签结合型铌。此Nb特异性识别C端四氨基酸Glu-Pro-Glu-Ala(EPEA)(128),可以将其克隆为任何蛋白质后面的标签。 Nb的体积小,意味着提取物中复杂混合物中的蛋白质很少会识别sdAb,这大大降低了分子的非特异性吸附。
由于Nb的体积小,远低于肾清除极限mol wt〜50,000,因此Nbs会迅速从血液中清除,这正是好的体内成像剂所需要的(129)。快速靶向病变组织和快速血液清除利用短寿命核素(68Ga,18F),其半衰期(t1 / 2)分别为68和110分钟,这使得正电子发射断层扫描和计算机断层扫描成像可用于在注射后1至3小时内测量示踪剂的皮摩尔浓度,因此对患者的辐射负担非常低。最近在具有Nbs的小鼠异种移植物中测试了用68Ga标记的表皮生长因子受体,针对HER-2,乳腺癌抗原(131)和V-CAM1在3小时后(130)产生的肿瘤与血液的比率为25 ,一种用于诊断脆弱的动脉粥样硬化斑块的抗原(132)。
5.3 纳米抗体作为治疗药物 Nanobodies as Therapeutics
抗体已经被用于被动免疫的年龄,以治疗有毒的受害者或感染的患者。尽管多克隆抗体通常可产生更好的中和作用,从而获得更好的保护,但经过筛选以识别参与受体识别的特殊表位的单克隆Nb可以达到极高的中和能力(133)。除了蝎子毒素外,几种抗菌毒素(134)和抗蛇毒Nb也正在积极研究中(135,136,137)。此外,在某些情况下,常规抗体的大尺寸会阻碍病原体(例如病毒,细菌或寄生虫)上隐藏的必需表位的进入;在这种情况下,Nbs将具有治疗方面的特殊优势(138、139、140、141、142、143、144、145、146)。
其他几种源自Nb的疗法(例如,用于治疗炎症性疾病的抗IL6R或抗TNFα,用于治疗急性血栓性血小板减少性紫癜患者的抗von Willebrand因子以及用于对抗骨丢失的抗RANKL疾病等)正在准备中;有些通过了第一阶段和第二阶段的测试(147)。然而,与其他治疗性化合物的竞争是巨大的。 Nb在治疗中的成功将来自对患者更友好的给药(局部,口服或吸入),以及在更长的时间内获得更高的血药水平,以及通过将Nb与白蛋白结合部分,或通过各种方式改变其流体动力学体积(148)。
另外,亲和力成熟的Nb的附加价值来自于它们将同源靶标与密切相关的变种区分开的能力。 大多数小型有机拮抗剂通常无法实现如此高的特异性。 因此,已开发出Nbs来阻止有害的酶活性,例如T细胞胞外ADP核糖基转移酶ART2.2在淋巴器官中的细胞毒性作用(59)。
最后,还评估了Nb将货物运送到难以接近的组织的能力。 为此,产生了穿过血脑屏障或导致跨上皮细胞转胞吞作用的Nb(100、149、150、151)。
六、总结要点
-
已经开发了一种可访问且精简的协议(protocol),用于快速生成几种Nb,这些Nb以高特异性和高亲和力识别其同源抗原。重组Nbs在各种微生物中表达良好,高度耐用,并且易于根据用户的需求或在预期应用中实现最佳性能而易于工程设计。
-
Nb与其抗原复合的多重晶体结构是可用的。这些提供了详细的见解,可支持合理设计的工程来增加Nb的效力。
-
众所周知,Nb更喜欢与抗原表面的空腔相互作用,例如酶的催化位点或受体的配体结合位点。因此,许多Nb对其抗原产生抑制,激动或拮抗作用。
-
可以捕获在不同构象之间快速切换的目标,并将其稳定在Nbs首选的构象中。这导致未知构象的鉴定,并允许详细研究例如酶机制。 Nbs可能稳定否则会不稳定的蛋白质并防止淀粉样变性。
-
Nbs的严格单体行为使其成为包含Nb提供抗原特异性和靶向功能的较大构建体的理想工具。
-
Nbs 似乎是成功的结晶伴侣。几种易于降解,解折叠或聚集的膜蛋白和不稳定蛋白已被Nbs稳定化,并且在过去几年中已经确定了这种高悬垂的水果蛋白的大量晶体结构。
-
放射性标记Nb的技术及其小巧的尺寸(远低于肾切除值)使得它们成为无创体内成像的理想工具。
七、未来的问题
-
用抗原免疫后可引发常规抗体和HCAb。但是,偶尔,HCAb中的响应低得令人失望(例如,小肽和半抗原)。因此,有必要更好地了解佐剂对骆驼科动物免疫系统的影响。此外,将血清中出现的不同HCAb同种型(亚型和同种异型)以及这些亚型中每一个的确切功能和作用的清晰图像清晰描述是非常重要的。
-
骆驼科动物B细胞中功能性HCAb的存在仍然是一个黑匣子。尽管已鉴定出大多数基因,但我们不了解涉及IGHV3H基因的V-D-J重排如何以及为何具有更长的CDR3或如何以及何时以及何时从IGHM切换到IGHG2或IGHG3。此外,任何有关替代L链在B细胞前阶段的参与和作用的信息都将受到欢迎。
-
基于Nb的产品的工具箱需要进一步开发,以进行目标验证和促进尖端科学。我们期望Nb作为高度特异性的捕获剂会有更多的发展。在染色质免疫沉淀中;在细胞内成像中以及细胞内靶标的特异性降解,保留或易位。
-
研究人员需要在表型选择策略的开发中实施Nb,以获得靶标调控Nb。
-
预计将产生Nb,这些Nb可以进入独特的位置,例如那些穿过血脑屏障或可以将货物运送到特定细胞并穿透其细胞膜的位置。通过为慢病毒或腺病毒载体配备Nb,可以实现其中一些目标。
-
预计下一代疗法中将开发Nb及其商业化。
参考资料
- Annual Review of Biochemistry . First published online as a Review in Advance on March 13, 2013. . Nanobodies: Natural Single-Domain Antibodies . 原文链接:https://doi.org/10.1146/annurev-biochem-063011-092449
