【2.7.8】VHH的抗原识别结构范围与约束
单域抗体(sdAb,Single-domain antibodies)是骆驼有蹄类动物和软骨鱼类天然产生的仅重链抗体的自主可变域,已经进化为仅使用三个互补决定区(CDR)环而不是传统的VH:VL抗体六个互补环来结合抗原。已经基于有限的证据表明,sdAb可能采用互补位(paratope )结构,使它们倾向于优先识别隐性(recessed)蛋白质表位,但对隆凸表位和小分子的识别能力差或不能识别。在这里,我们全面调查了支持该假设的证据。我们发现,与传统抗体相比,sdAb的互补位(paratope )形状在全局结构上存在差异:
- sdAb的互补位(paratope)具有较小的分子表面积和直径
- 更常见的是具有非规范的CDR1和CDR2结构
- 并且具有较长的CDR3长度分布
- 但是具有相似的氨基酸组成,
- 并且没有比常规抗体paratope扩展更多的范围(从CDR碱基到末端的原子间距离)。
sdAbs和常规抗体与同源抗原复合物的X射线晶体结构比较表明,sdAbs和常规抗体将溶剂暴露的表面区域掩埋在蛋白质上,并形成相似类型的非共价相互作用,尽管它们在浓缩物中更为集中sdAb互补位。因此,sdAb可能具有特权访问蛋白质上不同的抗原区域,但这仅是由于其小分子大小,而不是由于分子识别机制的普遍差异。关于sdAb不能结合小分子的证据还不清楚。现有数据提供了一个结构框架,用于理解仅自主(autonomous )重链抗体的进化出现和功能。
一、前言
单结构域抗体(sdAb)是仅重链抗体的单体结合结构域,它们通过融合进化至少出现了三遍(在软骨鱼类中两次,在骆驼科中两次,分别大约在220和2500万年前)。 Ward等人首先描述了自主的(autonomous),具有抗原结合能力的sdAb的概念。 在1989年和几年后,在单峰骆驼和nurse鲨中发现了缺乏轻链的天然存在的抗体。这些〜12-15 kDa可变域(分别为VHH和VNAR;图1)抗体可以产生重组,可以在没有抗体重链其余部分的情况下识别抗原。 VHH和VNAR的模块性质已在基于抗体的药物开发中得到了广泛和有效的利用(参见参考文献5)。

对第一个分离的VHHs和VNARs的结构研究[6,7]初步表明,这些分子可能使用不同于常规抗体的机制与抗原相互作用。事后看来,鉴于sdAb可能优先靶向特定类型的抗原结构,这一想法似乎并不完全出乎意料,因为它们是从V,D和J基因的不同组成部分重组而来的(见专栏1),它们可能是来自不同B细胞前体的个体发育,和骆驼科VHHs,它们的特殊恒定区带有很长的铰链区。但是,sdAb抗原识别的特定机制(例如sdAb:抗原界面的三级结构和理化特性,可能与常规抗体:抗原界面)仍然不清楚,尽管一些研究表明蛋白质裂痕识别( protein cleft recognition)是VHHs和VNARs的通用功能。随着时间的流逝,sdAb可以靶向隐秘(cryptic)表位的想法(之所以这么称呼,是因为出于空间原因或由于其基本的抗原特性而无法使用常规抗体)已经根深蒂固,尽管一些案例研究支持了它,它的普遍性和含义值得怀疑。最近的一些优秀评论和意见都提到了sdAb互补位的性质以及它们与抗原的相互作用,但是它们的方法不够严格,或者没有完全解决该主题,仅分析了sdAb互补位的性质,而没有与之比较。 13-17因此,本综述的目的是全面研究全面研究sdAb:抗原相互作用与常规抗体:抗原相互作用是否以及如何区别,以及评估VHH和VNAR在进化方面是否有相同之处。这个问题的答案与sdAb与传统抗体可使用的“druggable”
专栏1(Box 1) sdAb的免疫遗传学
VHHs是仅骆驼科重链抗体的可变域,在B细胞发育过程中会从位于唯一基因座的一组独特的种系V基因以及常见D和J基因(与常规四聚体抗体的VH域共享)重组在染色体4上,大多数骆驼科动物的VHH和VH基因18与人IGHV3-家族基因同源(〜75–90%相同),并在FR2中编码独特的可溶残基(使用IMGT编号,Phe / Tyr42,Glu49,Arg50和Gly 52, 这些位置映射到常规抗体中的VH :VL interface),尽管缺乏这种共识的功能性VHH已被分离出来。一些骆驼科动物的V基因可能会“混杂”地与仅重链和常规抗体恒定区基因重组。VHH域带有与人和鼠类常规抗体相比,CDR3环的长度异常长[21,22],可能反映了非模板核苷酸添加的增加,尽管这可能只是一部分VHH的特征[2]。在某些VHH中,长CDR3环具有双重作用,既可折叠在前VL界面上,又可与同源抗原相互作用。重排的VHH外显子被认为会导致CDR和FR的体细胞超突变率升高(例如,紧接CDR1的FR1编码序列; FR2编码序列可能在构建CDR3环中发挥作用; FR3编码序列,形成可与抗原(有时称为CDR4)接触的β转角。 VHH还可能以比常规抗体更高的速率获得体细胞插入和缺失,并且在某些情况下可能会使用FR3中的隐秘重组信号序列进行继发性重排事件。一些VHH基因编码半胱氨酸残基对之间形成的非规范二硫键( CDR1-CDR3,FR2-CDR3,CDR2-CDR3或CDR3-CDR3;见方框2).VNARs是软骨鱼类Ig新抗原受体的可变域,与T细胞受体和Ig轻链基因有序列同源性。可能是与Ig VH结构域相比,VNARs缺少两条β链(C’和C''),因此CDR2缺失,尽管连接CD和DE链的环(分别为HV2和HV4) 可以与抗原接触。在B细胞发育过程中,VNAR结构域从少数基因位(可能只有3个)重排,这些基因位点不同于编码可在血清中检测到的其他类型的Ig分子(IgM,IgW)的基因座。每个基因座包含一个V基因,两个或三个D基因和一个J基因,因此主要库多样性几乎完全基于CDR3,因为VNAR CDR3环是通过三个或四个独立的重排事件形成的,因此往往很长。 与IgM和IgW的VH结构域不同,VNAR在遇到抗原时主要在CDR1和CDR3中而且在HV2和HV4中引起体细胞超突变。
二、针对折叠蛋白的单域抗体 Single-domain antibodies directed against folded proteins
与常规抗体一样,研究的大部分sdAb都针对折叠蛋白。 折叠蛋白上的某些区域和表位本质上比其他区域具有更高的免疫原性,这一概念被称为免疫优势。 对B细胞免疫优势的免疫机制了解甚少,并且跨物种的免疫优势模式可能不完全保守。
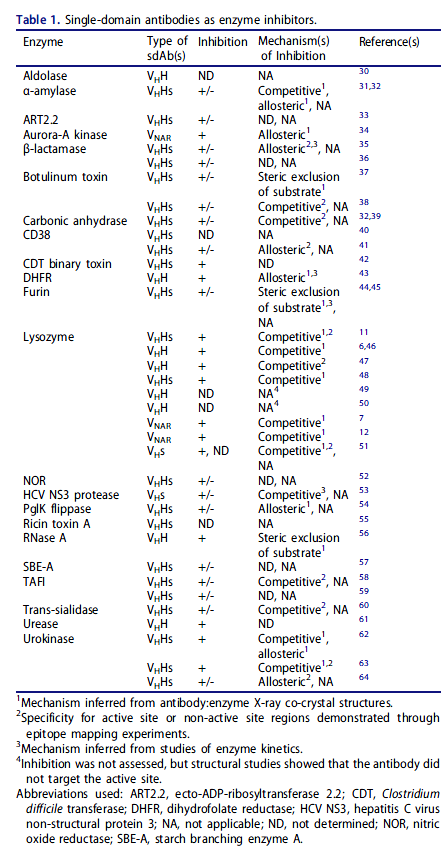
与常规抗体相比,sdAb可能优先靶向不同组表位的第一个迹象来自抗酶sdAb的研究(表1)。常规抗体可以作为酶抑制剂,最常见的是诱导变构构象变化或通过空间阻断底物接近活性位点。从抗溶菌酶VHHs和VNARs的早期结构研究中可以认识到,这些分子在异常情况下会与酶相互作用时尚,使用扩展的互补决定区(CDR)3 loops深入探究其活性位点。随后使用针对溶菌酶活性位点的其他VHs,VHHs和VNARs,以及针对α-淀粉酶,碳酸酐酶和尿激酶的活性位点结合VHHs,独立复制了这些结果。 通过一个VHH通过其CDR2环穿透活性位点裂口实现了对α-淀粉酶的抑制作用,这表明CDR3中心结合不是sdAb抑制竞争性酶的唯一机制。尽管进行了深入研究,但尚未描述通过靶向其活性位点的常规抗体对这些酶的竞争性抑制,特别是针对溶菌酶的鼠抗体。蛋白酶的天然竞争性抑制剂是凸的,这似乎是常规抗体的互补位难以实现的几何形状(请参见下文):即使在接近真正的竞争性抑制的情况下,常规抗体也使用平坦或凹入的VH / VL界面结合酶上的突出区域,并以一种非底物样的方式将一个或多个CDR部分插入到活性位点裂口中。这一假设得到了使用酶-纯化的多克隆免疫球蛋白(Ig)Gs的实验的支持。免疫单峰骆驼显示竞争性抑制是仅重链IgG的特征,而不是常规IgG的特征。尚不清楚为什么用某些酶免疫会产生大部分具有平面paratope的sdAb并结合在活性位点之外,从而实现变构或无变构抑制,尽管耐受机制可能起作用。
在针对病原微生物的sdAb研究中,发现了明显支持sdAb与常规抗体不同特异性的第二条证据。 Stijlemans等人假设,单峰骆驼VHH cAb-An33靶向布鲁氏锥虫所有变异表面糖蛋白类别中保守的隐性糖肽表位的能力是由于VHH的体积小以及其潜在表位。兔和单峰骆驼多克隆常规抗体以及〜90 kDa凝集素无法进入该位点,支持了该假设。 Henderson等[69]提出,VNAR(12Y-2及其亲和力成熟的变体)对疟原虫AMA1上保守的疏水性裂缝的识别反映了一种新颖的结合方式。尽管鼠类常规抗体(1F9)的表位与VNAR 12Y-2的表位基本重叠,但1F9的结合在很大程度上取决于疏水槽周围的多态环残基。同样,Ditlev等人[70]将羊驼VHHs与疟疾VAR2CSA蛋白的多个结构域的结合归因于VHHs识别主要表位的固有能力,尽管对人类对VAR2CSA的常规抗体应答以及不可重复性的了解有限美洲驼VHHs对这些反应模式的分析使这一评估变得复杂。
可能在HIV-1的包膜糖蛋白三聚体中发现了比sdAb更能结合sdAb的抗原决定簇的最清楚的例子:使用常规抗体很难实现异源交叉菌株的中和,需要数月的慢性感染和通过重组蛋白抗原的常规免疫,可以很容易地诱导出多轮的体细胞突变和选择,但是交叉中和的针对CD4结合位点和CD4诱导的位点的仅骆驼科重链抗体。对于其他病毒病原体,可以找到类似的例子。靶向脊髓灰质炎病毒衣壳中与CD155结合的“峡谷”(canyon)的血清型交叉中和抗体很少由鼠类或人类体液免疫系统产生,但显然在仅美洲驼重链反应中很常见。同样,靶向HLA的VHH诺如病毒VP1的HBGA结合口袋可中和多种基因型,而较大的常规抗体也与HBGA口袋周围的抗原可变残基接触,因此具有菌株特异性
最后,与常规抗体相比,已暗示sdAb可以优先进入膜蛋白上的凹入(recessed )位点,例如离子通道和G蛋白偶联受体(GPCR)。虽然这是一个有趣的假设,但尚未有任何数据证实。没有定义针对Kv1.3离子通道的骆驼状VHH靶向细胞外环,而不是针对通道腔[85]以及针对P2X7离子通道的VHHs表位没有定义。同样,骆驼科VHH被开发为对抗趋化因子受体CXCR4潜在疗法。 CXCR7和ChemR23,,以及用作某些GPCR,通道和转运蛋白的结晶伴侣的VHH,似乎都以类似于常规抗体及其片段的方式结合这些受体的溶剂暴露的细胞外或细胞内环。相比之下,发现从Ig样NCAM结构域改造而成的合成的CXCR4结合“ i-body”深入渗透到受体的配体结合口袋中,占据了真正的隐秘(cryptic)的部分跨膜表位。因此,至少存在有一些理由认为,小尺寸的sdAb可能使它们能够进入毛孔和通道上的凹陷区域,尽管仍缺乏实验证据。
总体而言,有力的证据表明,骆驼科动物VHH至少可以与蛋白质上的隐性(recessed )表位相互作用,而传统的抗体难以结合这些隐性表位。对于抗乳球菌噬菌体的sdAb ,恶性疟原虫MTIP ,表皮生长因子受体和呼吸道合胞病毒融合蛋白,可以找到与蛋白质上的凹入表位结合的其他实例(裂口,腔,缝隙或凹槽,clefts, cavities, crevices or grooves)。情况尚不清楚,这些位点是常规抗体无法接近的。尽管VNAR可能会共享相似的裂缝绑定倾向,但此类主张是基于非常有限的公开数据(三个结构)。此外,应注意,sdAb和常规抗体的表位之间存在部分或完全重叠的例子(本综述未涵盖),因此sdAb结合隐性(recessed )表位的程度与常规抗体可访问表位的结合程度,以及这种差异的大小是否超过了常规抗体的更一般的种间反应性差异,仍然是未知的。
三、单域抗体直接针对线性蛋白表位 Single-domain antibodies direct against linear protein epitopes
通常公认的是,大多数针对折叠蛋白的常规抗体都针对构象表位(≥90%),尽管这在某种程度上取决于抗原的性质。 几位作者提出,至少VHH比传统抗体以更高的亲和力结合线性肽的可能性更低。尽管这是基于sdAb对位的典型结构的合理假设(见下文),但尚未 由任何数据证实。 而且,相对大量的通过蛋白质印迹(western blotting)报告sdAb反应性的研究表明,针对连续表位的sdAb可能并不稀少。
四、单域抗体对位结构 Single-domain antibody paratope structures

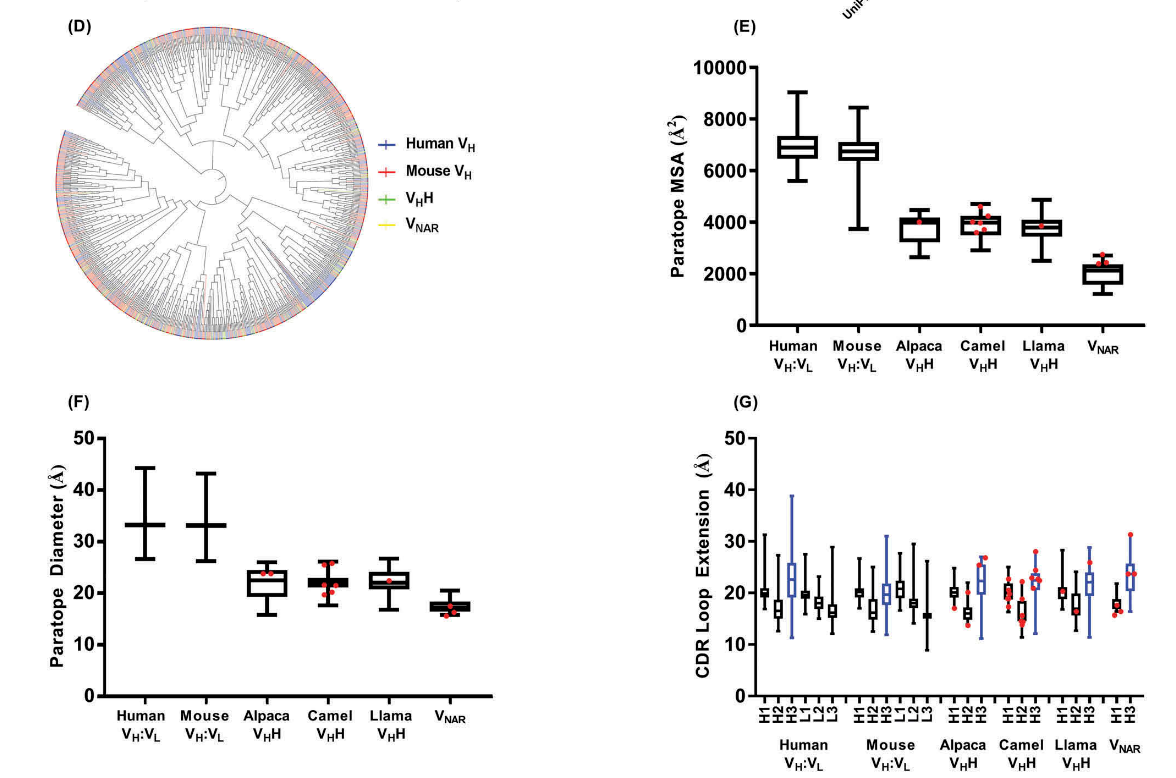

- 针对折叠蛋白的常规抗体的互补位往往是平坦或凹入的;至少鼠类和人类常规抗体难以实现凸(convex )结合位点,尽管合成的常规抗体可经工程改造以采用此类几何结构。相反, sdAb互补型拓扑可以同时采用平面和凸型拓扑,尽管可能仅采用低效的凹型拓扑。
- VHHs的CDR1和CDR2环有别于常规抗体的典型规范结构(图2A),可能是由于体细胞突变,因为种系人VH和骆驼科动物VHH组成谱似乎具有相似的规范结构。只有少数VNAR结晶,其中一些显示出CDR1(H1-13–9)的结构类别,在VHH中比常规抗体更常见,尽管其他一些具有的CDR1规范结构更接近VL结构域。
- VHH和VNAR的CDR3长度分布(图2B)比常规抗体更宽,并且倾向于更长的长度。
- sdAb的长CDR环可能在结构上受到非规范的二硫键的约束(请参见专栏2)。
- 尽管可能会有更高的体细胞突变率(至少是VHHs),但VHHs,VNARs和常规抗体的互补位具有相似的氨基酸含量,均富含Gly,Ser和Tyr,并且它们的CDR序列没有明显的序列同源性模式(图2C,D)。
- 与常规抗体相比,VHH和VNAR对位均具有较小的分子表面积和较小的直径(图2E,F)。但是,sdAb互补位作为一个整体并没有比常规抗体更广泛地延伸,这可以通过任何CDR环的尖端与碱基之间的最大原子间距离来反映(图2G)。
Box 2
一些但不是全部的骆驼科VHH带有成对的半胱氨酸残基,除了在所有Ig域中均存在保守的Cys23-Cys104键(IMGT编号)之外,还导致形成第二个域内二硫键。非规范二硫键最常见的是桥接CDR1和CDR3中的Cys残基,但也可以连接FR2和CDR,CDR2和CDR3,或CDR3环中的两个位置。 CDR1中的Cys残基由种系VHH基因编码,这些基因经常在单峰骆驼的库中使用,使用这些基因的B细胞可能在受体重排过程中获得了伙伴Cys。引用了两个假设来解释VHH域中非规范二硫键的存在:它们可能赋予VHH折叠更大的稳定性和/或限制长CDR3环的构象柔韧性,从而可能最大程度地减少熵对抗原结合的惩罚。然而,诱变研究表明,形成非规范二硫键的Cys残基可以被其他残基取代,而对抗原结合亲和力和热稳定性的损害不大。 大多数软骨鱼VNAR具有一个跨FR2-CDR3(I型)或CDR1-CDR3(II型和III16型)的附加非规范二硫键。此外,I型VNAR还具有CDR3-FR4二硫键,有时还具有CDR3二硫键(总共3个或4个域内二硫键)。少数VNAR(IV型)仅带有单规范的二硫键。至于VHHs,CDR1,FR2和FR4中的大多数VNAR Cys残基可能是在种系中编码的,并且非典型的二硫键在初级谱系发育过程中形成。 尽管尚不清楚非经典二硫键在sdAb结构和功能中的确切作用,但这些连接很可能影响sdAb互补位结构,因为抗原驱动的体细胞高变的模式似乎取决于它们的存在和位置。
五、单域抗体:抗原相互作用 Single-domain antibody:antigen interactions
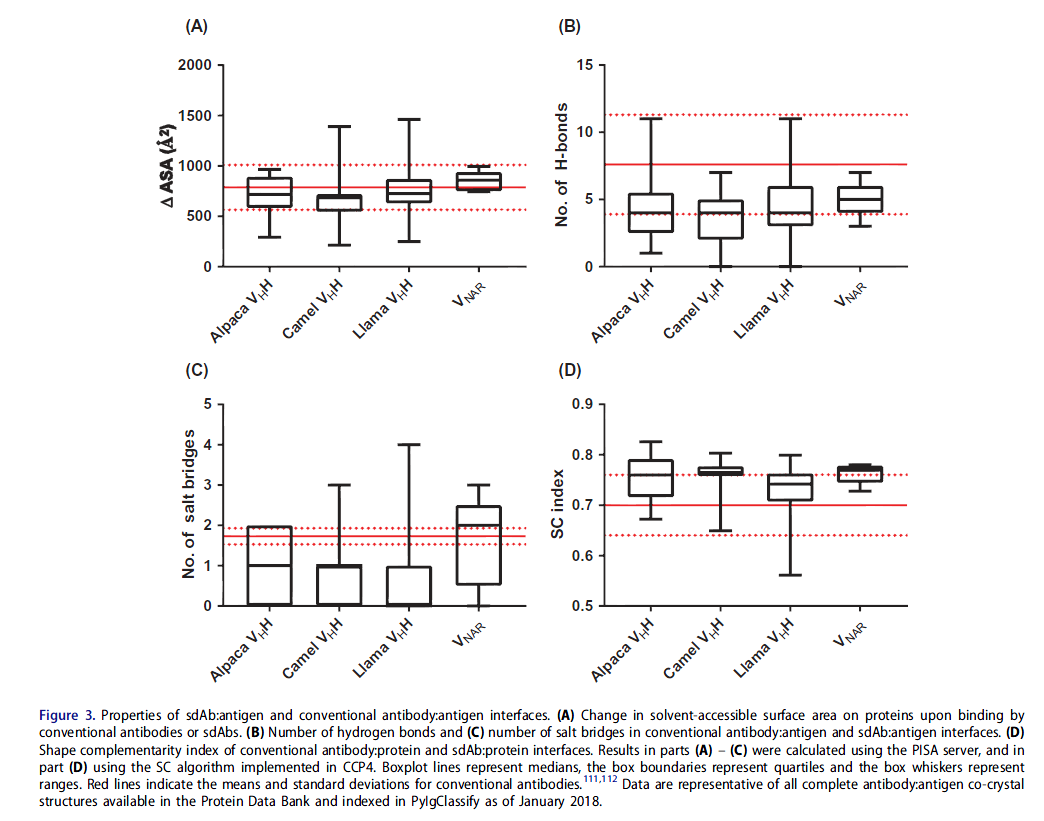
鉴于前者分子的互补位大约是后者抗体大小的一半,因此sdAb在抗原上的足迹(footprints )要小于常规抗体。 与常规抗体相比,仅使用三个CDR环(对于VNAR,两个CDR环和可能的两个HV环),sdAb可以在蛋白质上掩埋相似的溶剂可及表面积(图3A)。 sdAb的分子接触数量(氢键,盐桥)比常规抗体略低,但按链的数量更高(图3B,3C),这使其成为可能。 此外,sdAb:蛋白质界面的表面互补性在抗体:抗原相互作用方面处于高端(图3D)。 因此,sdAb和常规抗体通过相似类型的非共价相互作用结合蛋白质抗原,但它们更多地集中在sdAb的较小互补位上。
六、针对小分子的单域抗体 Single-domain antibodies directed against small molecules
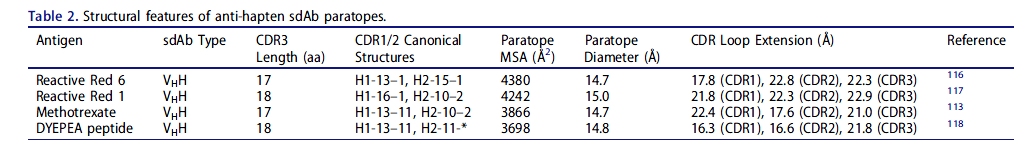
传统抗体与半抗原,小分子脂质和寡糖相互作用的主要机制是通过在VH和VL结构域之间的界面上形成一个结合袋,该结合袋通常涉及CDR-H3和CDR-L3环的碱基。同样,常规抗体往往在重链和轻链CDR形成的凹槽中容纳短线性肽和核酸聚合物。有四项研究报道了骆驼科VHH与半抗原和肽复合的结构(表2);除了一个抗体(甲氨蝶呤特异性VHH的非规范结合位点位于CDR1下方的框架区域(FR)3残基的非规范结合位点)以外的所有抗体的识别机制基本类似于常规抗体,半抗原结合口袋由两个抗体组成或多个CDR,并在某些情况下扩展到以前的VL接口。值得注意的是,这些VHH中的三个具有CDR1或CDR2的非规范结构,而在其他VHH的结构中未观察到这种结构,并且可能未进行种系编码。
多项研究报道了半抗原特异性VHHs的分离,但未对其结构进行研究,尽管一些研究还报道了与针对半抗原的常规IgG滴度相比,血清仅重链IgG滴度更弱且不一致。没有研究报道半抗原特异性VNAR,只有一项研究描述了针对脑膜炎奈瑟氏球菌脂多糖的碳水化合物特异性VHH; 已经描述了至少两种与糖肽表位结合的骆驼科VHH 。没有任何类型的sdAb具有令人信服地结合脂质或核酸的描述。总之,数据的共识是,sdAb互补位可能难以但并非不可能容纳半抗原,并且三个CDR足以形成此类相互作用所需的结合口袋和凹槽,尽管在口袋形成过程中,前VL界面上可能会增加溶解度的FR2残基可能会影响半抗原结合的特异性。
七、合成单域抗体和非抗体支架 Synthetic single-domain antibodies and non-antibody scaffolds
可以使用体外方(例如,噬菌体展示)法将衍生自VHH,VNAR或罕见的人和鼠VH和VL结构域的合成合成sdAbs在天然VH:VL配对范围之外保持稳定和可溶,以结合抗原。 最近,已经开发出了使用能够诱导V(D)J重组的工程化细胞系和带有杂交美洲驼-人类或全人类高度基因座的转基因小鼠来产生半合成sdAb的技术;在两种情况下, VH,D和JH基因(其中一些处于非生殖系构型以促进自主折叠)在异源细胞或体内系统中重新排列。已经描述了数量有限的合成sdAb,并且在结构上与抗原复合的研究还很少。然而,现有数据表明,某些合成的sdAb具有类似于VHHs和VNARs的裂隙结合特性,而其他合成的sdAb采用不寻常的机制与平面蛋白表位相互作用(例如,MDM4特异性VH结构域的CDR3重组,以适应针对疏水螺旋; 使用不同的机制使FR显着参与VH与血管内皮生长因子的结合和CD40。对于基于非Ig的抗体(例如可变淋巴细胞受体和非抗体支架)(基于单体非Ig结构域,例如纤连蛋白III型和SRC同源性3结构域)的互补位结构和结合模式,并且它们的合成来源可能暗示它们没有遵循一般模式。如果是这样,对天然存在的sdAb结合特异性的限制可能不会同样影响合成的sdAb和非抗体支架,尽管仍然可以应用稳定的Ig折叠可耐受的氨基酸序列的基本结构限制。
八、结论与观点
由非传统模型生物(例如牛,鸡)产生的异常抗体的最新研究引起了人们对抗体应答的比较免疫学的新兴趣。显然,sdAb比常规抗体更容易接近蛋白质上的某些“隐秘”(cryptic)区域(例如,酶的活性位点,病毒糖蛋白的凹入区域)。更普遍地说,我们推测sdAb识别的主要优点是能够靶向高变病原体上保守的裂口和袋状区域(通常是结合位点),而无需与这些位点的易变周边进行辅助接触。病原体选择为什么以及如何在鲨鱼和骆驼科动物中产生了两个与进化无关的sdAb系统,而在其他生物中却没有,尚待阐明。在sdAb的情况下,特权访问(privileged access)是由其紧凑的互补位直径( compact paratope diameters)(在没有配对的VL结构域的情况下)而不是互补位形状或结构的任何全局差异赋予的。相似的非共价相互作用介导了常规抗体和sdAb的结合,尽管它们更有效地集中在sdAb的紧密互补位上以产生高亲和力相互作用。尽管sdAb互补位可能难以采用凹形几何结构和识别小分子,但仍不清楚这种互补位限制是否也不利于与某些类型的蛋白质表位相互作用。
未来的研究将需要严格评估sdAb与常规抗体靶向的蛋白表位空间中的分离和重叠程度,并探讨是否可以通过计算机预测sdAb可及(和不可及)表位。 常规抗体与仅重链抗体在宿主防御中的免疫学功能(例如中和作用,调理作用,抗体依赖性细胞介导的细胞毒性和补体依赖性细胞毒性)的基础研究也将非常有价值。 鉴于sdAb对位抗原明显介导与蛋白质的高亲和力相互作用,在脊椎动物中负责形成更复杂的配对VH:VL抗体系统的进化力以及轻链的整体功能都是悬而未决的问题。
参考资料
- MAbs. 2018 Aug-Sep; 10(6): 815–826. Antigen recognition by single-domain antibodies: structural latitudes and constraints. 网址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6260137/
