【3.1.2】TCR-T细胞肿瘤免疫治疗的研究进展
目前,肿瘤免疫治疗方兴未艾,群雄并起,其中最有效的治疗策略之一就是过继细胞转移疗法(ACT)。嵌合抗原受体(CAR)和工程化T细胞受体(TCR)是近年来主要的过继性T细胞免疫疗法。TCR工程T细胞表达肿瘤抗原特异性受体,其α链和β链由高质量、高亲和力的抗原特异性T细胞克隆产生。

TCR分子属于免疫球蛋白的一个超家族,由两个共价结合的多态性亚单位组成,每个亚单位都是抗原特异性的,它们至少与四种不同类型的信号转导链有关。为了激活T细胞,TCR和主要组织相容性复合体(MHC)之间必须存在相互作用。

TCRs与pMHC(peptide-MHC)相互作用的强弱决定了未成熟胸腺细胞的命运,对幼稚T细胞的存活至关重要。因此,TCR-T免疫治疗技术通过与MHC特别是Ⅱ类分子的有效相互作用激活宿主的免疫系统,后者被TCR-T细胞和CAR-T细胞特异识别。TCR-T细胞可以识别细胞内的肿瘤特异性抗原,而CAR-T细胞主要识别肿瘤表面的特异性抗原。这使得TCR-T细胞在肿瘤治疗中更有效。
一、CAR-T与TCR-T的比较
在ACT疗法中、TCR-T和CAR-T细胞都已被成功地用于实体瘤的临床治疗。

CAR包含肿瘤抗原靶向的单链抗体、跨膜结构域和CD3ζ的胞内激活结构域。通过这种方式,工程化的CAR能够识别特定的肿瘤相关抗原,CAR能够在不经过MHC处理的情况下结合未经处理的肿瘤表面抗原。
第一代CAR-T细胞表现出有限的扩增和相对较短的持久性, “第二代”CAR-T加入了共刺激受体CD28、4-1BB/CD137和OX40。将这些共刺激受体添加到CAR-T细胞的CD3ζ结构域中,从而促进更强大和持久的T细胞反应。第三代CARs同时结合两个共刺激信号(CD28和4-1BB),这比第二代CARs具有更好的扩增和更长的持续性。
相反,TCR是与MHC抗原复合物结合的α/β异二聚体。与TCR相比,CARs识别肿瘤抗原具有某些缺点,如肿瘤外毒性。与CARs相比,TCRs在基于T细胞的治疗中具有一些结构性优势,例如其受体结构中有更多的亚单位(10:1),免疫受体基于酪氨酸的激活基序(ITAMs)更多(10:3),对抗原的依赖性更小(1:100),以及更多的共刺激受体(CD3,CD4,CD28等等)。具有低MHC亲和力范围(104-106M-1)的TCR就可以有效的激活T细胞,相反,CARs需要更高的亲和力范围(106-109M-1)。
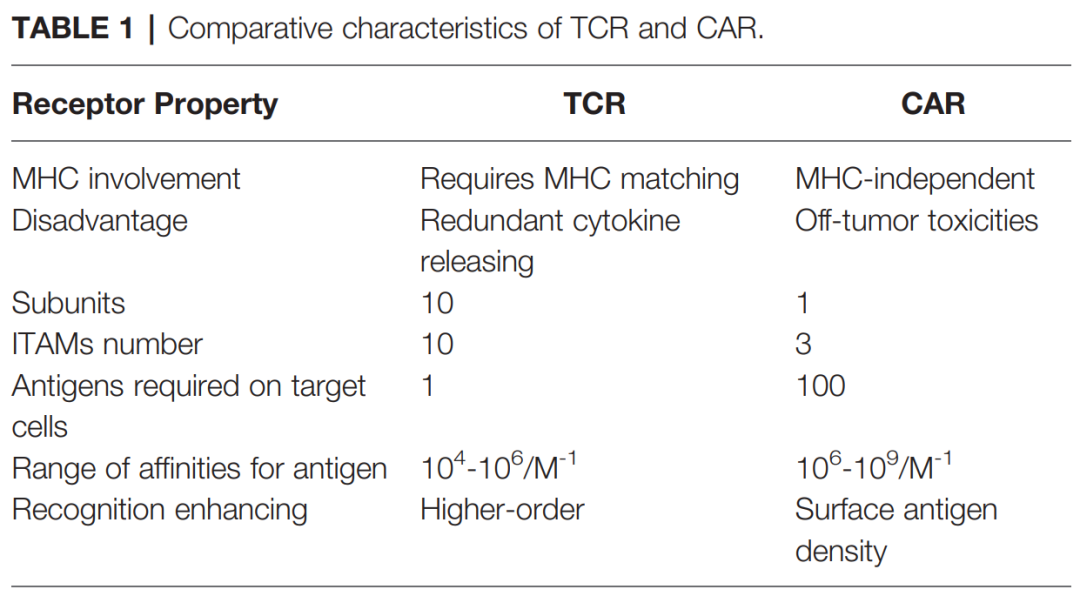
因此,CAR介导的细胞毒性依赖于更高密度的细胞表面抗原。此外,T细胞/抗原相互作用在免疫突触(IS)结构中启动,其中TCR呈现具有外周LFA-1粘附的环状区域,而CAR呈现无环状区域的弥散LFA-1分布。因此,TCR-IS比CAR-IS发出的信令速度慢但持续时间长。同时,CAR-T细胞呈现出更快的杀伤功能,并向下一个肿瘤靶点迁移(连环杀伤),这与TCR-T细胞延长信号传导和延长杀伤时间形成鲜明对比。
二、重组TCRs
TCR是人体最复杂的受体之一,它包含六种不同的受体亚单位,它们在T细胞中具有非常广泛的功能。肿瘤浸润淋巴细胞(TILs)的TCR的改变显著影响肿瘤特异性T细胞。其中TCR的变化有助于T细胞的增殖,TCR多样性与抗肿瘤作用相关。
对TIL的TCR工程化是肿瘤的最佳治疗方法之一。TCR由结合到肽-MHC配体的α链和β链、CD3复合体的信号亚单位(ϵ、γ和δ)以及CD3ζ同源二聚体组成。除CD3ζ外,所有亚单位均具有细胞外免疫球蛋白(Ig)结构域。基于这些结构,利用工程化TCR的新技术有ImmTAC、TRuCs和TAC等。
2.1 免疫动员单克隆T细胞受体(ImmTAC)
ImmTACs是使用工程化、可溶性和亲和增强的单克隆TCRs(mTCRs)设计的。ImmTACs基本上是融合蛋白,结合了工程化的TCR靶向系统和单链抗体片段(scFv)效应器功能。在ImmTACs的构建中, TCR能够识别来自人类白细胞抗原(HLA)呈递的细胞内靶点的肽。
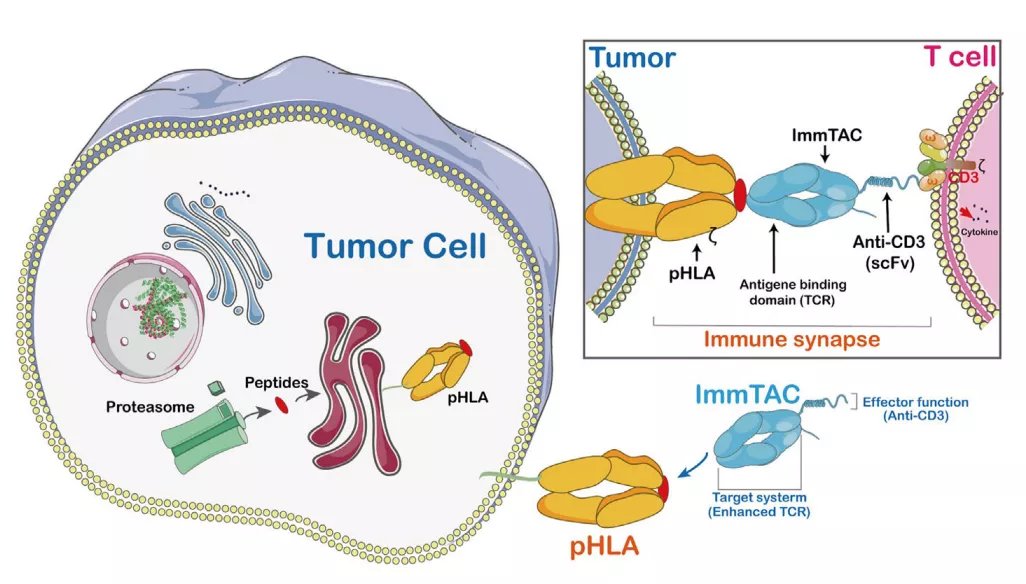
ImmTAC通过特异性靶向肿瘤细胞表面的HLA-肽复合物,并通过scFv抗体片段与CD3的相互作用促进T细胞介导的效应器功能。ImmTAC还以剂量依赖性方式激活CD8+T细胞,并能有效地重定向和激活效应和记忆CD8+和CD4+细胞。ImmTAC通过分泌多种细胞因子表现出多功能反应,如TNF-α、IFN-γ、IL-6、MIP1α-β和IFN-γ诱导蛋白10。
此外,选择合适的靶抗原是ImmTACs的关键,质谱技术和MHC多聚体技术有助于识别合适的抗原。值得注意的是,TCR工程化T细胞也表现出非预期靶向毒性。总的来说,ImmTACs已被证明能增强TCR-T细胞的抗肿瘤反应,但其安全性有待进一步研究。
2.2 T细胞受体融合结构
T细胞受体融合结构(TRuCs),一种与T细胞受体亚单位融合的抗体结合域,设计用于有效识别肿瘤表面抗原。TRuCs由靶向肿瘤相关抗原的特异性抗体融合到5个TCR亚基(TCRα、TCRβ、CD3ϵ、CD3γ和CD3δ)的胞外N-末端组成,为工程化T细胞提供了新的靶向特异性和HLA非依赖性靶细胞清除能力,可被相应的靶细胞激活。

与第二代CAR-T细胞相比,该方法显示出更好的抗肿瘤效果。此外,TRuCs支配TCR复合体的全部信号机制,而CARs仅利用分离的CD3ζ胞内段的有限信号。
2.2 T细胞抗原偶联剂(TAC)
T细胞抗原偶联剂是另一个工程化TCR细胞,以非MHC依赖性方式诱导更有效的抗肿瘤反应并降低毒性。TAC嵌合蛋白通过与CD3结构域的结合,从而形成TCR/CD3复合物并获得更多的T细胞应答。

TAC受体的活性与CD3结合域的选择密切相关。例如,与UCHT1相比,来自OKT3(muromonab-CD3)的单链抗体具有较低的细胞因子产生和细胞毒性,这可能导致实质上不同的功能结果。与第二代CARs相比,TAC基因工程化的T细胞不仅有利于过继后在实体瘤的更大浸润,而且减少了T细胞在表达抗原的健康组织中的扩增和肿瘤外毒性。
三、TCR-T的安全性
TCR-T细胞的ACT显示出很高的肿瘤杀伤,但在一些临床研究中也出现了一些严重的不良事件。优化工程化T细胞中的TCR亲和力至关重要,受体亲和力能够决定T细胞治疗的安全性和有效性。就疗效而言,亲和力TCR相互作用足以激活T细胞,但需要强亲和力来维持T细胞的扩增。
在I/II期ACT临床试验中,低亲和力工程化T细胞显示出更安全的特性,但它们的抗肿瘤反应较弱。通过识别T细胞的TCR-pMHC相互作用,可以将工程化T细胞分为高亲和力型和低亲和力型。此外,人们也开发了一些技术来提高TCR-T的安全性。
基于工程化T细胞的安全开关机制是一种有吸引力的策略。来源于单纯疱疹病毒Ⅰ型(HSV-TK)的胸苷激酶基因是最常见的自杀基因之一。
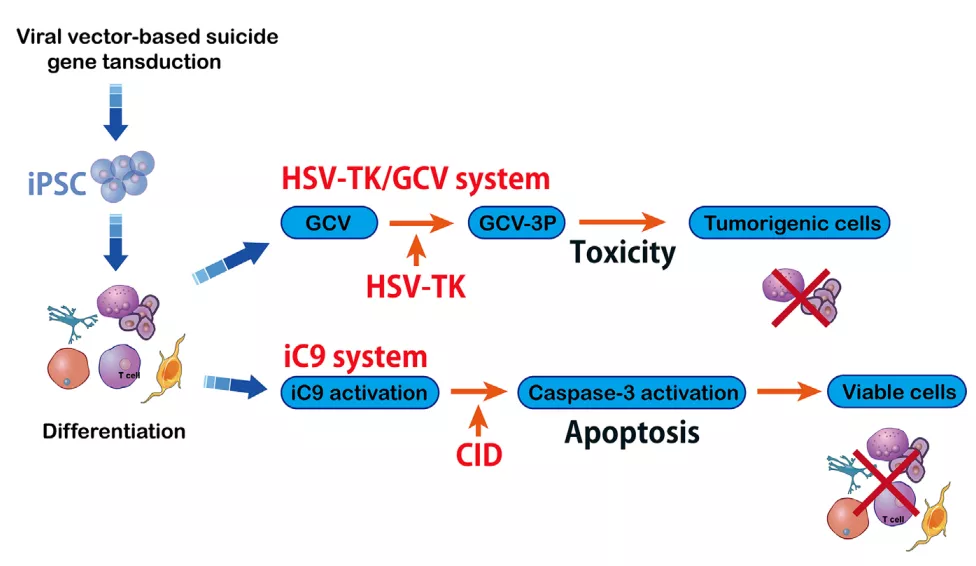
尽管HSV-TK在基于细胞的免疫治疗中显示出安全性,但需要导入磷酸化的核苷类似物。另一个更安全的诱导T细胞安全开关称为诱导型caspase-9(iC9)。iC9是一种修饰的人FK结合蛋白,可通过小分子化合物AP1903激活,这一过程依赖于线粒体凋亡途径。
iC9自杀基因的免疫原性较低,引发针对转基因细胞的免疫反应降低。基于iC9的安全开关已经被证明比先前的自杀基因更有潜力用于细胞治疗。
四、小结
近年来,工程化T细胞在治疗血液瘤方面显示出极为优越的疗效。TCR调节对于T细胞的再活化、免疫应答及其对外来抗原的临床效应至关重要。而TCR-T细胞具有CAR-T无法比拟的优势,在临床前和临床研究中显示出巨大的潜力。未来,TCR-T必将展现出其独有的魅力,给肿瘤患者解除病痛带来希望。
参考资料
