【2.7.7】在噬菌体展示库中构建天然骆驼科动物VHH库
骆驼科动物具有独特的抗体,即HCAb(VHH)或仅由重链同型二聚体组成的商品化Nanobodies(Nb)。由于基于免疫骆驼科动物的文库耗时,昂贵且可能对某些抗原而言是多余的,因此我们描述了从未免疫骆驼科动物的血清中建立亚纳摩尔范围的亲和力且适用于标准品的naive camelid VHHs文库,这种方法是快速的并且可以恢复VHH谱库,其优点是更加多样化,非特异性并且没有特异性抗体的亚群,从而可以鉴定任何潜在抗原(或病原体)的结合物。分离了来自沙特阿拉伯的骆驼科动物,扩增了多种vhh基因的cDNA,将所得的扩增子克隆到噬菌体展示pSEX81载体中,发现该文库的大小在要求的范围内(10^7),适合随后在疾病中应用诊断和治疗:随机选择200个克隆,并估算插入的基因文库的冗余性或对其进行测序,然后将其与参考骆驼科动物vhh基因进行比对(acc. NO. ADE99145)。结果表明该小文库的完全非特异性,其中未检测到单个冗余事件。这些结果表明了采用这种方法的功效,以产生足够大和多样的基因库,以确保编码任何靶抗原所需抗体的所需版本的存在。这项工作是构建可用于疾病(例如结核病或结核病)诊断和治疗的基于噬菌体展示的生物传感器的第一步。
一、前言
在骆驼科[1,2]中发现天然存在的仅重链抗体(HCAb),为药物和药物治疗提供了另一种方法[3]。这些抗体易于在细菌中表达,并适合重组DNA技术。这些抗体的衍生物稳定,通用并且具有独特的重折叠能力,降低的聚集趋势以及对其同源抗原的高亲和力。这些抗体的抗原结合位点被限制在一个结构域,称为重链或VHH的可变结构域。这些可变的纳米抗体(nanoantibodies)或纳米体(Nanobodies)(Nb)可以很容易地在细菌,酵母或其他宿主中以重组单结构域抗体(sdAb)的形式表达,被认为是最小的完整抗原结合片段[4]。由于其生物物理和药学特性,Nb片段具有广阔的应用潜力,尤其是作为新的免疫治疗药物以及有效的治疗和诊断方法[3]。
哺乳动物免疫球蛋白-γ(IgG)抗体的整体结构包含两条重链(H)和两条轻链(L)相同,高度保守的多肽链[5]。除常规的异四聚体抗体外,骆驼科的血清还具有两种其他特殊类型的IgG抗体(图1a)。这些抗体不含L链多肽,由三个而不是四个球状结构域组成,因为它们缺少第一个恒定结构域(CH1)。同二聚体蛋白的N末端结构域的H链包含可变结构域VHH,该结构域使其与其关联抗原相关联[4]。在没有可变轻链(VL)链结构域的情况下,该结构域适合在抗原结合中发挥功能[6-9]。
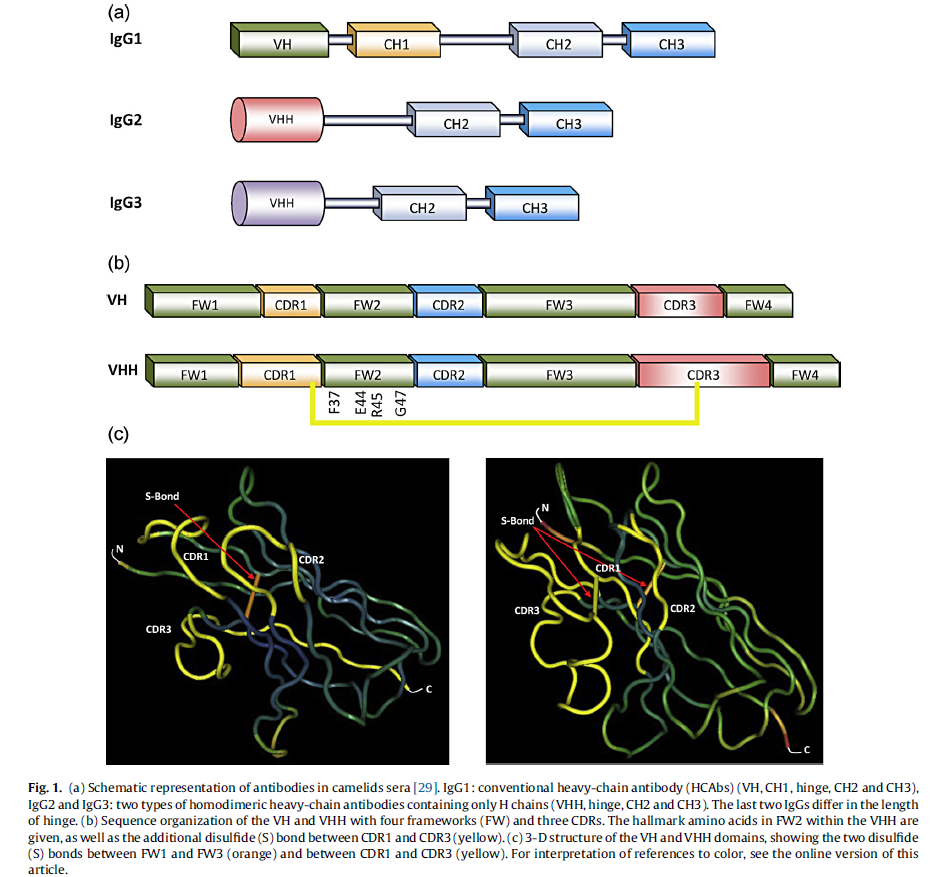
经典抗体(VH)的H链可变域与HCAbs(VHH)的可变域之间的组织非常相似,因为它们均由四个保守序列组成,即构架区(FW),围绕三个高变区,即互补决定区(CDR)(图1b)。但是,VH和VHH有重要区别[10]。
- 基于氨基酸序列,很明显VHH的CDR1和CDR3的大小大于VH。
- VH结构域的FW区包含更多的疏水氨基酸,而VHH结构域包含更多的亲水氨基酸(图1b)。这种区别解释了VL缔合的缺乏和VHH作为单结构域实体的溶解性[11]。
- 此外,VHH还包含一个额外的二硫键(CysSCys)[10],有助于形成环结构[12,13](图1b和c)。
迄今为止,大多数已的VHH已从免疫骆驼中分离出来[14-17]。该过程耗时,昂贵且可能对某些抗原可能是多余的,因此,已提出了naive VHH文库[15]。使用这种类型文库的理由是其种类更多,这使得人们可以鉴定用于任何潜在的抗原[14,18]。
在这项工作中,我们描述了骆驼属血清中naive文库的构建,并表明它可以回收更多样化的文库,这些文库适用于标准免疫应用并适合重组DNA技术它的产生取决于细菌;因此,它比哺乳动物细胞培养物便宜得多。在
二、材料和方法
2.1 血液手机和RNA纯化
EDTA中从30只未免疫的年轻骆驼科动物身上收集了20毫升血液样本,并使用Ficol分离方法分离了淋巴细胞[19]约10^9收集细胞并分成2-ml微量离心管;使用QIAamp RNA血液提取微型试剂盒(Qiagen,Dusseldorf,德国),根据制造商的说明,进行RNA纯化。然后,使用RevertAid逆转录酶(目录号EP0441,Thermo Scientific,KG Biotech,RAK,阿拉伯联合酋长国)和polyT-18引物,将2ug RNA用于cDNA合成。
2.2 VHH扩增和文库构建
。。。
2.3 文库评估和测序
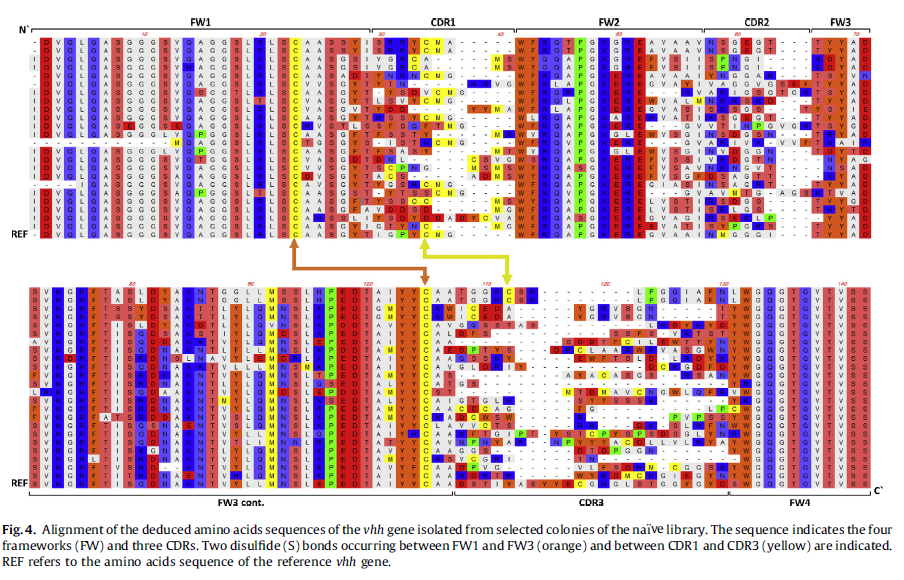
通过在LB选择培养基(100mg氨苄青霉素/ l)上铺板,评估文库中20微升合并的转化体的文库大小。 此外,随机收集200个菌落并用于微量制备,并通过用HinfI消化DNA来检查插入片段在文库中的冗余性。 然后,由Acrogen Korea(韩国首尔市金城区Gasandong)将100个菌落送去进行毛细管DNA测序。 通过CLUSTAL W方法将推导的氨基酸序列与参考vhh抗体(编号ADE99145)比对,以检测VHH区域内的多样性。
三、结果
进行了逐步PCR(图2),回收的扩增子(图3)用于构建骆驼科动物VHH文库。由于这是一个天然的文库(即来自未免疫动物的文库),因此有望具有很高的多样性。通过在培养板重复物中接种10ul并计数菌落数来检查文库的大小。该文库估计约为10^7个细胞。基于用HinfI酶消化DNA的冗余度测试(数据未显示)和vhh基因测序表明VHH的CDR结构域之间具有高度多样性(图4)。盒载体pSEX81在本研究中被用作构建噬菌体展示文库的第一步[21]。最可用于疾病诊断和治疗的库类型[22]。
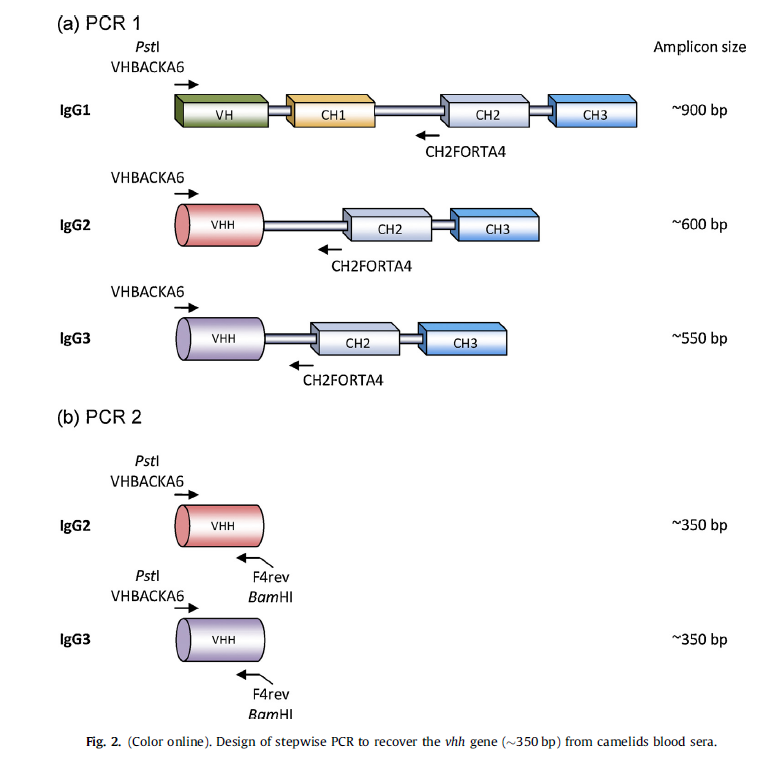
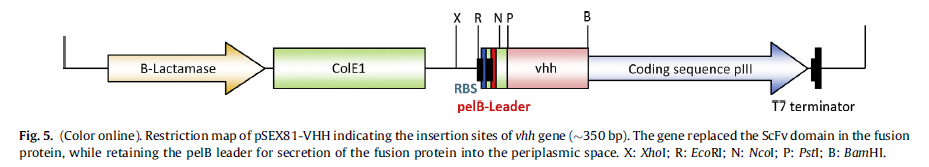
载体pSEX81被设计用于方便地插入重链可变域编码区,并用于在13个噬菌体表面上产生功能性单链Fv抗体pIII融合蛋白。通常通过PCR扩增相应的DNA片段。然后,将扩增子按框克隆在细菌果胶酸裂解酶(pelB)的信号肽序列和13个噬菌体的pIII基因之间,以将融合蛋白分泌到周质空间中。该载体还提供了IPTG诱导型强启动子,T7终止子,ColE1复制起点,噬菌体F1的基因间区域和用于选择的氨苄青霉素抗性标记。在当前的工作中,我们使用了BamHI和PstI限制性核酸内切酶的识别位点,以允许vhh基因片段与pelB前导基因和pIII基因一起在框架内单向插入(图5)。现在,该载体可用于在大肠杆菌中过表达任何功能性重组单链Fv抗体-pIII融合蛋白。
四、讨论
常规抗体的轻链和重链可变区的物理连接会导致结构不稳定,从而降低其溶解度和应用范围。鉴定仅由骆驼科和鲨鱼中的重链(HCAb)形成的抗体可以改善抗原S抗体的结合[1,2,18],因为它们更稳定并可以识别常规抗体无法接近的表位[12,23-25] 。
到目前为止,回收的VHHs大多是从经过免疫接种的骆驼中分离出来的,而不是未经免疫接种的骆驼[1,26]。最近,有人提出将来自美洲驼和鲨鱼的naive VHH文库作为更好的选择[14S17],其中此类文库的多样性可以识别任何潜在抗原的结合物。最近的研究表明,有可能回收有用的抗原即使使用相对较小的naive库(10^7)[16],其大小与本研究中恢复的大小相同,也可以使用粘合剂。
基于成功恢复10^7大小的naive库,我们建议恢复一个类似的文库,它在CDR域中具有随机的超突变,许多研究人员成功地使用了这一方法[14,18,27]。这些超突变可以补偿已经从免疫动物中回收的文库中已经获得的体细胞超突变[25,28]。 [4]显示,由10^9个淋巴细胞构建的美洲驼naive文库可以以与单克隆抗体相当的亲和力回收抗体。可以将这项工作视为选择针对不同病原体的有用VHH的有效工具。
参考资料
- C. R. Biologies 337 (2014) 244–249. Construction of naive camelids VHH repertoire in phage display-based library
