【8.2】外泌体
外泌体是纯天然的纳米颗粒,在组织里面有广泛的分布,现在已知的所有细胞都可以产生外泌体。越来越多的研究表明,外泌体可以调节多种生物学功能。
一、大自然的细胞间信使
在自然界中,外泌体保护和输送功能性大分子,包括核酸、蛋白质、脂质和碳水化合物。外泌体通过将大分子转移到受体细胞或激活信号通路以改变受体细胞的行为。比如转录转译、组织修复、免疫平衡、细胞分化与再生、细胞凋亡、细胞迁移、代谢调节、微生物环境,这些远远不能涵盖近些年在学术界广泛的研究工作。基于外泌体这些独特的优势,人们期待他可以成为一种无细胞的疗法来应用于多种适应症。
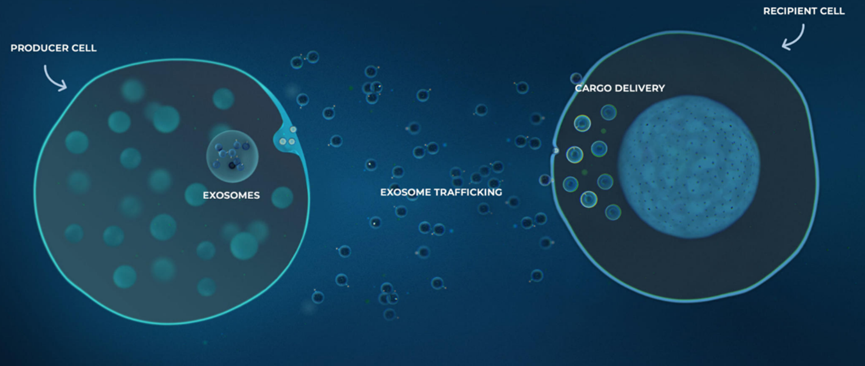
图1通过外泌体的细胞间交流
二、治疗潜力
对于外泌体作为药物载体的期待根源于外泌体独特的结构。其结构简单,外面是磷脂双分子层构成的膜,膜上有丰富的蛋白质分布,里面是一个空腔,空腔里面可以装载大分子、小分子和核酸类物质,空腔是我们可以利用来进行药物递送的一个空间。外面的蛋白质的存在非常有价值,一方面可以提供低免疫原性,可重复性给药的潜能大;另一方面,利用这些蛋白质进行表面修饰,装载大分子,提高靶向性。

图2外泌体结构
关于外泌体的医药潜力主要包括三个大的方向(图3):
A.外泌体在诊断预防方面的潜力:从病例微环境中提取的外泌体可作为生物标志物用于对特定疾病和损伤的诊断。
B.外泌体的医疗潜力:外泌体由多种细胞产生,通过多种方式与目标细胞作用,产生医疗效果。
C.外泌体的药物递送潜力:外泌体可用于递送RNA 、蛋白质、小分子等多种药物。
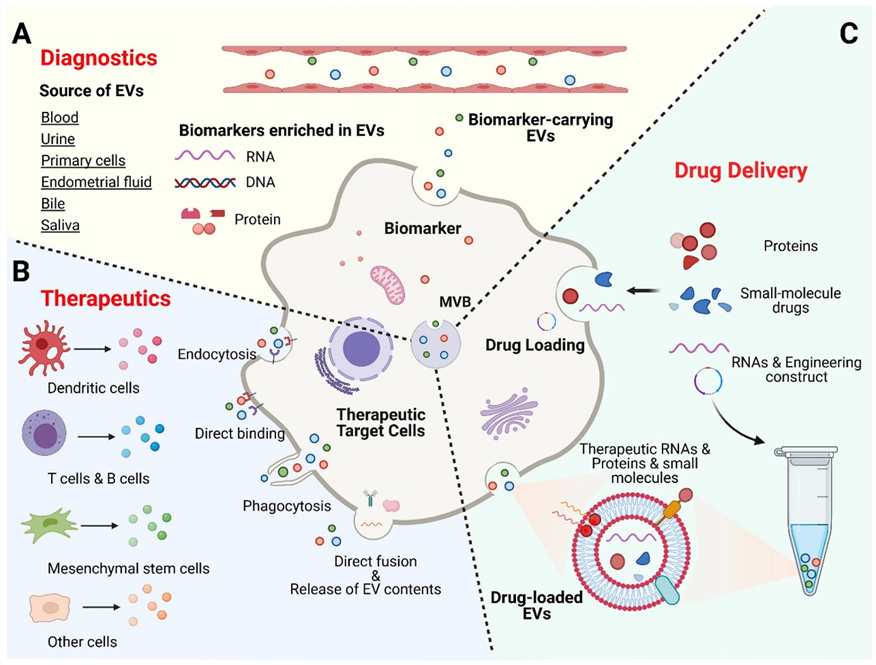
图3外泌体的潜在应用
三、药物递送系统(DDS)的应用
DDS开发需要考虑的一个因素是药物包封效率,由于外泌体是来自细胞活性的生物产品,与脂质体递送系统相比,它们适应其脂质膜和内部组成的自由度较低。
A.将药物加载到外泌体中主要有两种策略:1)在外泌体分离之前,通过添加和操作外泌体供体细胞来加载药物。该策略要求亲本细胞与要封装在外泌体中的药物的相容性和适用性。2)外泌体分离后加载药物。该策略需要保留囊泡的结构和功能。 为了全面评估任何治疗性递送载体,在类似于人类状况的临床前模型中详细测试药效学和药代动力学至关重要。
B.到目前为止,已发表的外泌体作为DDS的临床前研究只有小鼠,大鼠和斑马鱼。猪已被用于作为外泌体治疗本身的临床前测试,但不作为DDS,没有已发表的记录来研究非人类灵长类动物。
C.疾病适应症涵盖神经退行性疾病、心血管疾病、肿瘤、炎症等。
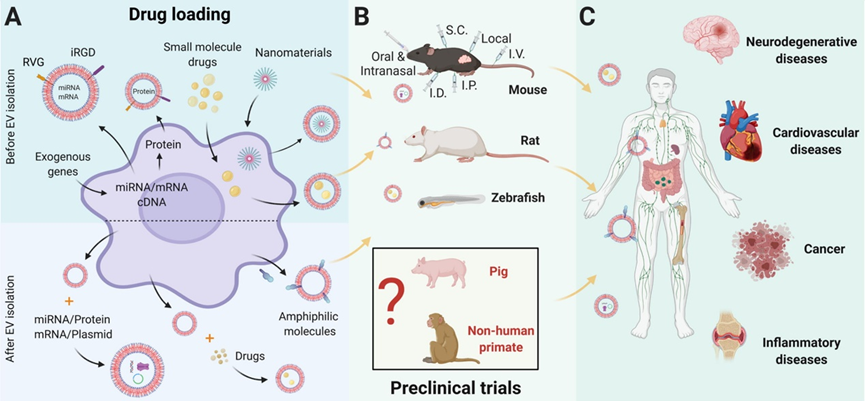
图4临床前动物模型中外泌体作为DDS的示意图
四、脂质体与外泌体给药的比较
将治疗药物递送到作用部位的主要挑战是靶组织、细胞或细胞器中的脱靶毒性、快速清除以及低积累和生物利用度。为了规避这些挑战,在过去的几十年里,已经开发了广泛的合成输送载体(脂质体,脂质纳米颗粒,聚合物胶束,无机纳米颗粒,树枝状聚合物等),其中一些已经得到临床批准。在所有纳米颗粒的可用图谱中,迄今为止最成功的,市场上临床批准数量最多的载体是脂质体。鉴于脂质体与外泌体的相似性,接下来将比较两者物理化学性质和药物递送能力。
A.脂质体:脂质性药物加载到双层膜中;可以掺入配体以增加组织靶向特异性;亲水性药物可以加载在脂质体的管腔中。Onpattro是美国食品和药物管理局(FDA)批准的第一个 siRNA负载脂质纳米颗粒,由可电离脂质,胆固醇,PEGylated脂质和辅助脂质组成。
B.外泌体:蛋白质,亲水性药物和核酸(miRNA,siRNA,mRNA等)可以加载到囊泡的腔内,而靶向配体,膜蛋白和亲脂性药物可以掺入膜中。
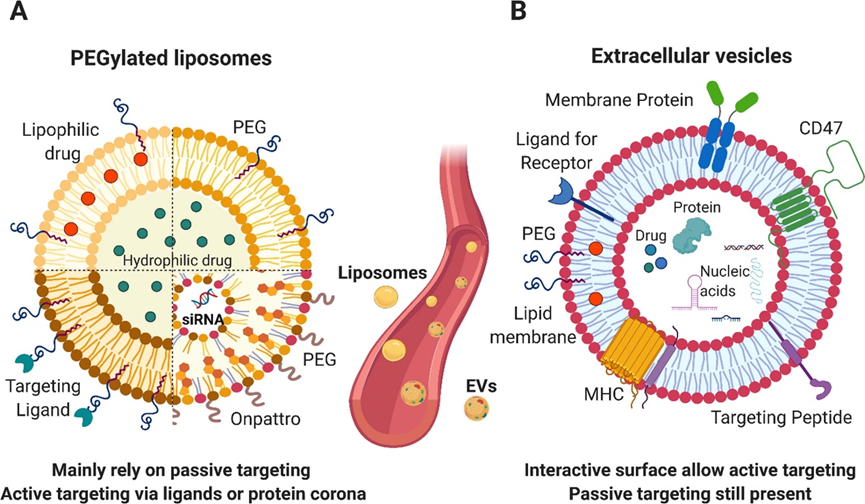
4.1 物理特征、生产和质量控制
脂质体在结构上与外泌体相似,因为它们由脂质双层组成。类似地,外泌体可以在脂质膜双层内携带疏水药物,在水性核心中携带亲水性药物。此外,临床批准的脂质体的尺寸约为100nm,类似于外泌体。该尺寸与避免巨噬细胞过早清除(随着颗粒尺寸的增加而增加)和肾清除(发生在流体动力学半径小于5-6 nm的颗粒上)是相容的。此外,脂质体的大小允许在静脉内给药和细胞摄取后在某些身体部位外渗。
尽管它们具有相似之处,但脂质体和电动汽车作为药物输送载体之间存在许多差异。与外泌体相比,临床使用的脂质体由有限数量的脂质组成,但没有蛋白质和遗传物质等细胞成分,因此,它们在药品质量控制和大规模生产过程中相对容易处理。
然而,外泌体富含鞘磷脂,胆固醇和溶血磷脂,所以与脂质体中的单个组分混合相比,外泌体可以实现更高程度的复杂性。此外,由于膜和核心中存在生物分子,外泌体中可能存在额外的结合口袋以进行药物加载。这对制造和质量控制提出了更高要求,到目前为止,在外泌体的生产和收获方面,扩大规模仍然极具挑战性。 外泌体和脂质体的体内给药 纳米颗粒(外泌体和脂质体)被单核吞噬细胞系统(MPS)迅速清除。脂质体代表可生物降解和生物相容的DDS,具有非常通用的高通量制备和药物封装效率,允许冻干和表面修饰。为了降低免疫原性并避免脂质体的快速血液清除,聚乙二醇(PEG)表面涂层被广泛使用,从而使更多的积累在靶组织中。用PEG或PEG偶联靶向配体装饰外泌体已被提出作为增强外泌体药物递送能力的有前途的策略。另一个有趣的策略是选择含有CD47等特定表面蛋白的外泌体子集。这种蛋白质在外泌体中充当“不要吃我信号”,并可能赋予它们绕过MPS并表现出更长循环时间的能力。
4.2 纳米粒子注射引发CARPA
CARPA是一种急性过敏反应,其症状包括心肺、血流动力学和一系列其他病理生理学变化。据报道,脂质纳米颗粒可引发不良免疫反应,并导致超敏反应CARPA,阻碍其在超敏患者的临床应用。因此,CARPA被认为是一个安全问题。尽管许多研究已经证实脂质体的施用可能导致不良的CARPA反应,但其确切的机制仍然未知。这为研究外泌体作为DDS的应用提供了机会,外泌体可能具有克服CARPA效应的潜力,因为一些研究声称外泌体由天然生物分子混合物组成,不会引起与脂质体颗粒输注相关的不良反应。但是,关于外泌体给药后可能的CARPA不良反应,其发生仍然不确定
4.3 生物分布
市场上所有获批的脂质体药物都依赖被动靶向,只有一小部分主动靶向制剂已达到临床阶段。这是因为即使使用表面配体靶向靶细胞上的特异性受体,脂质体的积累仍然被认为是由被动外渗过程决定的,称为增强通透性和保留(EPR)效应。通过EPR效应,循环时间较长的脂质体容易积聚在肿瘤中或受损的心肌。 研究表明,尺寸低于100nm的外泌体也能够通过某些肿瘤中的EPR效应实现肿瘤靶向的增强。同时,外泌体天然的互动表面,使它们自然地主动瞄准载体。尽管它们的交互式表面,外泌体的被动生物分布对于药物递送应用来说是一个巨大的挑战,因为到目前为止报道的研究中,外泌体的主要摄取器官也是肝脏和脾脏。据报道,外泌体上的整合素表达谱与肺,肝和脑的组织向器官性直接相关。此外,每个肿瘤来源的外泌体群体都对外泌体亲本细胞系起源的特定器官表现出偏向性。这些结果强化了外泌体源的选择可能是实现特定组织靶向的关键。
4.4 药代动力学和药效学(PK/PD)
PK/PD作为基于药物生理和药理作用的模拟系统,可以为药物的治疗疗效提供有价值的信息。与游离形式的药物相比,药物在脂质体中的包封阻止了快速清除,并显着改变了药物的PK特征。与脂质体相比,由于存在表面CD47,外泌体可能具有减少MPS介导的清除率的潜力,但需要更多的证据。由于大规模外泌体生产的挑战和内源性外泌体的存在,关于外泌体的PK/PD特性的信息很少。外泌体作为DDS的PK/PD特性的全面了解对于外泌体到达临床至关重要。
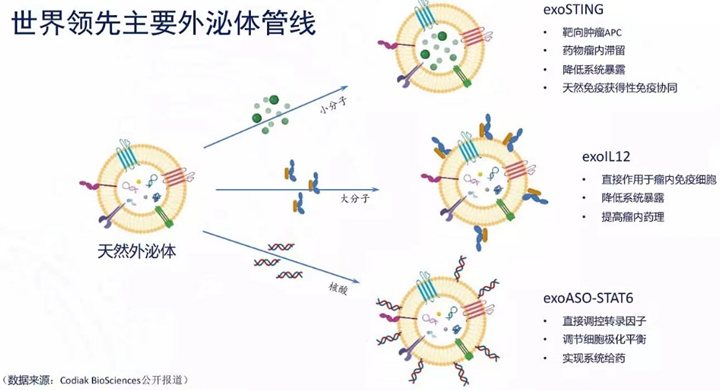
五、外泌体管线开发
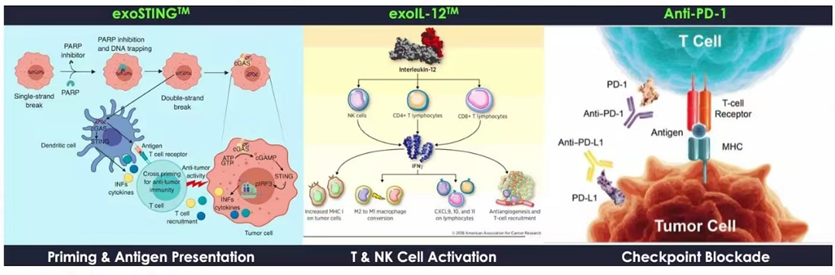
Codiak是全球首家专注于开发外泌体治疗方法的生物制药公司。Codiak BioSciences主要的三个临床管线:exoSTING,exoIL12,exoASO-STAT6。他们分表代表了外泌体向体内递送小分子,蛋白大分子以及核酸类的药物。目前exoSTING,exoIL12已完成Ⅰ期临床,在ⅠⅠ期临床阶段。exoASO-STAT6刚刚进入Ⅰ期临床阶段。前两个管线安全数据表现良好。根据该公司公开报道,exoSTING/exoIL12/antiPD1多功能外泌体显著增强抑癌作用。
近年来在生物医药领域内受到很多关注的物质——外泌体,有独特优势,比如容易实现多分子的装载,有靶向性的潜力,工程改造的潜力,免疫原性低,适用于重复给药。当然外泌体有他自身的一些局限性,在目前阶段对他的研究还不丰富,所以产能相对较低,也是这个领域亟待提高的一个方向。因此勇敢迎接工程和制造挑战,才能让精确的外泌体治疗成为现实。
参考资料
