【7】评估生物制药候选物可开发性的最佳实践(Best Practices in Assessment of Developability of Biopharmaceutical Candidates)
一、前言
机构的研究人员倾向于基于生物学特性选择候选药物,例如,抗体的情况下,基于结合亲和力,效力,功效,与物种靶标的交叉反应性进行毒理学研究和表位。然而,为了将候选物开发成药物,需要评估其他性质,例如表达和纯化产率,聚集倾向,稳定性,粘度,物理化学谱,与体内环境的相容性和免疫原性。负责开发以经济有效,可重复的方式生产高质量安全生物药物的过程的部门或研究组织对这些药物的附加特性感兴趣。因此,选择最佳分子,兼顾生物学和可开发性,是成功开发生物药物的关键步骤(图7.1)。可开发性解决风险评估和风险缓解问题,以提高选定的生物药物候选药物成功开发成患者可用药物的可能性。由于在可开发性评估期间对主要过程因素进行了调查,因此评估的额外输出是判断候选药物是否可以通过平台过程制造。在本章的上下文中,生物药物候选物的可开发性评估这一术语被理解为实验性的,而不是计算性的,用于评估制造可行性的调查(生产率,稳定性,过程),特定给药途径的易于配制,重要的是,与体内条件(in vivo tness)的相容性,例如交叉反应性,半衰期,体内环境中的稳定性和免疫原性。简而言之,在可开发性评估期间,在开始昂贵的开发工作之前,选择候选药物,或者如果必要的话,设计药物以实现制造,配方和安全特性。该方法定义了制造,配方和安全方面的最佳候选者,而不是采用制造工艺来制备难以生产的药物。适应在后期开发阶段制备高质量生物药物的过程变得越来越昂贵。已知可能影响蛋白质完整性的潜在翻译后修饰(PTM)位点的计算机鉴定和等电点(pI)的确定是本章的唯一计算组成部分。
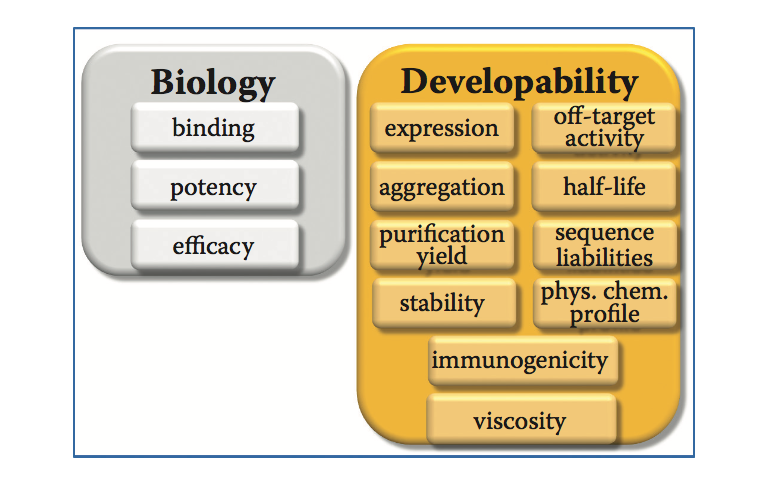
图7.1 生物候选物需要在生物学和可开发性特征方面表现优异,最终成为一种成功的药物。
二、为什么可开发性很重要
创新的生物药物在商业规模上的开发和生产成本很高。用于生产临床材料的典型开发程序包括细胞系开发,工艺开发,用于毒理学研究的材料的生产,以及最终用于临床试验的材料的生产。在几年的时间里,体积生产率和产品质量得到优化,制造过程按比例扩大,以满足预期的市场需求。随着对蛋白质表达和纯化的当前理解,可以产生大多数潜在的治疗性生物药物。已经建立了大量有效的真核和真核表达系统以使复合物的制备具有越来越复杂的治疗性蛋白质的惊人进展。然而,开发适合于难以表达和纯化和配制的蛋白质的方法的成本和时间表可能变得过高,只要必须放弃这种治疗剂的开发。相反,可以在平台过程中表达,纯化和配制的蛋白质实体的开发,即,适用于制造蛋白质的已建立的,良好优化的过程,对该过程进行微小修改,具有商业吸引力。因此,不仅要根据生物学考虑选择候选药物并提出将材料制备成细胞系和过程开发所需的任何努力,而且在开始细胞系和过程开发之前选择具有良好可开发性活动的候选物是有意义的。评估可开发性,被认为是与药物开发所需的预期工作相关的候选药物的全面表征,可以做出明智的决策和风险预警。可以发现候选物适合已建立的平台流程,风险低,并且包含技术开发的成本。可开发性评估还可以得出结论,即开发候选人的成本是中等甚至是高。因此,可开发性评估使项目团队和公司管理层能够根据开发成本做出有意识的,基于事实的决策。可开发性评估可以减少开发过程,减少工作量和成本。
三、抗体候选人评估
通过噬菌体展示(phage display),杂交瘤(hybridoma)或永生化技术(immortalization technologies)产生抗体通常产生相当数量的潜在候选药物。 首先,研究团队确定候选物,考虑结合,表位,效力和交叉反应等生物特性。 随后,研究团队确定的多达50名候选物可以进入可开发性评估。 在诺华,候选物的可开发性评估分为早期选择阶段和最终剖析阶段。 在选择阶段,候选者的数量通常减少到大约4个,最终在剖析阶段详细表征(图7.2)。

图7.2 在选择阶段,许多候选物的特征在高通量测定。 在这个阶段,重点是制造的可行性。 在选择阶段确定的少数候选物随后在候选人物况分析阶段进行深入的表征。 在分析阶段期间,更详细地评估制造的可行性,此外,评估候选物在制剂和体内适合度方面的特征。 在该过程结束时,识别lead和备用候选物。 基于在选择和分析期间生成的数据,可以评估候选者是否可能在低成本平台过程中准备好或者需要在资源密集型,非平台过程中处理。
为了评估分析阶段中的广谱候选物,除了候选物的可开发性特征之外,还考虑序列和表位多样性,因为结构上密切相关的候选物可能都显示出可比较的可开发性问题。
可开发性评估过程以识别lead和备用候选物而告终。 基于候选物选择和分析期间产生的综合结果,可以评估候选物是否最有可能在低成本平台过程中开发,或者需要在资源密集型非平台过程中进行准备。
3.1 早期选择阶段
在早期选择阶段,在计算机中确定候选物的互补决定区(CDR)中的潜在PTM位点和候选物的理论等电点(Isoelectric point, pI)。 在体外测定中评估表达效价,聚集,构象稳定性和疏水性。
3.1.1 翻译后修改 (Post-Translational Modi cations)
作为第一步,在计算机中扫描候选物的CDR的氨基酸序列以寻找潜在的PTM位点。 翻译后蛋白质修饰可能影响产品稳定性,影响制造过程和制剂开发,降低效力,并增加免疫原性的风险。 标记了天冬酰胺脱酰胺,天冬氨酸异构化,甲硫氨酸和色氨酸残基的氧化,未配对的半胱氨酸残基和潜在的糖基化位点。 例如,CDR中N-糖基化位点的存在导致候选物的消除,或者如果没有替代候选物可用,则开始通过基因工程改造位点的努力。 突出显示并评估不太重要的修改以及为每个候选物生成的体外数据。
3.1.2 关键风险因素
表达候选物的可行性和候选物的聚合倾向被认为是关键的风险因素。 关键风险因素直接影响候选物排名并导致候选物的取消选择。
3.1.2.1 表达
在早期选择阶段,在制备用于分析和功能评估的材料期间,表达差或低表达将导致困难。如Geisse和Fux所述,候选物的可表达性通过人胚胎肾细胞(HEK293)中候选物的瞬时表达来确定。出于成本原因,聚乙烯亚胺(PEI)用作转染剂。转染在含有100ml培养基的1L滚瓶中进行。培养10天后,离心除去细胞,过滤澄清上清液。蛋白质含量在配备有分析蛋白A柱的高效液相色谱(HPLC)系统上测定。在100ml规模的HEK293细胞中的瞬时表达通常产生数十毫克的候选蛋白,这足以进行早期选择阶段测定并鉴定候选物用于后续的详细表征。迄今为止,中国仓鼠卵巢(CHO)细胞中100ml规模的瞬时表达并未稳定地产生足够的材料用于表征。因此,尽管CHO细胞最终将用于制造,但HEK细胞中的瞬时表达用于早期选择。蛋白A的色谱法用于纯化候选抗体。通过质谱法检查每个纯化候选物的身份和完整性。瞬时表达系统中的表达水平不能预测稳定的表达系统。因此,基于差表达取消候选者是由于这些候选者与高通量早期阶段的不兼容性。较短的时间表不允许我们单独提升表达不良的候选物。然而,失去表达不良的候选物不是问题,因为在这个阶段的总候选人数通常很高。
3.1.2.2 聚合 Aggregation
在蛋白质药物的表达,加工,配制和使用过程中可能发生聚集。 它可能导致体内疗效降低,制造中批次之间的变异性增加,并且重要的是,患者的免疫原性。 因此,聚合倾向是确定并用于在早期选择阶段以及概况分析阶段中取消选择候选者的关键参数。 通过尺寸排阻色谱 - 多角度光散射评估抗体聚集体的量。
3.1.3 累积风险因素 Cumulative Risk Factors
累积风险因素综合影响评级,并实现全面的数据驱动候选物排名。 在早期选择阶段,等电点,构象稳定性,表面疏水性和界面稳定性被评估为累积风险因子。
3.1.3.1 Isoelectric Point
有意义的是选择满足已建立的下游处理平台中的净化要求的候选者。 pI是这方面的预测因子,并且基于氨基酸序列在计算机中确定。 由于在分析阶段期间通过实验评估药物制剂中的溶解度,因此pI不用于估计候选物的最佳溶解度的最佳pH。
3.1.3.2 构象稳定性 Conformational Stability
通过差示扫描量热法使用Thermofluor测定法以高通量模式评估构象稳定性。 温度上升最终导致折叠的球状蛋白质展开或融化。 熔点(Tm)的测定提供了蛋白质稳定性的量度,更稳定的候选物需要更高的温度才能展开。
3.1.3.3 疏水性 Hydrophobicity
具有增加的疏水性的候选者倾向于在聚集,粘度和溶解度方面表现出问题。 因此,在早期选择阶段评估候选物的疏水性。 通过测定候选物从疏水相互作用色谱(HIC)柱洗脱的硫酸铵浓度来实验测量表面疏水性。
3.1.3.4 界面稳定性 Interface Stability
文库中重链和轻链区的随机关联可以产生具有良好抗原结合特性的候选物。 然而,由于没有体内选择和成熟,如通过杂交瘤技术或人B细胞永生化获得的候选物,可能形成不稳定的重链和轻链对。 通过噬菌体展示技术产生的Fab片段中重链和轻链区之间的界面稳定性,通过将重链组氨酸标记的非半胱氨酸键合的Fab片段吸附到金属螯合亲和层析柱来测试。 用30%异丙醇洗涤后,评估洗脱的轻链的量。
3.1.4 早期可开发性评估
对于评估的每个候选物,使用“红绿灯”分类,红色表示高风险,黄色表示中等风险,绿色表示低风险评估。这个单个候选物的累积风险标签分别来自两个关键因素,即聚集和效力,以及四个风险因素(pI,Tm,疏水性和界面稳定性)(图7.3)。低风险,中等风险和高风险分类建立在每个风险因素的阈值之上。阈值是根据科学知识和历史数据设定的。这两个关键因素也使用每个交通灯标签进行分类。相比之下,四个风险因素仅分为两类:绿色和黄色。只有不利风险因素的组合才会对整体风险标签产生负面影响。取消选择高风险候选者,并考虑技术可开发性,序列和表位多样性以及生物活性对其余候选者进行排序。在随后的最终剖析阶段,最佳候选人的特征更为详细。
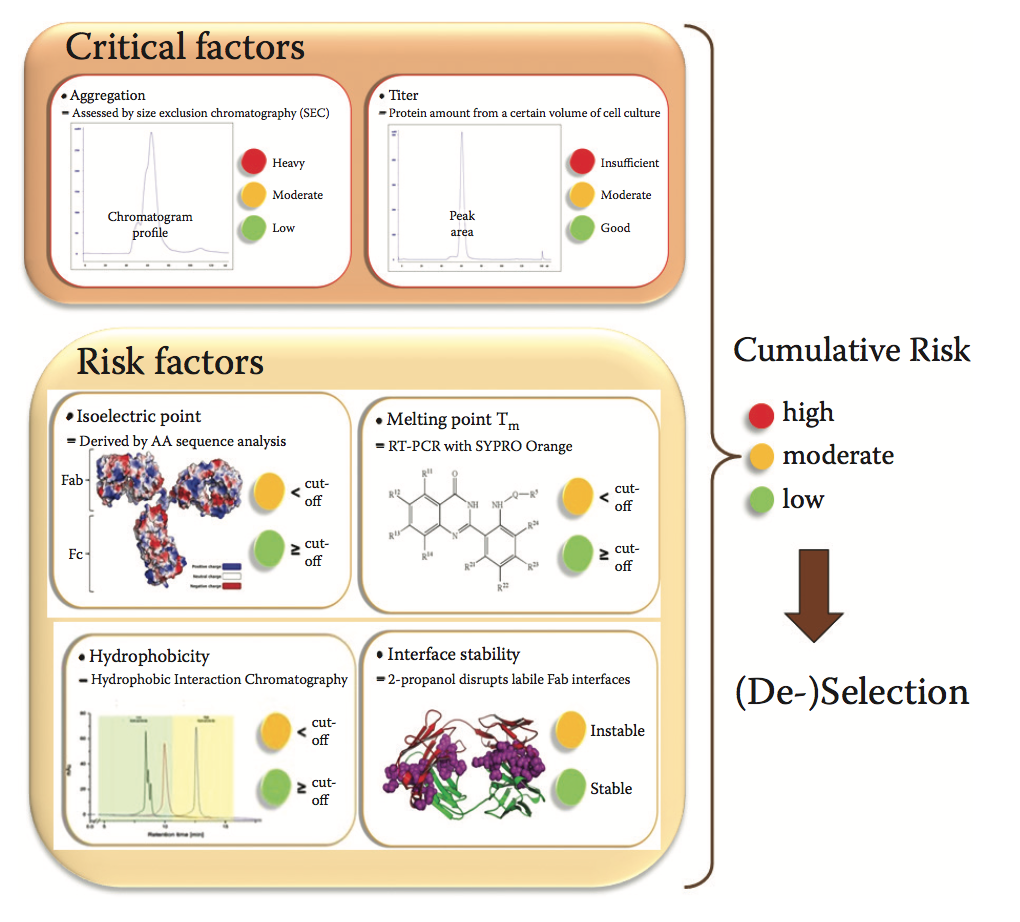
图7.3 对表达效价和聚集倾向负有相当大责任的候选物将被去掉。 进一步的候选物排名考虑了累积风险因素。
3.2 最终的分析阶段
最终的分析阶段包括针对CHO生成,分子谱分析,预配制和体内适应性的候选物的更详细评估。
- CHO生产包括与临床制造相关的上游和下游工艺要求的评估。
- 分子谱分析涉及物理化学表征,重点是完整性,纯度,异质性,修饰,粘度和构象稳定性。
- 预配方研究评估在代表性应激条件下在所选制剂中的稳定性和溶解度, *体内适合度检测血清,血浆或其他相关体内基质中的离体稳定性; 非特异性结合;药代动力学; Fc受体结合; 和免疫原性的风险。
3.2.1 CHO生产
3.2.1.1 上游流程
如前所述,通过在HEK293细胞中瞬时表达,制备用于早期选择阶段表征的蛋白质。相反,为了在最终的分析阶段中进行详细表征,通过在CHO制造细胞系中稳定表达来制备材料。在分析阶段期间,执行所有测试所需的克数量的候选物的产生,仅在该阶段已经使用稳定表达系统是可行的。首先将转染的CHO细胞培养为细胞库,并将从培养的细胞库中回收的候选蛋白用于候选分析。与细胞库的培养平行,克隆细胞以最终鉴定用于临床和商业制造的最终克隆。因此,并且重要的是,生成最终制造细胞系和候选物的最终分析的过程并行运行并且完全整合。该方法使得可以将制造单元线的选择与最佳产品轮廓相关联。
3.2.1.1 下游流程
CHO表达的蛋白质的纯化,在标准抗体纯化平台过程的缩小版本中进行。 通过离心和过滤澄清细胞收获,并在蛋白A色谱柱上捕获抗体候选物。 随后,降低洗脱液的pH以模拟病毒灭活步骤,并测试不同的离子交换色谱树脂和要求以确定抛光蛋白质的最佳条件。 净化评估使我们能够评估候选物是否最有可能在低资源平台过程中进行准备,或者需要以更加资源密集的非平台方法进行处理。
3.2.2 分子谱 Molecular Profiling
在分子谱分析中评估完整性,修饰,纯度,异质性,粘度和构象稳定性。 完整性,纯度,异质性和修饰是依赖于过程的,而粘度和稳定性主要与候选物的氨基酸序列相关。
3.2.2.1 测试完整性和修改 Testing for Integrity and Modifications
通过电喷雾电离(ESI)质谱(MS),十二烷基硫酸钠毛细管电泳(SDS-CE)和微流体凝胶电泳系统上的电泳评估表达和纯化后候选蛋白中的修饰的特性,完整性和存在性。 产生的肽图可以通过液相色谱 - 质谱(LC-MS)表征脱酰胺,异构化,氧化,剪切和糖基化模式等修饰的详细分析和定位。
3.2.2.2 聚合和降解产物
聚集体,降解产物和污染物的定量基于尺寸排阻色谱(size exclusion chromatography, SEC)和SDS-CE数据。
3.2.2.3 分子的异质性
例如,通过毛细管区带电泳(CZE)和阳离子交换色谱鉴定脱酰胺作用的电荷变体。 变体的详细表征基于肽匹配(peptide mapping )和LC-MS。
3.2.2.4 粘性 Viscosity
粘度在毛细管流变仪中以高浓度(例如,150mg / ml)测定,并且通过动态光散射(DLS)测量胶体稳定性,只要在低浓度(1-10mg / ml)下仅限制量的候选物即可。发现低浓度的DLS测量和高浓度的流变测定具有相当好的相关性。
3.2.2.5 构象稳定性
在分析阶段通过差示扫描量热法评估构象稳定性。 发现在分析期间通过差示扫描量热法获得的数据,与在早期选择阶段期间通过高通量差示扫描荧光测定法产生的数据很好地相关。
3.2.2.6 等电点 Isoelectric Point
pI可通过毛细管电泳 - 等电聚焦(CE-IEF)测定。 发现实验确定的pI与在早期选择阶段期间计算机测定的pI很好地相关。 因此,实验性pI测量仅在最终分析阶段的特殊情况下进行。
3.2.3 前处理
在开发性评估期间也应考虑给药和配方的途径。 这些方面传统上已在后期开发阶段得到解决。 候选分析测定包括测定溶解度和加速稳定性测试,以便可以考虑这些重要方面用于候选选择。
3.2.3.1 可溶性
候选物的溶解度通常在100mg / ml的候选蛋白质浓度下,4.0至8.0的pH范围内确定。 将溶液温育1和7天,通过测量405nm处的浊度并在离心后在280和330nm处的UV吸收来评估溶解度。
3.2.3.2 加速稳定性
如前所述,在分子谱分析下评估候选物的构象稳定性。在预配制中,候选物的稳定性在施加热和机械应力之后并且长时间测试。制备浓度为约100mg / ml,pH范围为5.0-6.5的候选蛋白质溶液,含有和不含赋形剂如蔗糖和精氨酸。为了评估热稳定性,将溶液在25℃和40℃下孵育数周。通过分别冻融溶液和摇动来施加机械应力。在将蛋白质溶液在5℃和25℃下储存长达1年后,研究长期稳定性。从存储数周的材料中生成的稳定性数据被考虑用于可开发性评估和选择领先和备用候选者。长期稳定性数据仅在作出牵头决定后才可用,但在主要候选人的后期制定活动中是有用的。应激后使用分子谱分析中描述的方法评估聚集,异质性和修饰,包括尺寸排阻色谱,毛细管区带电泳,动态光散射和浊度测量。根据需要通过质谱法对降解产物进行详细表征。
3.2.4 体内适应性 In Vivo Fitness
重要的是要理解允许成功生产,纯化和配制的抗体的性质,不一定与体内的最佳行为相关(反之亦然)。 为了研究这些风险,在分析期间包括几种测定法,并且称为体内适合度评估。
3.2.4.1 FcRn结合
通过由新生儿Fc受体(FcRn)介导的再循环机制保护IgG免于溶酶体降解。 IgG在酸性环境中与FcRn结合并在生理pH条件下解离的能力是抗体长半衰期的先决条件。 因此,在体内适合性评估期间,使用基于表面等离子体的测定法在酸性(6.0)和生理学(7.4)pH值下测定IgG与人,食蟹猴(cyno),大鼠和小鼠FcRn的结合亲和力。
3.2.4.2 FcγR结合
测量针对选择的食蟹猴和人Fcγ受体的结合允许预测抗体依赖性细胞毒性(ADCC)功能的存在或不存在。 这些测量是在所有IgG格式上进行的,这些格式旨在增强或消除ADCC功能。
3.2.4.3 非特定绑定
使用蛋白质微阵列研究脱靶或与其他蛋白质的非特异性结合。在Protagen销售的蛋白质微阵列,将384种人蛋白质与另外选择的蛋白质如靶抗原一起点在硝酸纤维素包被的玻璃表面上。理想的候选物仅与其靶抗原结合。有问题的候选物可能对其靶抗原具有优异的结合亲和力,但也表现出与许多斑点蛋白结合的靶标。该测定的目的是为抗体候选物提供多种蛋白质表位,并评估该结合是否限于特定设计的靶标。基本假设是在蛋白质微阵列上观察到的候选物的非特异性或脱靶结合活性可能在体内引起问题,其中候选物将暴露于具有多种蛋白质表位的甚至更复杂的情况。只要这些非特异性相互作用的信号强度保持低于靶抗原信号强度的10%,就可以认为与微芯片上发现的少于10种蛋白质的结合无关。
3.2.4.4 血清稳定性 Serum Stability
在食蟹猴和人血清和血浆或其他相关的体内基质中离体评估蛋白水解稳定性和溶解度,以判断与体内条件的相容性。 将候选物在37℃下以。10mg / kg剂量的浓度温育2周。 采样类似于药代动力学(PK)研究。 通常通过表面等离子体共振测定法监测样品,在平行设置中监测与靶标的结合,以及抗体Fc部分的完整性。
3.2.4.5 大鼠分诊药代动力学
使用单次静脉内注射的简单单剂量大鼠分类PK研究,来确定候选物的分布和半衰期是否与大鼠中人抗体的预期行为相匹配。 使用Gyrolab仪器,使用通用酶联免疫吸附测定(ELISA)样测定监测抗体浓度28天。 在疑似大鼠抗人体抗体反应的罕见情况下,使用基于表面等离子体共振的免疫原性测定来评估各个样品。
该研究并非旨在取代完整的PK研究,而是旨在判断候选药物与动物体内复杂情况的相容性。 理想地,抗体不与大鼠靶标交叉反应以避免任何靶标介导的处置效应。 取消选择具有异常PK概况的候选物。
3.2.4.6 免疫原性风险评估
近年来,在临床前药物开发的早期阶段评估免疫原性的风险变得越来越重要。 开发抗药物抗体(ADAs)的后果可能会有很大差异。 在大多数情况下,针对人抗体药物的抗药物抗体是相对罕见的并且不会造成安全风险 - 与针对人类蛋白质类似物的ADA相反,这可能是严重的安全风险。
用于免疫原性风险评估的计算机方法在第4章中讨论,但由于它们的各种限制,我们使用主要组织相容性复合物(MHC)II类相关肽蛋白质组学。 这些体外实验表征药物与人树突细胞上的MHC II类受体的结合模式。 结合T细胞反应测定数据,评估免疫原性的风险。
3.2.5 关于领导和备份候选物的数据评估和决策
基于在最终分析阶段期间生成的数据对先行和后备候选者的决定,使用先前描述的交通灯系统,绿色指示低,黄色为中等,红色是高发展风险。在分析阶段的可显影性评估的这个实例中,表征了针对可溶性人血清蛋白的单克隆抗体候选物。在根据生物特性识别候选物,并根据第3.1节描述的方法减少候选物数之后,在最终的剖析阶段对四名候选物进行了评估。标记为mAb1和mAb2的两个候选物通过噬菌体展示产生,并且两个标记为mAb3和mAb4,通过杂交瘤技术产生。 mAb1,mAb2,mAb3和mAb4在低皮摩尔范围内具有相似的结合亲和力。四种候选物与预期用于毒理学研究的动物物种中的靶标交叉反应。预期治疗方案是通过皮下注射,并且预期在临床环境中将需要高剂量。四个候选物的可开发性评估结果总结在图7.4中。注意,对于标准抗体形式,不常规确定免疫原性风险和FcγR结合。

图7.4分别针对人血清蛋白的抗体mAb1,mAb2,mAb3和mAb4的可开发性风险评估结果。 n.d.,未确定。
根据这些信息,可以得出以下结论:
mAb1:mAb1的可开发性评估揭示了许多弱点:(1)在加速稳定性评估中在应激条件下聚集的高趋势,(2)在互补决定区域中显着的蛋白水解(剪切),导致候选异质性,和(3) )高蛋白质浓度下的高粘度和聚集倾向。 已识别的弱点的总和导致被认为是高的累积风险。 需要主要的努力和资源来生产和配制这种抗体。
mAb2:发现mAb2的聚集倾向在蛋白A上层析后升高,并且在随后的平台下游处理过程中保持升高。 如前所述,聚集是影响药物效率,下游加工,配方和免疫原性的主要问题。 因此,预期候选mAb2的下游处理需要特殊的努力和资源。 此外,加速稳定性测试揭示了基本变体的形成,这种特性需要特别努力用于药物制剂。 已确定的弱点的累积风险被认为是中等而不是不做决定,而是技术开发工作将超过标准资源需求的标志; 如果没有具有改进属性的替代方案,则应考虑候选物。
mAb3:mAb3显示出不寻常的可开发性特征。 基于评估的可开发性质,发现制造和配制的风险较低,即,从技术可开发性的角度看,表现良好的抗体。 然而,mAb3显示出非典型的药代动力学(PK)谱,在PK研究中具有不常见的快速清除。 例如,快速清除可能是与蛋白质和组织的非特异性结合,或靶标依赖性或非靶标依赖性吸收或内化的结果。 没有详细说明mAb3特殊情况的根本原因。 基于体内健康发展能力类别的发现,mAb3被评为高风险候选者,导致其取消选择,因为没有解决此类清除问题。
mAb4:mAb4的评估揭示了粘度和疏水性方面的中等可开发性风险,以及技术开发的总体低累积风险。 对制剂中常用的赋形剂的快速评估导致粘度降低。 该发现表明,粘度问题很可能通过微小的努力来克服。 因此,选择mAb4作为开始开发活动的主要候选者。
总之,作为可开发性评估的结果,抗体mAb1的累积风险被认为是高,mAb2中等,mAb3高,mAb4的低。 mAb4被选为主要候选物,开发组织开始用该候选物开展研究。发现制造方面的风险很低,而且配方风险被认为是可控的。选择mAb2作为备用候选物。下游处理过程中的聚集倾向和加速稳定性评估后的电荷异质性被确定为风险。制定和优化配方的过程被认为是可能的,尽管资源超过了标准平台过程后通常分配给开发活动的资源。由于在聚集,粘度和完整性方面确定的问题,排除了mAb1。由于在解决体内适应性的研究中的非典型发现,mAb3被丢弃。
2.2.6 高通量早期选择阶段,与最终性能分析阶段的详细表征进行比较
在早期选择过程中,消除了基于生物学特征鉴定的大约90%的潜在候选物。 高通量测定用于产生导致消除大量候选物的数据。 因此,重要的是确保早期选择过程中使用的分析能够预测其在后期开发过程中的行为。
由于大量候选物必须使用高通量测定,因此不能期望这些测定将提供对晚期行为的完美预测。 选择阶段分析的主要目的是取消选择不良候选者,同时避免取消选择可开发的候选者。 因此,选择阶段分析的截止标准被设定为相当低估了表现不佳的候选物,以避免过度预测,这将导致可接受的候选物的取消选择。 后期的分析阶段将提供具有更大覆盖范围的深度表征,这将提供第二过滤器以移除任何剩余的有问题的候选者。
选择和分析空间中涵盖的知识空间如图7.5所示。 快速聚集(表达和纯化期间的聚集,与存储和应激条件下发生的慢聚集相反),构象稳定性,等电点,疏水性和Fab界面稳定性是选择阶段的评估标准。 确认了这些特征,并在分析阶段涵盖了其他标准。

图7.5 在高通量选择阶段(黄色条)和更全面和深入的分析阶段(棕色条)中涵盖的知识空间。(Image reproduced with permission from American Pharmaceutical Review. Copyright 2014 CompareNetworks.)
选择和分析阶段中候选风险类别分配的相关性如图7.6所示。在选择阶段,后来在剖析阶段进行评估的63%的候选人分别被分配到低风险,30%到中等风险,7%到高风险类别。在分析阶段对候选物进行详细描述后,分配了54%的低风险,23%的中等风险和23%的高风险类别。因此,在分析阶段确认了74%的选择阶段风险类别分配。在选择阶段确定的26%的可开发性风险类别分配是根据分析阶段生成的数据进行调整的。在选择阶段被指定为高风险的候选物中有7%在分析期间被确认为高风险候选物,这表明选择通常不会高估可开发性风险。在分析阶段之后可开发性风险类别调整的主要原因是候选物在用于制造和纯化的CHO细胞系中表达的结果,其遵循旨在评估在分析阶段中平台下游处理的适合性的过程。此外,在分析中,候选物的特征还在于高蛋白质浓度和经受应激条件后。体内适应度负债仅在分析阶段确定,因此也有助于选择和分析阶段之间整体风险分配的变化。
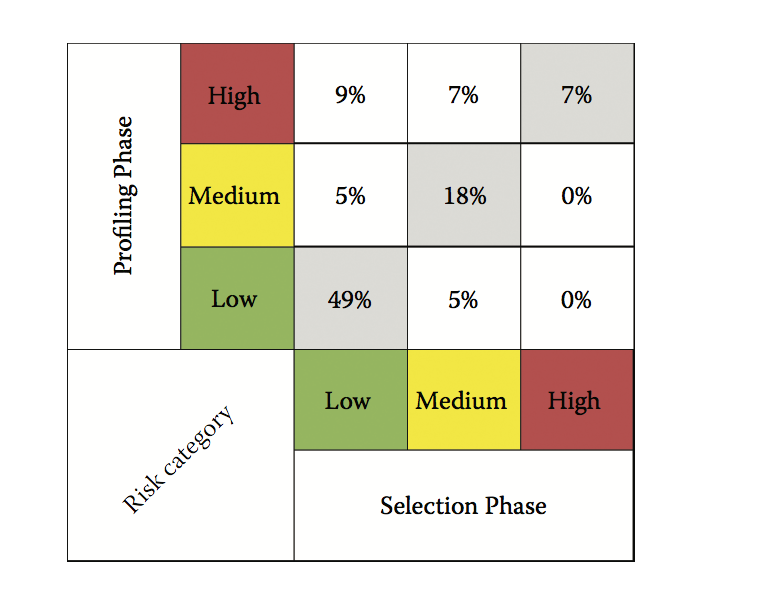
图7.6 选择和剖析阶段的可开发性风险等级的相关性。 在选择阶段,74%的候选风险分配在分析中得到确认(灰色方块的总和)。 在分析阶段收集的其他信息导致26%的案例中风险类别的变化。 (Image reproduced with permission from American Pharmaceutical Review. Copyright 2014 CompareNetworks.)
3.3 用遗传工程提高候选物的质量
人血清中的抗体浓度大多低于用于治疗的浓度范围。因此,例如,在自然环境中没有问题的抗体可能出现高浓度下的聚集和低稳定性。应当理解,仅一部分抗体具有理想地适用于治疗应用的生物物理特性。
因此,可能需要对候选物进行基因工程以获得令人满意的可开发性。通过完善的嫁接和一致性策略可以提高人抗体的热力学稳定性。蛋白质聚集(胶体稳定性)仍然是一个更持久的问题。然而,最近已有可用于增加人抗体VH和VL结构域的胶体稳定性的策略。例如,已经进行基因工程以降低高粘度,低溶解度或聚集倾向风险的候选者需要重新分析其生物学特性和可开发性风险。
四、非抗体蛋白质形式的可开发性评估
抗体可开发性的知识空间在过去几年中稳步增长,大量候选物正在接受评估。纳入/排除标准已经定义并且不断完善。用于快速和高通量定量和纯化的蛋白A层析的可用性极大地有助于评估抗体候选物的可开发性。市售的抗CH1,抗λ或抗κ亲和产物有助于定量和纯化其他形式,如Fab片段,单链抗体和纳米抗体。在其他情况下,需要制定量身定制和纯化的定制解决方案。对于非抗体格式,包含/排除标准也不太先进,因为候选者的数量很少且缺少全面的数据集。然而,表达效价的评估,下游加工的可行性,加工期间和储存时的聚集倾向,给定治疗药物候选物的稳定性,异质性,溶解性,粘度及其可能的变体提供了对可开发性风险的有价值的见解。在项目早期了解发展风险将避免代价高昂的意外。
五、外表 OUTLOOK
进行可开发性评估以识别或优化主要候选物的概念在业界越来越被接受。对生物候选物进行可开发性评估可以判断候选物是否可以作为药物生产和配制,与体内条件相容,或者可能具有安全性责任。开发药物的成本是十亿美元的努力,超过一半的成本是在选择先导分子后产生的。因此,在开展昂贵的开发工作之前,在药物开发过程的早期阶段选择尽可能少负债的候选物是有意义的。此外,可开发性评估还使我们能够确定需求增加的领域,并更好地预测整体开发工作和产品成本。对具有可开发性责任的候选人物放弃或及时再造减少了后来的发展努力。如图7.7所示,在开始技术开发活动之前,综合生物制剂分析单元进行的相对较小的分析工作通过拒绝那些需要过度努力开发的候选物,来降低开发过程的风险,从而提高生产率,加快获得药物的速度给患者,并提供一流的药物。
设计后期制造和临床前开发以适应药物产品的更传统的方法可能导致巨大的成本,延长到达诊所的时间,并且在药物的整个寿命期间增加商品的成本。

图7.7 在开始资源密集型技术开发活动之前,综合生物制剂分析单位(Integrated Biologics Pro ling Unit)进行的小型分析工作的效果。 (1)降低风险的开发过程,(2)提高生产率,(3)加速开发过程,(4)最佳药物。
当然,在体外测定中进行可开发性评估也有其成本。 与体外方法相比,使用计算机方法进行可开发性评估可进一步降低成本,提高通量并缩短时间线。 正是出于这个原因,计算可开发性方法是内部构建的,并且定期评估和验证商业可用的命题。 如所描述的,首先在计算机中鉴定用于翻译后修饰的潜在位点,并随后在体外进行分析测试。 等电点的确定是平台拟合的下游处理的重要参数,是今天仅在计算机中确定的值的示例。 随着计算机方法学的可预测性和可靠性的提高,这些方法学对可开发性评估的重要性将继续增长。
参考资料
- 《Developability of Biotherapeutics》
