【4.2】CAR-T在肿瘤微环境中面临哪些挑战
已上市产品和已有研究显示,CAR-T疗法对于血液肿瘤效果显著。虽然表现各异,但总体来看,CAR-T疗法在治疗难治复发性B细胞急性淋巴细胞白血时可达到约90%完全缓解率,而在治疗B细胞淋巴瘤时可以达到约70%完全缓解率。除此之外,部分临床显示,大约有20%的患者接受CAR-T治疗后可以获得长期生存(即医学上的治愈)。CAR-T疗法对于血液肿瘤的惊人疗效,是目前其他治疗手段所无法达到的。
然而,根据2020年数据显示,中国癌症死亡人数前十的癌症分别是,肺癌71万,肝癌39万,胃癌37万,食管癌30万,结直肠癌29万,胰腺癌12万,乳腺癌12万,神经系统癌症7万,白血病6万,宫颈癌6万。十种癌症占癌症死亡总数达到83%,仅有白血病一项是血液肿瘤。CAR-T技术必须拿下实体瘤。
CAR-T治疗实体瘤的探索一直没有停歇。2015年4月,诺华与宾夕法尼亚大学初步证明了CAR-T疗法在实体瘤中的安全性和有效性。然而四年后的2019年12月,诺华传出消息,将暂时放弃CAR-T治疗实体肿瘤,而临床试验的不顺被认为是导致放弃的原因之一:以间皮素MESOTHELIN为靶点的CAR-T疗法CART-meso临床实验效果并不明显,参与试验的19名患者中,仅有4人达到病情稳定。此外,临床安全性也受到了质疑,2010年Morgan等人报道,一位转移性结肠癌患者在接受靶向HER2的CAR-T治疗后死亡,后发现是CAR-T识别到肺上皮细胞低水平的HER2而触发释放大量细胞因子导致的。科学家指出CAR-T靶向实体肿瘤之所以受到较多限制,主要原因来自于实体瘤的特殊免疫环境。
一、肿瘤微环境对CAR-T细胞造成了哪些阻碍?
实体肿瘤与血液瘤最重要的区别就是实体瘤存在肿瘤细胞微环境(TME)的特点。
肿瘤微环境指的是肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境有着密切关系,它不仅包括肿瘤所在组织的结构、功能和代谢,而且亦与肿瘤细胞自身的(核和胞质)内在环境有关。
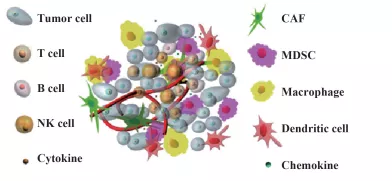
图1:肿瘤微环境
TME的复杂环境往往利于肿瘤生长,而不利于包括CAR-T细胞在内的人体免疫细胞生存。因此,了解肿瘤微环境的机理,对设计可以治疗实体瘤的新型CAR-T疗法具有重大意义,目前已知肿瘤微环境造成的障碍主要有:
1.1 血管障碍与基质障碍
TME在癌细胞从早期浸润到逐渐转移的过程中有利于肿瘤血管生成。这些肿瘤血管是由于位于肿瘤基质中的成纤维细胞(CAFs)和多种生长因子的调控而生成的。(如血管内皮生长因子VEGF、转化生长因子TGF、血小板衍生生长因子PDGF等。)这种TME环境下的异常脉管系统与正常血管结构不同,一方面,TME下的异常脉管系统可以支持适宜肿瘤生长的低氧和酸性环境,另一方面,这种环境会导致T细胞存活率下降,功能衰竭,这些血管屏障使得CAR-T细胞很难在肿瘤内部迁移,同时令肿瘤更易于转移。
TME的基质屏障由结缔组织形成,作为结缔组织,基质屏障本身具有物理上的妨碍作用,阻碍CAR-T细胞无法入内,降低CAR-T运输效率。从构成上来看,这种胞外基质(ECM)包含多种成分,包括胶原蛋白、蛋白聚糖、纤连蛋白、层黏连蛋白等。实体瘤中,胶原蛋白和纤连蛋白提供细胞结构支撑。蛋白聚糖有助于生长因子和细胞因子结合特性。其中,源于基质相关因子诸如ISF-1,IGF-2等能够促进肿瘤细胞的浸润,胞外基质中PI3K等细胞信号则途径调节肿瘤的生长。此外,ECM中的非结构性基质蛋白如如硫酸乙酰肝素蛋白聚糖(HSPG),能够促进肿瘤细胞的增殖与迁移,因此需要增加CAR-T细胞降解富含基质的ECM能力。
1.2 免疫检查点
免疫检查点是维持自身耐受性和调节免疫反应信号通路的关键因子。通过干预与影响T细胞免疫应答发挥作用,保护机体免于自身免疫和炎症的伤害。当免疫检查点无法正常发挥功能时,会引起肿瘤耐受,使得肿瘤细胞逃逸免疫系统的追杀。
例如,程序性死亡因子1(PD-1)会与肿瘤细胞表面的PD-L1结合诱导CAR-T细胞衰竭、凋亡。粘蛋白分子3(TIM-3)也有类似功能,可诱导效应CD8+ T细胞衰竭,促进Tregs的免疫调节功能TIM-3高表达常常提示患者预后不佳。CTLA-4是T淋巴细胞表面表达的一种蛋白受体,与B7-1结合或B7-2结合可下调T细胞的免疫应答。LAG-3可传递抑制信号,降低效用T细胞的杀伤作用,同时能促进Tregs的免疫抑制功能。对这些免疫检查点的了解有助于设计新型CAR-T细胞,提升治疗效果。
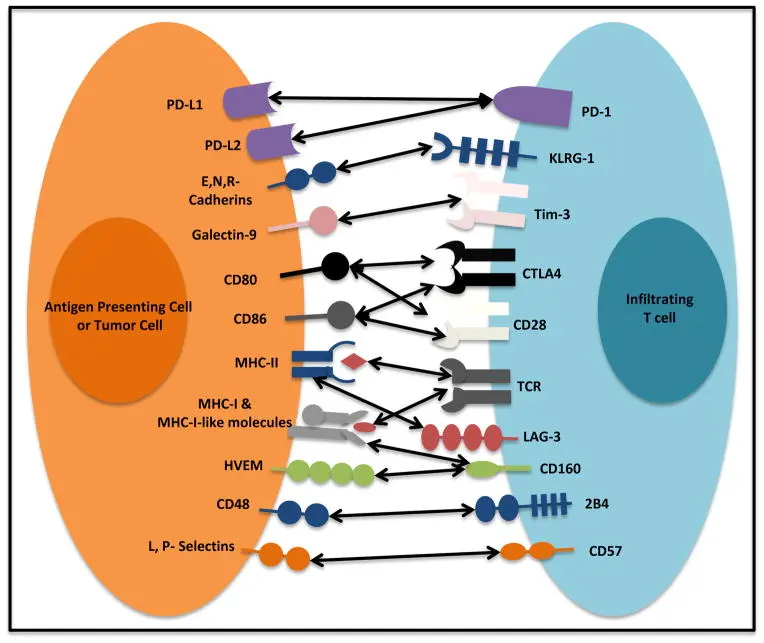
图2:在肿瘤微环境中发现了高水平的多种免疫调节受体
1.3免疫抑制细胞及细胞因子
抑制细胞:
T 细胞(Tregs) 通过其抑制功能来防止由于过度或不必要的免疫激活而导致的自身免疫和组织损伤,在维持自我耐受和免疫稳态中具有重要作用。然而,在肿瘤微环境中,Treg细胞通过其高亲和力IL-2受体从周围摄取IL-2,使其无法用于反应性T细胞。
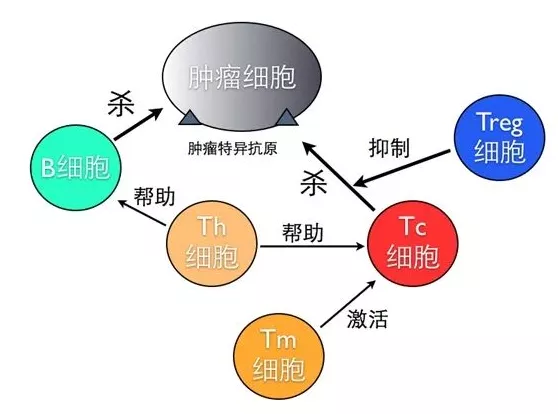
图3:Treg细胞作用示意图
骨髓来源的抑制性细胞 (myeloid-derived suppressor cells,MDSCs)由骨髓经血液循环,流向炎症部位和实体瘤。在TME的炎性环境中,MDSC的两种亚型均可抑制T细胞。
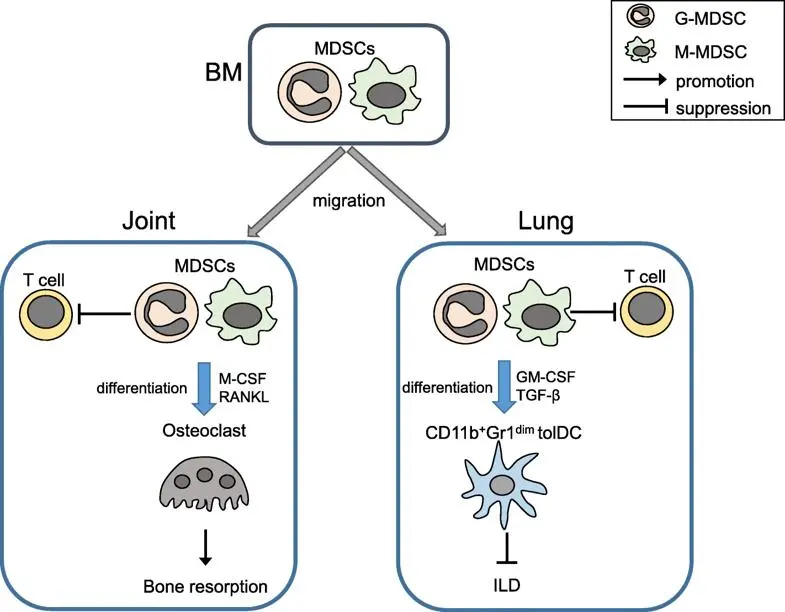
图4:MDSCs作用机理图
肿瘤相关的中性粒细胞( tumor associated neutrophils,TAN)在肿瘤的生长和进展中展现出双重性,TAN可以通过释放ROS和中性粒细胞弹性蛋白酶来介导肿瘤细胞杀伤,通过释放ROS抑制肿瘤细胞转移,并在抑制TGF-β后增强抗肿瘤T细胞反应。同时TAN还可通过释放ROS促进遗传不稳定,通过弹性蛋白酶促进肿瘤细胞增殖;通过释放VEGF、MMP-9 或Bv8维持血管生成;通过可溶性介质增强肿瘤细胞的侵袭性;通过表达由TGF-β驱动的精氨酸酶有效地抑制抗肿瘤CD8 + T细胞免疫反应。
细胞因子:
白介素10 (IL-10),也被称为人类细胞因子合成抑制因子(CSIF),是一种抗炎细胞因子。人体中白介素10是由IL10基因编码的。IL-10信号通过两个IL10同源二聚体与一个由两个IL-10受体-1和两个IL-10受体-2蛋白组成的异源四聚体受体复合物传递。下游通过JAK1和Tyk2分别磷酸化IL-10受体1+IL-10受体2的胞质尾端来诱导STAT3信号传递。 IL10通过活化的巨噬细胞来抑制炎症因子如TNF、IL-6、IL-1的表达。由于IL-10作为一种免疫抑制细胞因子被广泛接受,因此人们认为IL-10可以通过降低肿瘤微环境中的抗肿瘤免疫反应来促进肿瘤免疫逃逸;但也有一些其他研究发现,IL-10对肿瘤患者长期生存所必需的血管生成和转移有根除和抑制作用。
Indoleamine 2,3-dioxygenase 1(IDO 1)是代谢通路中一种非常重要的细胞因子,能够将色氨酸分解为犬尿氨酸。IDO的活性导致了肿瘤微环境中色氨酸的减少以及犬尿氨酸数量的增加。犬尿氨酸主要与芳基碳氢化合物受体(AhR)进行结合,这个受体是免疫细胞的胞内可溶性受体,能够导致调节性T细胞的增殖。因此犬尿氨酸数量的增加会抑制效应T细胞的激活,分化以及活性。而肿瘤细胞能够通过激活抗原递呈细胞IDO活性,实现免疫抑制或者免疫逃逸。
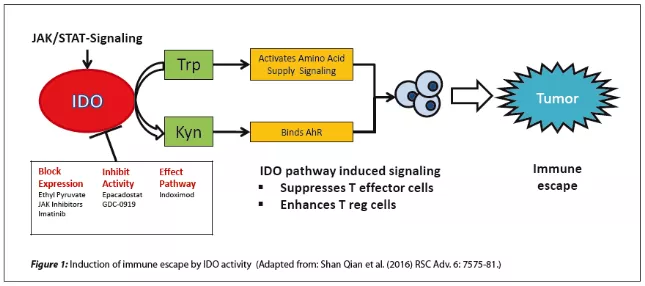
图5:IDO抑制原理
TGF-β细胞因子被证明不仅能直接抑制T细胞的效应功能,还能促进T细胞分化成Tregs,促进Tregs调节免疫功能导致肿瘤细胞逃逸。
此外,还有一部分细胞因子与癌细胞生长情况有直接关系,比如说,IL-6信号通路能够通过IL-6受体调控细胞生长分化,有研究表明IL-6信号通路是非小细胞肺癌的发病机制之一,能够促进该肿瘤生长。在肺腺癌和鳞状细胞癌中,IL-33表达与肿瘤分级及肿瘤大小呈负相关,IL-33 mRNA高表达的肺腺癌患者预后较好。实体肿瘤可过表达趋化因子,如CXCL10、CXCL12、CXCL14等,参与肿瘤的生长、转移及血管。
了解这些与肿瘤生长相关的细胞因子,有助于设计新型CAR-T细胞,提高归巢能力。
1.4 靶点选择问题
实体瘤之间具有高度异质性,可转移性,因此很难筛选到合适的表面抗原,这也意味着在肿瘤转移过程中,原发性肿瘤,继发性肿瘤,或同一肿瘤的不同部位之间,标靶是有可能不同的。
目前大部分研究选用的肿瘤相关性抗原在正常组织中会少量表达,导致CAR-T细胞产生脱靶毒性。顾名思义,脱靶毒性就是CAR-T细胞在攻击癌细胞的过程中,会无可控地攻击正常人体细胞,造成严重后果。上述以HER2作为靶点的CAR-T疗法事故,就是CAR-T细胞错误识别到了结肠癌患者的肺上皮细胞低水平的HER2而触发细胞因子风暴,产生肺水肿导致患者多器官衰竭致死。
此外,在一项靶向表皮生长因子受体变异体III(EGFRvIII)的研究中发现,CAR-T细胞输液后,部分患者中标靶抗原水平降低,疗效并不显著。经检测,患者肿瘤表面的EGFRvIII发生广泛突变,导致CAR-T无法识别变异的抗原。这也意味着肿瘤生长过程中有可能发生突变,导致治疗靶点发生改变。
解决靶点问题,是实体瘤面临的首要任务。目前的热门靶标包括HER2、EGFR、间皮素(mesothelin)、FAP、CD171、PSMA、GPC3、FR、NKG2D等等。
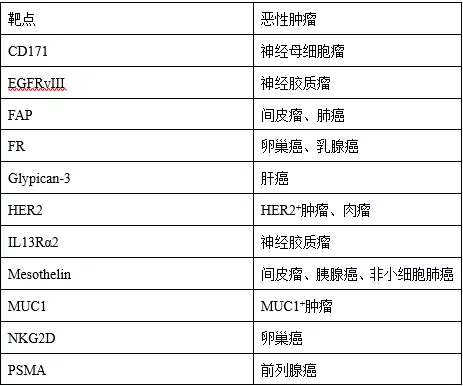
图6:实体瘤热门靶点及对应靶向肿瘤
二、CAR-T细胞针对肿瘤微环境有什么策略?
2.1 提高定向运输能力
使用合适的运输方法对CAR-T治疗有重大意义。如上文所述,CAR-T细胞向实体瘤部位运输效率很低。因此Brown等采用局部递送的方法将 CAR- T 细胞颅内递送至 3 例复发性胶质母细胞瘤患者切除腔中,有两名患者在切除切缘未见肿瘤复发。 运输过程中,T细胞会表达各种趋化因子受体来向肿瘤部位迁移,然而肿瘤细胞表达的趋化因子往往与其不匹配,限制了CAR-T细胞向肿瘤部位的运输。CXCR2,CCL2,CCR2b等趋化因子是导向研究的关键。
2.2 防范脱靶毒性
为了防止CAR-T细胞的脱靶毒性,定向局部/区域注射CAR-T细胞这种方法已经在不同程度上对实体肿瘤患者进行了测试,并取得了一定成功。对转移性乳腺癌患者的一项0期临床表明,在肿瘤内注射c-Met CAR-T是安全的,小鼠实验也证明了这一点。
美国加州大学旧金山分校(UCSF)的研究人员设计了一种“智能”的CAR-T细胞。利用称为synNotch的基因表达调控系统,引导CAR-T细胞识别在部分癌细胞中高特异性表达的EGFRvIII,然后激发识别EphA2或IL13Rα2的CAR的表达。这两种蛋白在所有癌细胞中都表达,进而可以指挥T细胞消灭所有的癌细胞。虽然EphA2或IL13Rα2也在部分健康细胞中表达,但在synNotch系统的调节下,识别它们的CAR只会在迁移到肿瘤中的T细胞上表达,因此健康细胞不会受到这些CAR-T细胞的攻击。
目前,已经开发三类双特异性CAR来解决此类问题,即双重CAR、串联CAR( Tan CAR)和抑制性CAR(iCAR) ,当肿瘤细胞表面同时存在两种靶抗原时,该类型CAR-T细胞才能被激活,显著增强特异性,从而使旁观者细胞不受影响。
2.3 抑制肿瘤微环境中的免疫检查点
抑制肿瘤微环境内部的免疫检查点一直都是抗癌研究的重要部分。PD-1作为免疫检查点的重要部分,在CAR-T技术中也能够运用到。利用CRISPR/Cas9技术干扰T细胞表面PD-1基因的表达(或将其敲除),可以提高细胞因子分泌,增加CAR-T的抗肿瘤能力。这一策略也可以运用于TIM-3、CTLA4等信号回路中,促进细胞生长。目前该策略的成果颇丰。
2.4 避免细胞因子和细胞的抑制作用
抗组织中粒系分化抗原(Gr-1)抗体、抗粒细胞巨噬细胞集落刺激因子(CM-CSF)抗体、信号转导与转录激活子-3(STAT3)可以抑制髓源性抑制细胞MDSCs,防止这些异质性细胞群在肿瘤内转化生长因子(TGF)和白介素(IL)等细胞因子分泌及表达PD-L1结合T细胞上的PD-1,抑制T细胞灭杀作用。
IL-12可通过再活化TIL、募集NK细胞到肿瘤部位及抑制Tregs、MDSCs、TAM的免疫抑制 作用等机制调节肿瘤微环境。
NK细胞活化受体NKG2D与T细胞受体的细胞毒性ζ链融合(NKG2D.ζ-NK),可消灭过表达NKG2D配体的MDSCs,促进CAR-T细胞向肿瘤部位聚集,从而提高CAR-T细胞抗肿瘤作用。
TGF-β-CART细胞可避免TGF-β介导的抑制作用,减少TGF-β诱导T细胞向 Tregs分化,提高CAR-T细胞的细胞毒性作用。著名CAR-T疗法先驱Carl June博士联合创建的Tmunity公司开发的一款新一代CAR-T疗法就采用了表达阻断TGF-β信号通路的策略。尽管目前该款产品在临床中遇到了神经毒性致死的问题,这一策略在胰腺癌中观察到了显著PSA水平下降。
2.5 改变肿瘤微环境的物理结构和生物化学特性
TME中含有高水平的抗氧化剂(如过氧化氢),可干扰CAR-T细胞功能,诱导CAR-T细胞产生过氧化氢酶,可增强CAR-T细胞对氧化应激的抵抗力及抗肿瘤能力。
癌症相关的成纤维细胞(CAF)促进血管生成,有助于实体瘤的进展和转移,因此 Schuberth等构建了靶向成纤维细胞活化蛋白(FAP )的CAR-T 细胞,在体外以抗原特异性方式裂解 FAP 阳性间皮瘤细胞和炎性成纤维细胞,成功抑制了 FAP 阳性人类间皮瘤细胞在小鼠腹膜腔的生长,显著延长了小鼠的生存期。FAP-CAR-T也因此成为目前实体瘤研发的热点。
实体肿瘤中血管异常化生成可阻碍T细胞浸润,促进肿瘤生长。整合素αvβ3 可在某些实体肿瘤血管内皮细胞过表达,而锯鳞血抑肽与整合素αvβ3有高亲和力。CAR-T细胞靶向锯鳞血抑肽(T-eCAR)可通过破坏肿瘤血管生成抑制肿瘤生长,有效缩小肿瘤体积。
T细胞代谢途径的修饰也为抵消免疫抑制性TME提供另一种思路。T细胞的活化增殖以及发挥效应功能需要糖酵解提供能量, 然而肿瘤细胞扩张需要更多的能量,对T细胞的有效活化具有竞争性抑制作用。可以通过在体外培养时限制糖酵解代谢来保留其抗肿瘤活性,如外源精氨酸补充体外培养基抑制T细胞糖酵解代谢,同时促进氧化途径,导致体内细胞持久性和抗肿瘤活性增加。
三、展望未来
根据美国临床试验注册库的数据,以实体瘤作为病症(Solid Tumor)的CAR-T为词条搜索可知,目前共有53项CAR-T实体瘤临床实验正在进行,都处于I期至II期临床,其中共有24项处于II期临床。临床实验绝大多数集中于北美和东亚地区,目前我国已经成为CAR-T实体瘤的第一大临床实验基地。
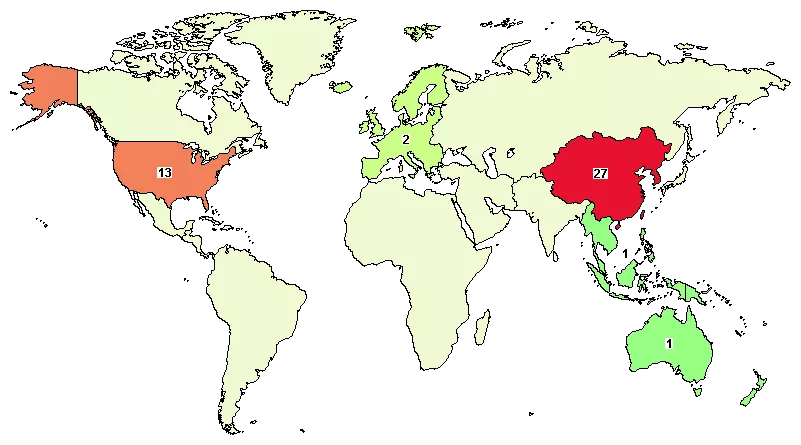
图7:CAR-T实体瘤临床地区分布
对血液系统恶性肿瘤的显著疗效证明了CAR-T在癌症治疗领域有着里程碑式的意义。然而,目前CAR-T细胞治疗实体瘤仍充满了未知。毫无疑问,TME是复杂的。因此,目前CAR-T细胞正在更趋向于通用性,多靶点性,常常与其他靶点药物联用抗击癌症。CAR-T“大牛”Carl June教授在 Frontiers in Immunology上发表了综述,他认为实体瘤治疗形势仍然严峻,CAR-T的治疗窗口应当在安全性确保的情况下进一步扩大。这也是CAR-T细胞疗法未来的趋势。 我们也期待实体瘤CAR-T的临床实验能够为我国患者带来更多的福音。
去年7月,CAR-T大牛Carl June教授还提到了NK细胞疗法,他说NK细胞疗法可能显著推进肿瘤免疫学领域,他相信NK细胞和T细胞领域具有极大的协同作用。那么像NK细胞那样有可能用于协作的免疫疗法又有哪些呢?他们的临床目前又到了什么阶段?
参考资料
- https://xw.qq.com/cmsid/20210325A0EYON00
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3636159/
- 关丽萍,蒋敬庭,吴昌平.CAR-T细胞治疗突破实体肿瘤微环境新策略的研究进展[J].临床肿瘤学杂志,2020,025(003):264-267
- 武少贤,蒋敬庭.基于肿瘤微环境的CAR-T细胞疗法研究现状[J].中国免疫学杂志,2020,036(009):1031-1036
- 徐玉清.CAR-T及CAR-T在治疗实体肿瘤中的应用——前景展望和现实问题[C]//第九届中国肿瘤内科大会、第四届中国肿瘤医师大会暨中国抗癌协会肿瘤临床化疗专业委员会2015年学术年会.2015
- MORGAN R A,YANG J C,KITANO M,et al.Case Report of a Serious Adverse Event Following the Administration of T Cells Transduced With a Chimeric Antigen Receptor Recognizing ERBB2[J]. Mol Ther,2010,18(4):843-851.
- https://baike.baidu.com/tashuo/browse/content?id=954bc47ea628fa8666d5a01e
- https://www.sohu.com/a/335267685_682259
- Brown CE,Badie B,Barish ME, et al. Bioactivity and safety of IL13r alpha2-redirected chimeric antigen receptor CD8 + T cells in patients with recurrent glioblastoma[ J]. Clin Cancer Res,2015,21(18):4062-4072
- Katz SC, Burga RA, McCormack E, et al. Phase I hepatic immunotherapy for metastases study of intra-arterial chimeric antigen receptor-modified T-cell therapy for CEA+ liver metastases [J]. Clin Cancer Res,2015,21(14):3149-3159
- https://www.baidu.com/link?url=2aIWgBG2mHyauEEzdb0sc8mWpa7KRupYZqBiC1utBB8YmaVt_Cy-alshk0WBgwu-ODkVm25bN8dleboS4LnIMoNdnQo9Glepftz22EXzi5O&wd=&eqid=d491efeb00275b4a0000000460b8ee59
- https://clinicaltrials.gov/
