【8.1】肿瘤新抗原
一、基本概念
肿瘤新抗原的定义:
肿瘤新抗原,英文单词“tumor neoantigen”,是一类肿瘤细胞特有的“抗原”,其主要来源是肿瘤细胞基因组的点突变(约占95%)、基因插入敲除以及移码和结构突变(后两者约占5%)。该类抗原的最大特点是肿瘤细胞特有表达,且其它正常细胞不表达,因此也被称为肿瘤特异性抗原。肿瘤新抗原也可以分为通用型新抗原和个体化新抗原,通用型新抗原可以在不同个体或者瘤种之间都有表达,而个体化新抗原则是特异的表达在某一患者体内。
其它肿瘤抗原:
肿瘤新抗原被定义为“新”抗原,顾名思义,肿瘤细胞中也存在“老”抗原,这包括肿瘤相关抗原(tumor associated antigens,TAAs)、肿瘤种系抗原(cancer germline antigens, CGAs)和肿瘤病毒相关抗原。
-
肿瘤相关抗原,是一类在正常细胞中低表达而在肿瘤细胞内高表达的抗原;由于该类抗原在正常细胞中也会表达,因此靶向该类抗原的免疫治疗通常会面临中枢和外周免疫豁免的难题。即使免疫治疗可以起作用,这意味也可能同时带来自身免疫的副作用;
-
肿瘤种系抗原,是一类在正常细胞中不表达而在肿瘤细胞和生殖细胞中表达的抗原;
-
肿瘤病毒相关抗原,由病毒感染诱发的肿瘤,其基因组中可能插入了病毒的基因片段,因此在肿瘤细胞上会表达病毒相关抗原,这类抗原在正常细胞中不表达,因此也是肿瘤特异性抗原。
二、肿瘤新抗原和机体的免疫反应
肿瘤新抗原可以诱导机体产生抗肿瘤免疫反应这主要包括以下几步:
a. 抗原递呈细胞(APC)识别新抗原,并被活化;
b. 活化后的APC迁移到淋巴结,同时通过MHC分子将抗原递呈给CD4+T细胞(MHCII分子)和CD8+T细胞(MHCI分子),最终活化新抗原特异的T细胞;
c. 新抗原特异的T细胞浸润到肿瘤组织中,启动肿瘤杀伤作用;其中CD4+T细胞介导的免疫反应可以改变肿瘤微环境,使得肿瘤细胞更容易被免疫系统识别;CD8+T细胞可以通过T细胞介导的杀伤作用,直接裂解肿瘤细胞,裂解的肿瘤细胞进一步会释放更多的肿瘤新抗原,最终引起更广泛的抗肿瘤免疫反应。
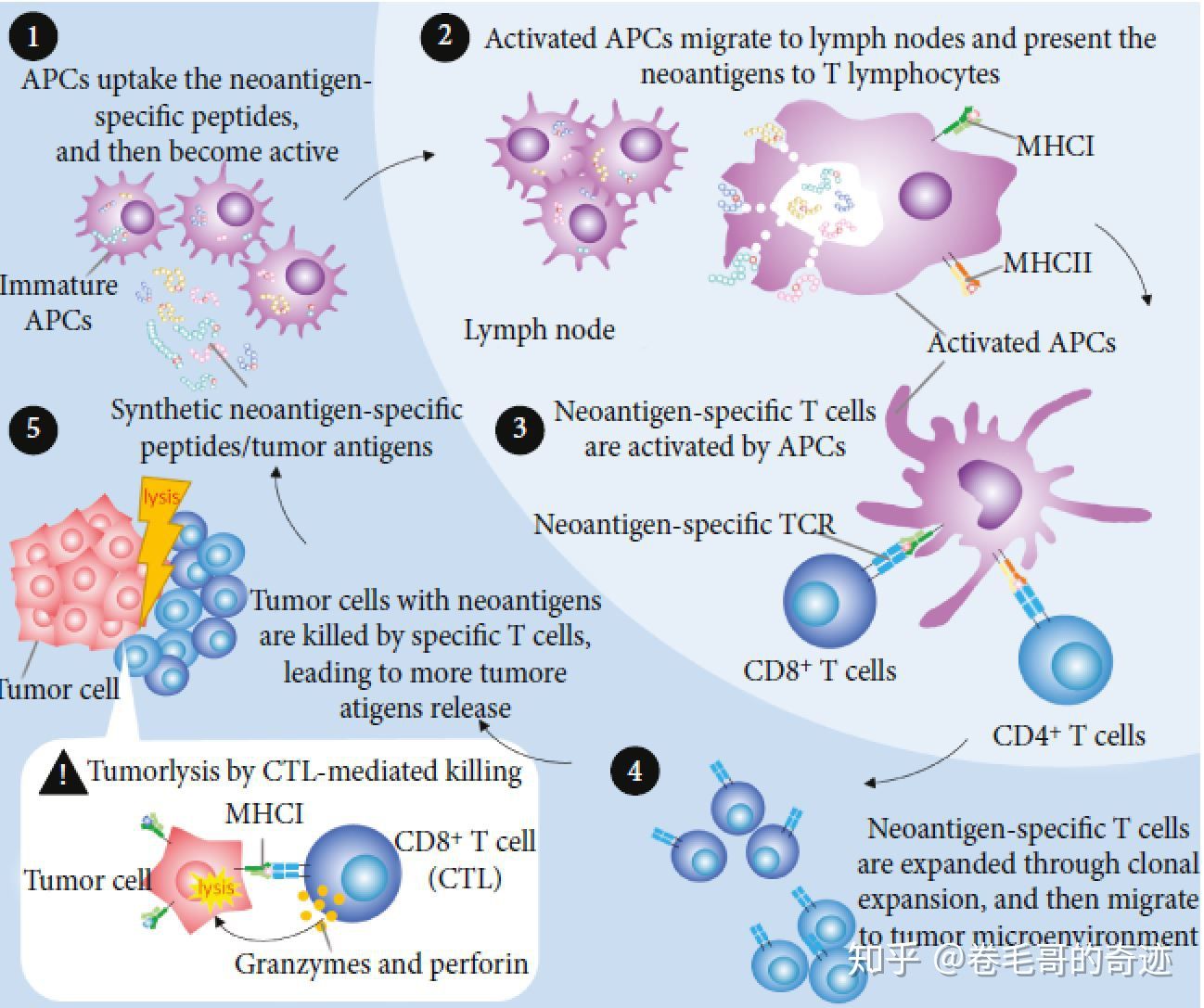
肿瘤新抗原相关的免疫反应
三、肿瘤新抗原的获得
肿瘤新抗原可以通过体内和体外两种方式获取。
肿瘤新抗原的体内获取,在体内可以通过溶瘤病毒、化疗以及放射疗法,直接杀伤肿瘤细胞,从而使肿瘤细胞释放大量的新抗原,诱导机体新抗原特异的肿瘤免疫反应。这种方式在理论上是可行的,但是肿瘤新抗原占所有肿瘤抗原的比例非常小,在体内对肿瘤细胞进行杀伤后,释放出“特异性”的新抗原的同时也会释放大量的其它抗原,从而稀释了新抗原表位的浓度,因此诱导的免疫反应非常有限。
肿瘤新抗原的体外获取,主要有以下几个步骤:
a. 通过手术介入的方法,获得患者的肿瘤组织,随后利用NGS技术进行DNA/RNA全外显子组测序,同时采集患者的外周血淋巴细胞(PBMC)也进行DNA/RNA全外显子组测序,通过差异分析,获取肿瘤细胞特异的基因序列,进而得到新抗原;除了NGS技术外,也可以利用其它技术加以辅助,例如通过质谱的方法,识别在MHC-肽结合物种洗脱下的肽序列,从而确定新抗原。
b. 预测NGS分析得到的肿瘤新抗原和MHC分子的结合能力。这一步骤非常重要,因为新抗原是通过MHC分子进行递呈的,数据显示仅有0.5%的新抗原能够达到筛选标准;用于新抗原预测的算法已经发布很多种,但是成功率非常低,有许多问题需要解决。
c. 检测新抗原激活T细胞的能力。研究发现,不是全部的新抗原都能够引起T细胞的免疫反应,如果新抗原在体外能够活化T细胞,这会大大增加新抗原被用于免疫治疗的潜力;
 肿瘤新抗原的获取
肿瘤新抗原的获取
四、肿瘤新抗原技术在临床的应用
肿瘤新抗原由于其特异的识别特性,因此是非常有潜力的肿瘤杀伤靶标。其在临床主要有以下几个方面的应用:
1、基于新抗原的T细胞过继疗法(adoptive cell transfer, ACT)
,可以通过体内或者体外获取的新抗原活化肿瘤浸润T细胞,再回输给患者进行治疗;
2、DC疗法
利用体内和体外的方法获取肿瘤新抗原,活化分离的患者DC细胞,再回输给患者进行治疗;
3、治疗性疫苗
治疗性疫苗主要是通过体外获取肿瘤新抗原,再辅以合适的佐剂,旨在诱导患者肿瘤新抗原特异的T细胞免疫反应,对肿瘤进行杀伤。目前正在尝试的治疗性疫苗包括:DNA/RNA疫苗、蛋白/多肽疫苗和自体/异体肿瘤细胞疫苗。
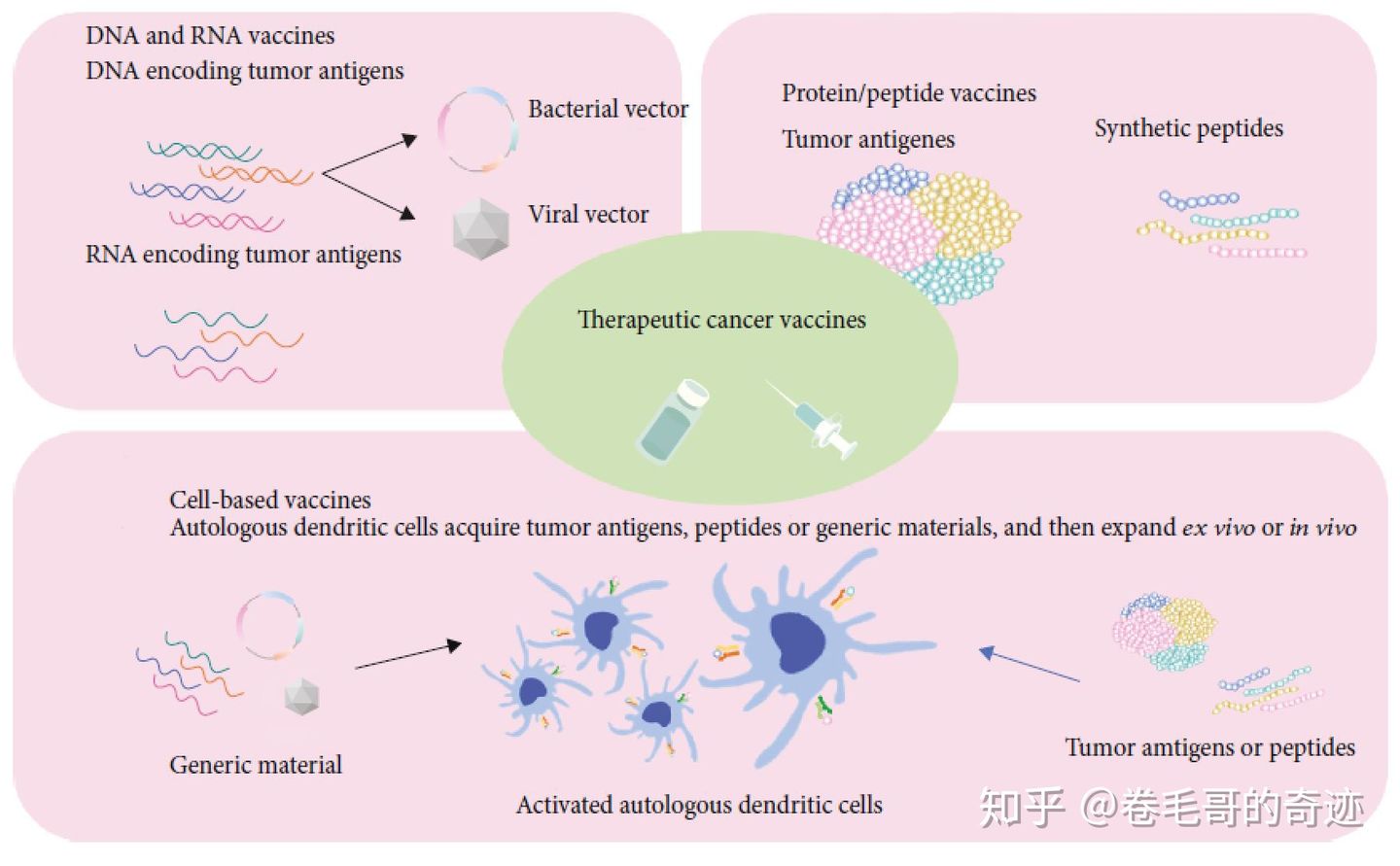 基于肿瘤新抗原的癌症疫苗技术
基于肿瘤新抗原的癌症疫苗技术
五、肿瘤新抗原技术的弊端或者限制:
-
上文已述,肿瘤新抗原的产生源于肿瘤细胞的基因突变,但是两者之间并未发现概率相关性。即使有很多突变的肿瘤,也可能找不到新抗原,即使突变位点极少的突变也可能存在新抗原;
-
肿瘤新抗原的预测软件非常不成熟。肿瘤新抗原的预测基于人工智能的“深度学习”,目前对于新抗原的理论知识所知甚少,缺乏统一的规律性。另外,新抗原在临床的应用非常少,因此也缺乏“深度学习”的案例,这导致新抗原预测软件都存在非常明显的缺陷。
-
不同个体之间以及不同肿瘤类型之间的差异非常大,通用型的肿瘤新抗原获取的难度非常大,几乎每一例患者都是个性化的表达新抗原;
-
肿瘤的免疫逃逸机制。肿瘤组织的微环境是一种免疫抑制的环境,不利于T细胞免疫反应的发生,因此即使新抗原在体外可以诱导明显的T细胞反应,其在肿瘤组织内诱导的T细胞反应的能力依然不能确定;
-
在临床应用时具有费用高和用时长的缺点。虽然现在NGS技术非常成熟,但是由于新抗原的个体差异较大的特征,依然需要不菲的费用用于新抗原的发现。另外,新抗原的GMP生产也需要一笔费用。在生产时长上,目前报道的数据大致在3-5个月,很难满足临床肿瘤患者的需求;另外,在获取新抗原的技术上,需要大量的肿瘤组织,且最终的得率较低,这也是一项急需突破的技术难题;
-
临床试验缺少biomarker。新抗原相关的免疫疗法目前缺乏可靠的biomarker,因此缺乏相应的临床评价机制;
参考资料
- https://zhuanlan.zhihu.com/p/142801928
- Chen F , Zou Z , Du J , et al. Neoantigen identification strategies enable personalized immunotherapy in refractory solid tumors[J]. The Journal of clinical investigation, 2019, 130(5).
- Jiang T , Shi T , Zhang H , et al. Tumor neoantigens: from basic research to clinical applications[J]. Journal of Hematology & Oncology, 2019, 12(1):http://1-13.Li L , Goedegebuure S P , Gillanders W E . Preclinical and clinical development of neoantigen vaccines[J]. Annals of Oncology, 2017, 28(suppl_12):xii11-xii17.
- Peng M , Mo Y , Wang Y , et al. Neoantigen vaccine: an emerging tumor immunotherapy[J]. Molecular Cancer, 2019, 18(1).
- Pan R Y , Chung W H , Chu M T , et al. Recent Development and Clinical Application of Cancer Vaccine: Targeting Neoantigens[J]. Journal of Immunology Research, 2018, 2018:1-9.Schumacher T N , Schreiber R D . Neoantigens in cancer immunotherapy[J]. Science, 2015, 348(6230):69-74.
- Yi M , Qin S , Zhao W , et al. The role of neoantigen in immune checkpoint blockade therapy[J]. Experimental Hematology & Oncology, 2018, 7(1).
