【7.8.2.9】c-MET
MET(mesenchymal to epithelial transition factor,间质表皮转化因子)
一、 MET基因介绍
MET基因又称间质上皮转化因子(Mesenchymal to epithelial transition factor),位于7号染色体长臂,主要在质膜上表达,基因结构主要包括Sema结构域、近膜结构域及激酶结构域等。c-MET作为跨膜蛋白,分为胞外区、跨膜区以及胞内区。胞外区仅包含α亚基,跨膜区和胞内区包含α亚基和β亚基,并且α亚基和β亚基依靠二硫键形成异二聚体,组成c-MET跨膜蛋白受体。简言之,MET基因表达形成了c-MET蛋白。
1991年Bottaro等首次发现肝细胞生长因子(HGF,Hepatocyte growth factor)作为c-MET蛋白的配体,同时也确立了HGF/c-MET信号通路的形成,为今后该信号通路的探索开创了先河。HGF作为c-MET蛋白的配体,主要表达在间充质细胞和成纤维细胞旁分泌因子,也可能在某种特定的情况下在非激活状态下的肿瘤细胞产生,通过二聚化或二磷酸化进行激活,同时与c-MET蛋白受体结合,激活酪氨酸激酶,进一步激活下游信号通路(PI3K-AKT通路、RAS-MAPK通路、JAK-STAT通路以及WNT通路),同时这些通路的激活与肿瘤的发生和发展密切相关。
二、MET基因突变类型以及致癌机制
基因突变主要包括单核苷酸突变(SNV)、短片段插入或缺失(Indel)、拷贝数变异(CNV)以及基因融合(SV)。针对MET基因突变,以上几种突变情况均有存在。在乳头状肾细胞癌中发现胚系或体细胞突变,以及在肺肉瘤样癌一种独立的分子亚型中,出现一种罕见的外显子剪接突变—MET exon14跳跃突变等。SNV突变如图1所示:
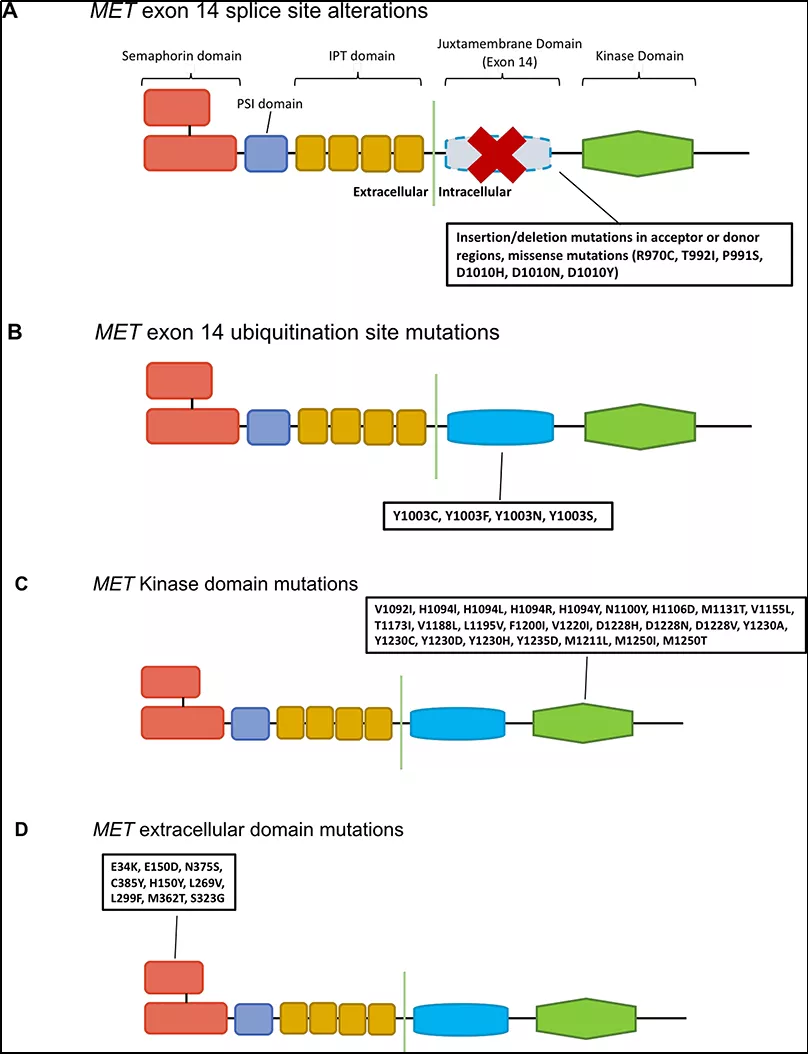 图1: MET基因不同结构域突变示意图
图1: MET基因不同结构域突变示意图
其中,SNV包括MET exon14附近区域的突变,在RNA前体剪接形成mRNA时,主要影响到剪接供体或受体的改变导致exon14被剪掉的情况(图1A);还包括MET exon14 Y1003位点的突变(图1B),作为CBL直接结合位点,CBL是E3-泛素连接酶,可促进c-MET蛋白降解。当c-MET蛋白需要进行泛素化降解时,c-CBL 酪氨酸激酶结合域(TKB)和MET基因上近膜结构域酪氨酸残基(Y1003)结合,导致c-MET蛋白降解;当该区域缺失时,会导致c-MET受体泛素化降低,c-MET蛋白降解降低,最终导致下游信号通路的持续激活,从而导致肿瘤发生。除此之外,一些MET基因激酶结构域的SNV影响了激酶的激活(图1C),可能与MET激酶抑制剂耐药机制相关;还有一些位于MET基因胞外结构域的突变(图1D),对MET激活方式仍存在争议。
相关MET exon14跳跃突变研究统计,共933例非鳞状的非小细胞肺癌中,存在28例(3%)患者发生MET exon14突变,并且MET exon14跳跃突变定义了非小细胞肺癌的独特分子类别。其机制与Y1003突变类似,MET exon14 跳跃突变导致CBL直接结合位点丢失,最终导致c-MET蛋白积累与信号途径激活。28名患者均对MET exon14外显子剪接供体和剪接受体产生了影响,发生了MET exon14跳跃突变,如图2所示:
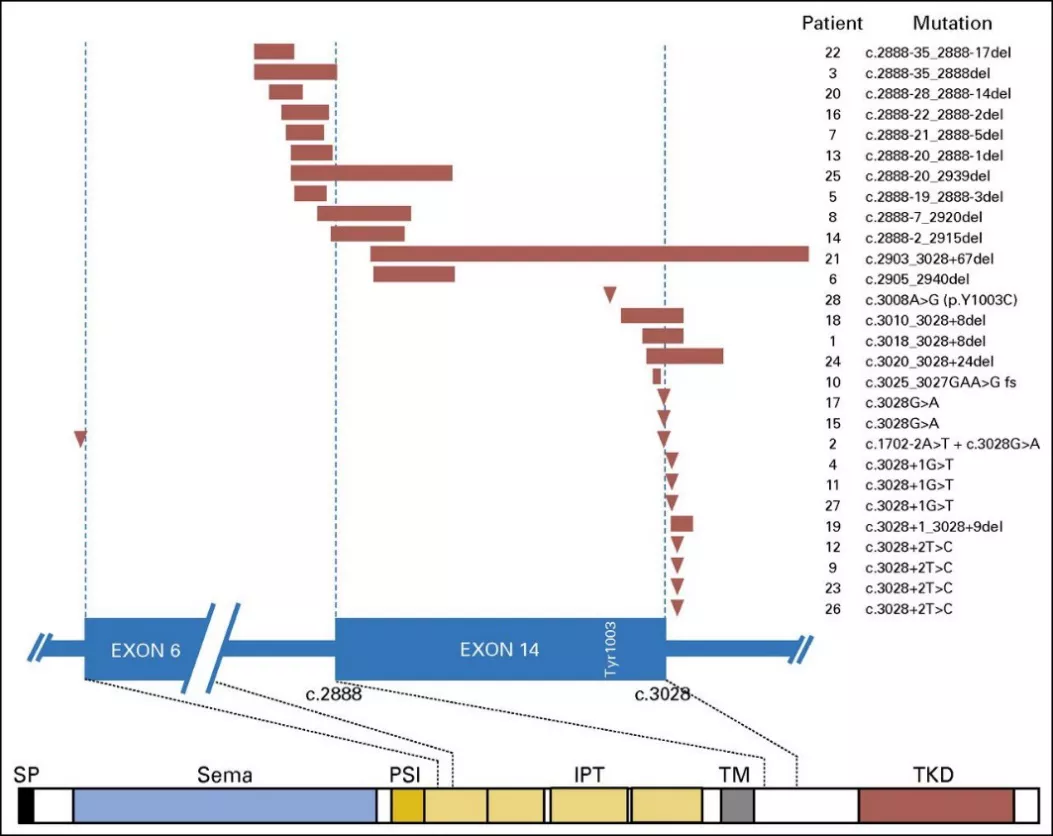
图2:28例肺癌患者携带MET基因的突变位点
其次,早在1984年Cooper等在骨肉瘤细胞系中发现与TPR基因融合,形成第一个MET/TPR融合蛋白,并且基于此项研究,首次确认MET基因为原癌基因。除此之外,有相关融合伴侣在文章中报道,如图3所示:
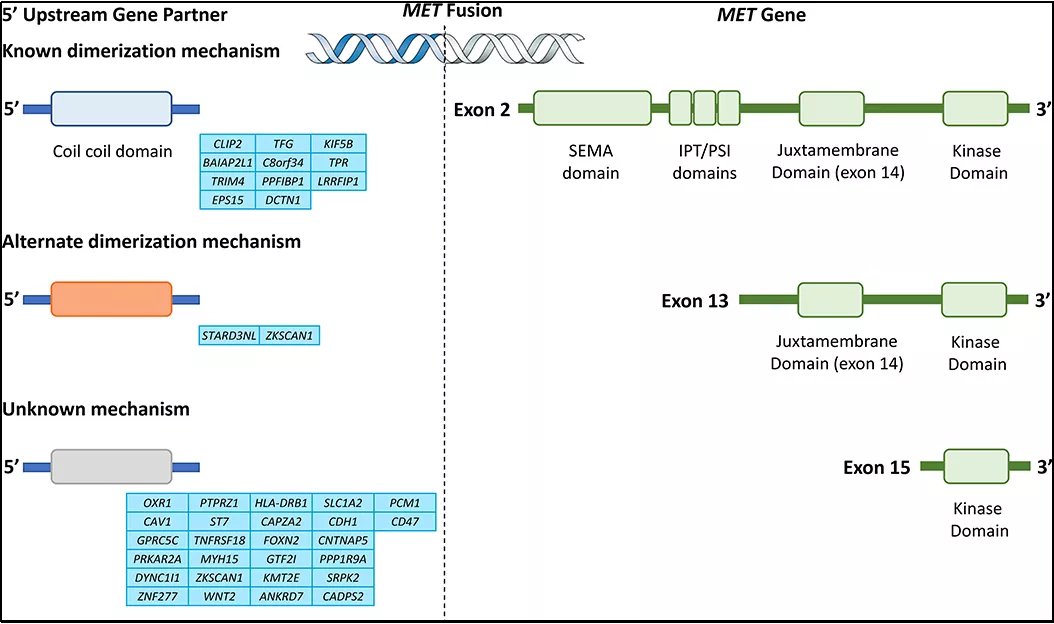 图3:MET基因融合伴侣断点区域示意图
图3:MET基因融合伴侣断点区域示意图
MET融合在不同癌种中均有发生,主要有乳头状肾细胞癌、低级别脑胶质瘤、肺癌、肝癌以及甲状腺癌等,并且不同的融合断点的位置与MET基因激活方式不同,如图4所示:
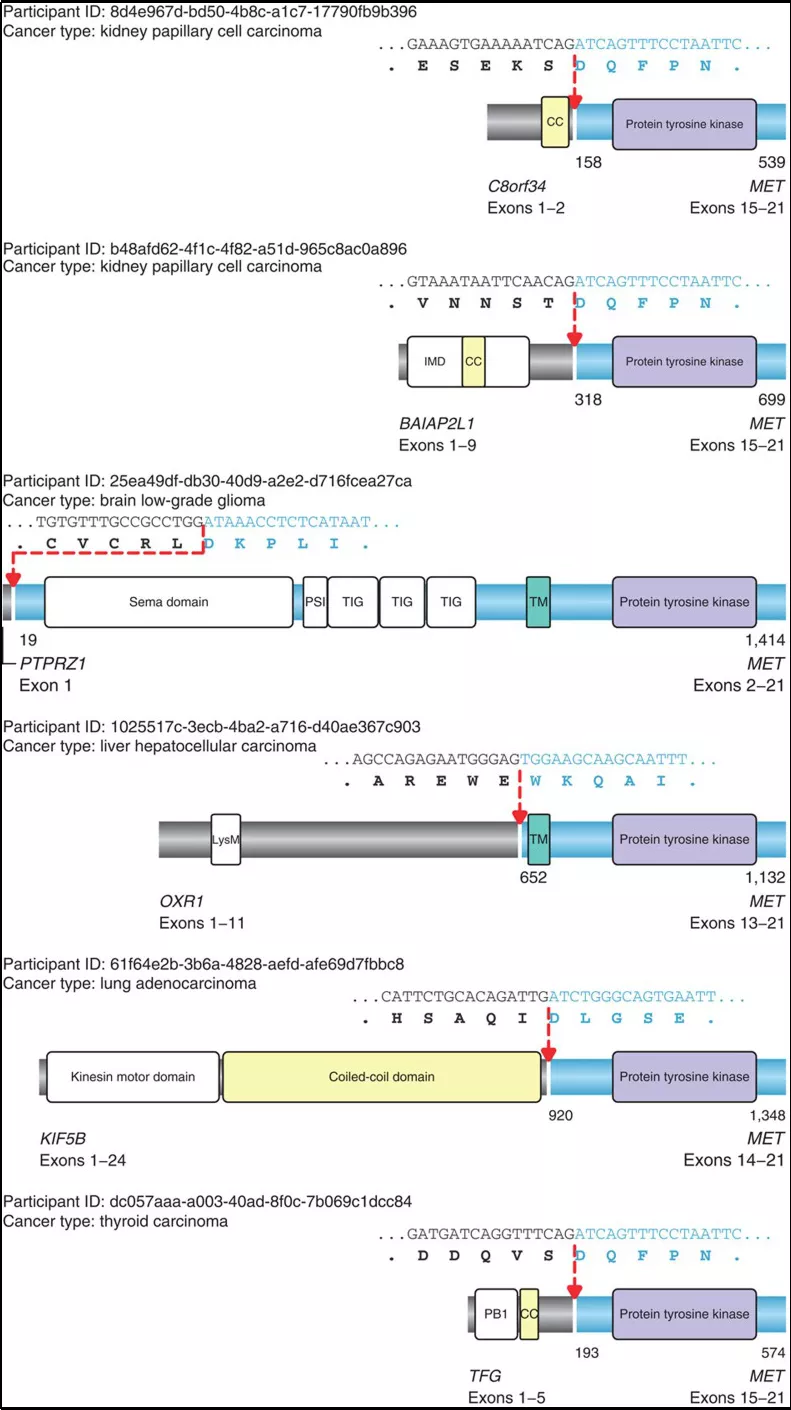
图4:不同癌症中MET基因融合断点
部分融合依赖于该基因exon14的丢失,激活途径与exon14跳跃激活途径类似;另一部分融合则为直接通过融合exon14以外的激酶结构域,导致配体非依赖性组成MET活化,最终影响MET基因表达的增加导致癌症的发生与发展。更惊奇的发现,后者融合致癌活性高于前者。
MET基因拷贝数增加,在胃癌、乳头状肾细胞癌以及对EGFR酪氨酸激酶抑制剂(TKI)耐药的肺癌等发生频率较高,主要是通过基因拷贝数增加,导致c-MET蛋白表达的积累,受体活化,最终导致信号途径的激活。检测基因扩增的方法主要是荧光原位杂交法(FISH)或第二代测序(NGS),都可作为MET基因CNV检测的方法。MET基因扩增如图5所示:
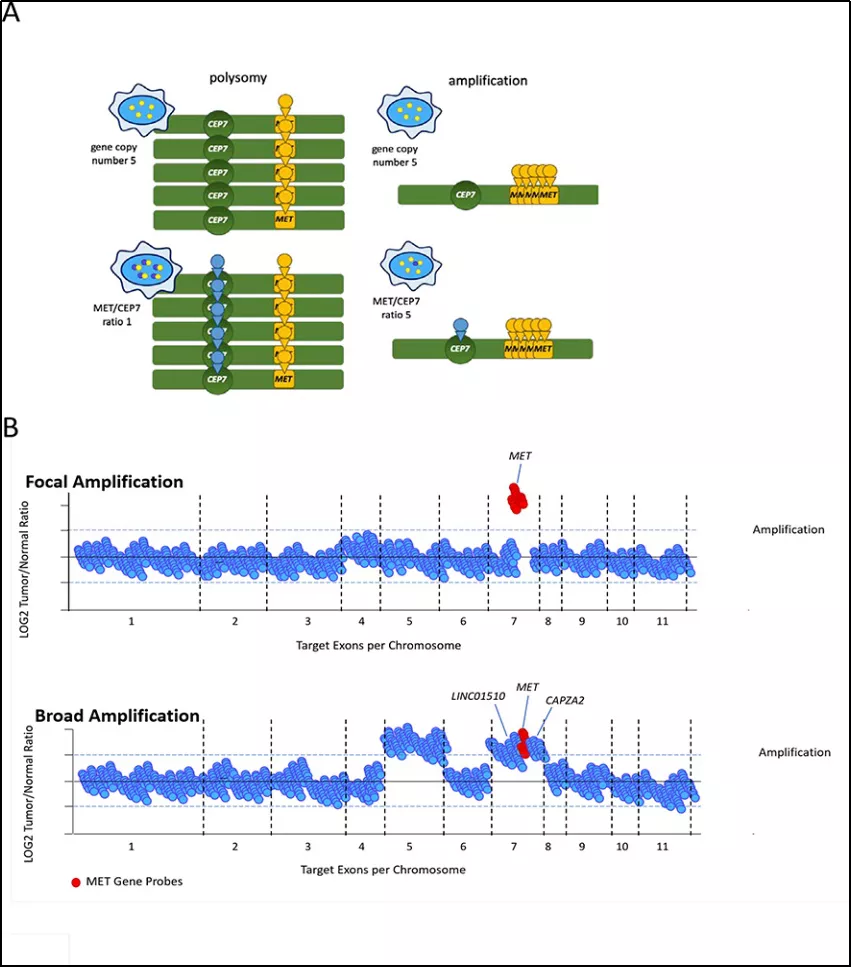
图5:MET基因拷贝数扩增示意图
MET基因扩增作为肺癌获得性耐药的重要机制之一,占比为5-20%,一般预后可能不佳。相关研究表明,NSCLC EGFR TKIs耐药机制是基于c-MET蛋白过表达,诱导ERBB3 (HER3) 活化,进一步激活PI3K/AKT,从而使EGFR TKIs发生耐药。除此之外,在乳头状肾细胞癌、胃癌、肝癌等癌种中,也有相关基因扩增的报道。
三、MET抑制剂获批适应症
在NSCLC中,针对MET exon14跳跃突变,美国食品药品监督管理局(FDA)已有两款MET抑制剂获批,分别为诺华公司的卡马替尼(capmatinib)和默克公司的特泊替尼(Tepotinib)。
四、小结
目前,c-MET靶点在不同的癌种中存在各种类型的突变,其突变最终影响是基于c-MET蛋白过表达来进一步激活下游信号通路以及致癌性转化,最终导致癌症的发生与发展。c-MET小分子抑制剂对依赖HGF/c-MET信号途径激活的肿瘤细胞具有明显的抑制作用,同时也是肿瘤患者对抗癌症的重要武器。
略
=====
====
1. 靶点机制(图 50)
MET 编码合成的蛋白 c-MET,是一种可以与肝细胞生长因子(hepatocyte growth factor, HGF)结合的受体酪氨酸激酶。c-MET 通路正常表达时可促进组织的分化与修复,当表达或调节异常时则可促进肿瘤细胞增殖与转移。MET 通路异常激活存在于诸多实体瘤中, 包括脑瘤、乳腺癌、结直肠癌、胃癌、头颈癌、肺癌、肝癌、皮肤癌、前列腺癌及软组织 肉瘤等。MET 通路的异常激活可以通过非 HGF 依赖性机制发生,主要包括 MET 14 外显 子跳跃突变、MET 扩增/重排和 MET 蛋白过表达等。目前认为,MET 高水平扩增和 14 外 显子跳跃突变是 2 种可治疗的变异,在非小细胞肺癌患者中发生率约 5%。临床上的 MET 抑制剂分为 2 大类:小分子激酶抑制剂和单克隆抗体。小分子酪氨酸激酶抑制剂包括卡博 替尼、克唑替尼和赛沃替尼等,以及部分多靶点激酶抑制剂。
高度选择性 MET 激酶抑制剂已经上市的有美国 FDA 批准默克公司的特泊替尼 (Tepotinib)和诺华公司的卡马替尼(Capmatinib),用于治疗 MET 14 外显子跳跃突变的 非小细胞肺癌。另外,强生旗下杨森公司开发针对 c-MET/HGFR 和 EGFR 的双特异性抗 体 Amivantamab,被证实在 MET 扩增亚组患者中比 TKI 耐药 EGFR 突变的非小细胞肺癌 患者中活性更强;除用于治疗 MET 扩增外,Amivantamab 也用于治疗 EGFR 20 外显子插 入突变的非小细胞肺癌。
2. 临床研究申报概况
2022 年,国内外药企在中国申请开展的围绕抗 MET 单靶点或多靶点抑制剂的研究 有 14 项,其中 4 项进入III期,均为国际多中心研究,包括评价拉泽替尼(Lazertinib)联 合皮下注射埃万妥单抗(Amivantamab)与埃万妥单抗静脉内给药或皮下给药治疗奥希替 尼和化疗后进展的 EGFR 突变晚期或转移性 NSCLC 研究;比较赛沃替尼联合奥希替尼与 含铂二联化疗治疗既往奥希替尼进展的 EGFR 突变 MET 过表达和/或扩增的局部晚期或 转移性 NSCLC 的研究;比较赛沃替尼+度伐利尤单抗与舒尼替尼和度伐利尤单抗单药治 疗 MET 驱动、不可切除和局部晚期或转移性乳头状肾细胞癌的研究;抗体偶联药物 Telisotuzumab Vedotin(ABBV-399)和多西他赛治疗既往接受过治疗的 c-MET 过表达、 EGFR 野生型、局部晚期/转移性非鳞状 NSCLC 的研究。在I/II期研究中,5 项为 MET 选 择性抑制剂,TQ-B3139、SPH3348 在健康人群中进行早期的吸收、代谢和排泄临床研究; 伯瑞替尼在 2022 年 9 月拟纳入 CDE 优先审评,用于 MET 14 外显子跳跃突变的局部晚期 或转移性 NSCLC 患者,目前正在开展健康受试者空腹单次口服生产场地变更前后的人体 生物等效性试验;TPX-0022 和 ASKC202 正在开展实体瘤的I/II期研究。EGFR/MET 双 特异性抗体 EMB-01 有 2 项研究正在进行,一项是单药治疗晚期/转移性消化系统癌症患 者的研究,另一项为 EMB-01 联合奥希替尼治疗晚期/转移性 EGFR 突变型 NSCLC 患者 的研究。荣昌生物的 ADC RC108 也在 c-MET 阳性晚期消化系统恶性肿瘤患者中开展了 有效性、安全性和药代动力学的IIa 期临床研究。嘉和生物的 EGFR/cMET/cMET 三特异 性抗体 GB263T 治疗晚期 NSCLC 和其他实体瘤患者的国际多中心的I/II期临床研究也在 进行中。
资料来源:Drilon A,Cappuzzo F,Ou SI,et al.Targeting MET in lung cancer:will expectationsfinally be MET?[J].J Thorac Oncol,2017,12(1):15-26.doi:10.1016/j.jtho.2016.10.014.Epub 2016 Oct 26.PMID: 27794501; PMCID:PMC5603268.
3. 简评
MET 抑制剂对于 MET 各种类型变化形式均展现出一定的疗效,但与针对 EGFR、 ALK、ROS1 等不断迭代的靶向药物一样,包括针对 MET 抗体在内的各种 MET 抑制剂的作用位点、相关机制和特点都不尽相同,因此,在疗效上存在差异,不良反应的特点也轻 重不一。目前,国内外已经有超过 80 项的 MET 抑制剂相关临床研究正在如火如荼地进行, 竞争异常激烈,而最终疗效和安全性将最终决定哪种产品能够胜出。考虑到 MET 突变的为 少见突变,因此,未来的众多产品都要开展临床研究和上市必将进行一番激烈的角逐
参考资料
- https://mp.weixin.qq.com/s/8luT1Qmhpf1FgN5SO2b7wA
- 《2022年度中国抗肿瘤新药临床研究评述》
