【7.8.2.7】KRAS(RAS)
KRAS(Kirsten rat arcomaviral oncogene homolog,Kirsten 大鼠肉瘤病毒癌基因同源物)
一、背景
RAS是第一个被发现的人类肿瘤基因(oncogene)。
19世纪末,巴斯德等巨匠的研究让现代医学在抗感染领域获得巨大成功。1876年,一个俄罗斯人成功地将肿瘤组织从一只狗移植到另外一只狗。1908年,两个丹麦科学家发现母鸡白血病细胞中的提取物可以让其它鸟类感染白血病。这些观察和研究让人们相信肿瘤也是病毒所致的传染病。
1910 年,洛克菲勒研究所的 PeytonRous 从一只来自纽约长岛的母鸡中发现了第一个肿瘤病毒 Roussarcomavirus(RSV,劳氏肉瘤病毒)。此后,一系列导致动物肿瘤的 RNA 和 DNA 病毒相继被发现。致病机理也得到了合理地解释:这些病毒(RNA病毒通过逆转录酶)可以将肿瘤基因整合到被感染的宿主细胞中,诱导恶变并维持肿瘤细胞的无限分裂。发现RSV的PeytonRous和发现RNA病毒逆转录酶的HowardTemin分别获得1966年和1975年的诺贝尔生理医学奖。至此,人们深信肿瘤是一种病毒导致的疾病。
直到1974年,UCSF 的 J.MichaelBishop 和他的博士后 HaroldVarmus 通过 DNA 探针意外发现未被感染的正常细胞中也存在此前 RSV 病毒中发现的肿瘤基因 src。原来肿瘤基因早就存在于宿主的基因组当中,远古时期,病毒从宿主细胞中获得这些基因片段并加以改造,也就是说病毒所携带的肿瘤基因其实来自我们自身。这些发现打开了以基因变异为基础的现代肿瘤生物学的大门。Bishop 和 Varmus 也因此在 1989 年获得了该领域的第三个诺贝尔奖。
Harvey 和 Kirsten 等人在 60 年代分别发现了类似于 RSV 的逆转录病毒携带的老鼠肿瘤基因 HRAS 和 KRAS。1982 年,Weinberg 等实验室在人类膀胱癌细胞T24/EJ中也发现了HRAS,使得RAS成为第一个被发现的人类肿瘤基因。
50多年过去后,RAS基因被发现是肿瘤中最常见的突变基因之一,30%的肿瘤携带RAS变异,如果算上RAS调控因子和信号通路上下游的变异,几乎覆盖所有肿瘤,RAS变异每年造成一百万以上的病人死亡,无愧是肿瘤基因之王。这也令人非常好奇,RAS到底具有什么神奇功能,令肿瘤细胞如此依赖?
二、 KRAS
2.1 KRAS基因的概念
KRAS基因的全名叫Kirsten rats arcomaviral oncogene homolog,翻成中文是“Kirsten大鼠肉瘤病毒癌基因同源物”。KARS基因编码的蛋白是一种小GTP酶(smallGTPase),它属于RAS超蛋白家族。
2.2 KRAS基因的分类
在人的基因组中,有 2 个 KRAS 基因。一个是 KRAS1,位于第6号染色体的短臂上;另一个是 KRAS2,位于第 12 号染色体的短臂上。其中,KRAS1 是“假基因”,不能被转录成 RNA,所以它是没有功能的。而KRAS2才是“真基因”,能够转录、并且翻译成蛋白,具有生物学活性。
Note:通常公司和文献报道中所研究的KRAS基因和蛋白,是指“KRAS2”基因及其蛋白产物。
KRAS基因属于RAS基因家族。RAS基因家族当中,还有NRAS (neuroblastoma-RAS)和HRAS (Harvey-RAS)。HRAS、KRAS和NRAS,分别定位在11、12和1号染色体上,都参与细胞内的信号传递。
KRAS蛋白有 2 种变体。这 2 种变体,是因为第 4 号外显子在 RNA 的剪接过程中,有 2 种不同的剪接方式,就得到了 2 种 mRNA,进而翻译出 2 种蛋白质(变体)。这 2 种蛋白质分别被称为“KRAS4A”和“KRAS4B”,KRAS4B的表达量明显多于KRAS4A的表达量,一般情况下,KRAS4B是KRAS4A的5倍。
2.3 KRAS蛋白的结构和位置
KRAS蛋白质有188个氨基酸,它的分子量是21.6KD。拥有GTPase酶活性的鸟嘌呤核苷结合蛋白。
KRAS蛋白定位在细胞膜的内侧,通过一个法呢酰基(Farnesyl)的修饰基团【1】,连到细胞膜上。法呢酰基,是通过翻译后的蛋白修饰,在法呢酰基转移酶【2】的作用下,加到KRAS蛋白上的【3】。

2.4 KRAS相关通路
上游信号通路
正常细胞中,细胞膜上的EGFR、HER2、ErbB3和ErbB4等受体单体与细胞膜外配体结合形成二聚体,二聚体自身磷酸化,再磷酸化下游的信号蛋白。其中一条信号通路可激活Grb2-Shc,再激活SOS蛋白,进而可激活KRAS蛋白。
KRAS通路
在细胞内,KRAS蛋白在失活和激活状态之间转变,当KRAS与鸟嘌呤核苷二磷酸(GDP)结合时,它处于失活状态,当它与鸟嘌呤核苷三磷酸(GTP)结合时,它处于激活状态,并且可以激活下游信号通路。
下游信号通路
大部分细胞中的KRAS处于失活状态,当它被激活后,可以激活多条下游信号通路,其中包括MAPK信号通路,PI3K信号通路,和Ral-GEFs信号通路。这些信号通路在促进细胞生存、增殖和细胞因子释放方面具有重要作用。
2.5 KRAS活性的调节因子
KRAS在失活与激活状态之间的转换受到两类因子的调节。
一类是鸟嘌呤核苷酸交换因子(GEF),这类蛋白催化KRAS与GTP的结合,从而促进KRAS的激活,其中包括SOS蛋白(属GEFs/鸟苷释放因子/鸟苷酸交换因子)。
另一类是GTP酶(GTPase)激活蛋白(GAPs),这类蛋白能够促进与KRAS结合的GTP水解成为GDP终止活性状态,从而抑制KRAS的活性。

2.6. 调节过程
a) RAS是GDP/GTP循环控制的二进制分子开关:KRAS蛋白未被激活时,与GDP紧密结合,处于“关”的状态;接收到信号后,鸟苷酸交换因子GEFs(SOS)被招募到细胞膜上与RAS结合并释放GDP,KRAS被SOS蛋白激活后,转到与GTP结合。
b) 与GTP结合的KRAS蛋白,具有磷酸激酶的活性,代表“开”的状态,可进一步激活下游蛋白。
Note:没有刺激信号时,这种关开状态的转换非常缓慢。
c) 被激活的下游信号蛋白:Raf蛋白家族、PI3K蛋白、PLC-ε、RALGDS、TIAM1、RIN1等下游蛋白【1】。
d) 下游信号通路打开后,进一步激活再下游信号通路【2】,进而启动细胞增殖、细胞迁移等细胞功能【3】

三、KRAS致癌基因的突变
由于 RAS 在许多重要细胞信号网络的轴上处于中心位置,因此它们与许多癌症标志有关。RAS蛋白之所以如此命名,是因为它们首先是在由强致癌性病毒引起的大鼠肉瘤的研究中被鉴定出来的。RAS是人类癌症中最常出现突变的致癌基因,目前已经在所有人类肿瘤的大约1/5中发现了突变引起的RAS蛋白激活。
而KRAS是RAS家族中最常出现的亚型,KRAS基因突变占RAS基因突变总数的85%(NRAS(12%)次之,HRAS(3%)最少)。在人类癌症中,KRAS基因突变出现在接近90%的胰腺癌中,30-40%的结肠癌中,17%的子宫内膜癌中,15-20%的肺癌中(大多为NSCLC)。它也会在胆管癌、宫颈癌、膀胱癌、肝癌和乳腺癌等癌症类型中出现。也就是说,在上述多种癌症中,有高比例的KRAS基因突变。

在KRAS的基因突变中,97%是第12号或者第13号氨基酸残基发生了突变。其中最主要的是G12D、G12V、G13D这三种突变。结构学研究表明,这些基因突变大多干扰KRAS水解GTP的能力。
KRAS基因的三种主要突变

KRAS与GDP或GTP的结合力非常强,它(KRAS)与GTP结合的亲合系数在PicoMolar(皮摩尔浓度)级。当KRAS与GDP结合时,没有激酶活性;而当KRAS与GTP结合时,有激酶活性。野生型的KRAS与GDP结合,还是与GTP结合,受到上游信号调控。
当KRAS发生G12D、G12V、G13D这几种突变后,会通过破坏GAP活性,KRAS会一直保持与GTP结合,将KRAS锁定在有酪氨酸激酶活跃状态,并不断激活下游信号通路(如PI3K,RAF-MEK-ERK(MAPK),RAL-GEF等)。这些下游的信号通路打开之后,就会刺激细胞增殖、迁移,最终促成肿瘤发生。
我们打个比方来说明这种突变的后果:将KRAS比作银行金库(细胞增殖、迁移能力)的保管员。正常情况下,只有银行行长(上游信号蛋白)带着钥匙(激活信号)来,保管员(KRAS)才能打开金库(细胞增殖、迁移)。现在金库保管员(KRAS)偷配了金库钥匙,把金库大门大开,那么金库(细胞增殖、迁移)也就失控了。
RAS 基因点突变:
KRAS和NRAS是由RAS家族成员基因编码的两种GTP 酶蛋白,参与表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)的信号转导,调控细胞生长、分化、增殖 和存活。40%~50%的结直肠癌患者存在 KRAS 点突变[3]; KRAS 自身内在的 GTPase 活性和 GDP-GTP 交换活性在不 同 KRAS 突变中是不尽相同的。例如,第 12、13 和 61 位突 变一般会使 KRAS 内在的 GTPase 活性减弱 [4]。我国 KRAS p.G12C 在结直肠癌的突变率为 2.5%[5] ,并且 KRAS p G12C 受试者的预后较差[6]。3.8%的结直肠癌存在 NRAS 基因点突 变[7]。RAS 突变影响结直肠癌患者针对 EGFR 靶向治疗的疗 效。
四、KRAS的功能作用与肿瘤治疗的关系
RAS在细胞生长的信号调控当中起到枢钮的作用。上游的EGFR(ErbB1)、HER2(ErbB2)、ErbB3、ErbB4等细胞表面受体【1】,在接收外界信号【2】后,会通过RAS蛋白【3】,把信号传递到下游【4】。进而刺激细胞增殖、迁移。

KRAS是RAS蛋白中的重要一员,KRAS基因的突变,会直接影响到针对EGFR基因的抗肿瘤药物的疗效。同时KRAS基因是否有突变,也是肿瘤预后的一个重要指标。
如果一个肿瘤病人的肿瘤当中有KRAS的激活突变,那么针对EGFR的靶向治疗药,例如:西妥昔、易瑞沙等,它们的治疗效果,通常不太好。因为KRAS把药物对EGFR的抑制作用给绕开了。此外,有KRAS激活突变的肿瘤病人,预后一般也不太好,生存期往往会明显短于那些没有KRAS激活突变的病人。
所以,肿瘤当中的KRAS基因,是否有激活突变,对于预判EGFR抑制剂类的药物(的治疗)是否会奏效,很重要。正因如此,对KRAS基因的激活突变的检测,现在已经是肿瘤靶向药物的重要伴随诊断之一。
研究表明,致癌的KRAS基因突变除了直接促进肿瘤细胞的增殖和生存以外,还能够对肿瘤微环境产生影响。致癌性KRAS以旁分泌方式诱导影响基质周围的细胞(如成纤维细胞,先天性和适应性免疫细胞),这些基质细胞反过来又促进了癌症的恶性。
携带KRAS基因突变的肿瘤细胞能够分泌多种细胞因子、趋化因子、和生长因子,包括IL-6,IL-8,IL-23,CCL9,hedgehog等等。这些因子能够对肿瘤微环境中的基质细胞(stromacells)进行重编程。例如,IL-6和IL-8能够在胰腺癌和肺癌中维持基质的炎症表型。而肿瘤细胞分泌的粒细胞-巨噬细胞集落刺激因子(GM-CSF)能够刺激髓源抑制细胞(myeloid-derivedsuppressorcells,MDSC)对肿瘤的浸润,从而抑制抗肿瘤免疫反应。
KRAS突变对肿瘤微环境的影响图片

五、针对KRAS突变的基因检测
2012年的1月,FDA批准Qiagen公司的KRAS突变检测方法可以用作西妥昔的伴随诊断。2015年5月,FDA批准罗氏公司的KRAS突变检测方法可以用于转移的结肠癌的诊断。
中国的厦门艾德公司、武汉友芝友公司、武汉海吉力公司、苏州为真公司等,都有提供针对KRAS基因激活突变的检测试剂盒。
上述这些针对KRAS突变的检测方法,都是基于实时荧光定量PCR方法的原理。
六、KRAS,不可成药靶点?
既然KRAS如此重要,且KRAS基因上的致癌突变十分清楚,那么,为什么到现在为止,仍未上市一个直接针对KRAS基因的靶向药物?原因在于KRAS蛋白是一种无特征、近乎球形的结构,无明显结合位点,很难合成一种能靶向结合并抑制其活性的化合物。长期以来无法攻克,KRAS已成为肿瘤药研发领域"不可成药"靶标的代名词。
困难点在于:
-
KRAS的作用泛围很广,KRAS的正常活性也是许多正常细胞功能所需要的活性,如选取直接抑制KRAS的药物,则该药物毒性可能会很大,副作用也可能会很强。且KRAS与NRAS、HRAS有很高的同源性,能抑制KRAS活性的药物,就很可能会抑制NRAS、HRAS的活性。那么,这个药物的毒性就可能很大。
-
目前已知的KRAS的活性功能域,主要是KRAS与GDP、或GTP结合的口袋状的功能域。与蛋白激酶与ATP的亲和力较弱不同, KRAS与GTP、或GDP的结合非常强,亲合系数达到PicoMolar(皮摩尔浓度,10^-12)级。而正常细胞里面的GDP与GTP的浓度,达到了MicroMolar(微摩尔浓度,10^-6)级。所以,细胞内正常的GDP与GTP的浓度,比与KRAS结合所需的浓度,高了10的6次方倍。而RAS缺乏足够大的能够结合小分子的口袋;故要做出一种小分子化合物,其与KRAS的结合能力,要能与GDP、或者GTP相匹敌,非常难。
-
设计一种只针对性抑制突变KRAS蛋白的活性药物,而尽量少影响正常KRAS蛋白的活性,需要此种化合物对突变的KRAS有很好的选择性。这是药物设计的又一个难题。
-
然而,间接靶向KRAS的策略也是困难重重,包括阻断KRAS细胞膜定位和靶向KRAS下游的信号分子,如RAF、MEK、ERK和PI3K等家族成员。具体而言,间接途径的困难包括:(1)RAS是正常细胞生长和存活相关的必需途径,靶向必需途径首先面临严重的毒副作用,导致疗效指数非常狭窄甚至没有;(2)补偿逃逸机制,以及(3)由于严格调节导致的信号反馈和冗余。
综上,就是到目前为何没有直接针对KRAS的靶向药物上市的主要原因。
七、靶向KRAS的药物开发策略和进展
1. 直接靶向KRAS突变体——近年有突破
近年来,针对KRAS突变体的共价抑制剂研究的突破让通过异构位点(allosteric)靶向KRAS突变体成为可能。在KRASG12C突变体中,与突变生成的胱氨酸共价结合的小分子更倾向与和GDP结合的KRAS蛋白相结合。而这一结合降低GTP与KRAS的亲和力,同时阻碍GEF催化GTP替换GDP,将KRASG12C突变体锁死在失活状态。KRASG12C突变体上这一结合“口袋“的发现催生了多款靶向KRASG12C突变体的小分子共价抑制剂。
其中安进公司的AMG510是首款公布临床试验结果的KRASG12C抑制剂。MiratiTherapeutics公司的MRTX849也已经进入1/1b期临床试验。该公司的另一款KRASG12C抑制剂MRTX1257仍然处于临床前开发阶段。WellspringBiosciences公司开发的ARS-3248的IND申请已经获得FDA批准。JanssenBiotech将接手进行1期临床试验和后续的临床开发。
除了这些进入临床开发的KRASG12C抑制剂以外,勃林格殷格翰公司(BoehringerIngelheim)近日在PNAS上发表的研究表明,该公司发现了能够以纳摩尔级别与KRAS蛋白结合的小分子抑制剂,这款名为BI-2852的小分子抑制剂结合的“口袋“与已有的KRASG12C抑制剂不同,它与KRAS的结合能够影响到KRAS与GEF,GAP和下游效应子的结合。在体外试验中,这款抑制剂能够在携带KRAS基因突变的细胞中起到抗增殖作用。勃林格殷格翰计划以这一款抑制剂为基础,开发更为强效和具有特异性的KRAS抑制剂。
Mirati公司还有一款KRAS抑制剂旨在抑制KRASG12D突变体。
2. 间接-调节RAS与质膜结合的蛋白酶
如抑制法呢酰基转移酶和PDEδ的活性。
KRAS要通过一个法呢酰基的基团定位到细胞膜上。而KRAS蛋白只有定位到细胞膜上,才能较好的被上游信号蛋白所激活,所以,科学家考虑是否可通过抑制法呢酰基转移酶的活性,来抑制KRAS蛋白的法呢酰基化,进而减少其定位到细胞膜上,达到抑制KRAS活性的目的。
目前,已经设计出一些针对法呢酰基转移酶的化合物,但这些化合物在后期的实验当中,对肿瘤的抑制作用不佳。
3. 间接-靶向调节KRAS活性的蛋白
由于KRAS蛋白的“不可成药“性,靶向调节KRAS活性的蛋白成为间接靶向KRAS的一个研究方向。GEF能够催化GTP与KRAS的结合,因此抑制GEF功能的抑制剂可以间接降低KRAS的活性。目前,勃林格殷格翰的研发管线中有一款SOS1抑制剂,SOS1是催化GTP与KRAS结合的一种GEF。
另一个受到关注的靶点是SHP2,它是一种蛋白酪氨酸磷酸酶,对RAS/MAPK信号通路具有调控作用。科学研究表明,抑制SHP2活性可以与包括MEK抑制剂等其它治疗方法结合,增强对携带KRAS基因突变的肿瘤细胞的杀伤效果。诺华公司和RevolutionMedicines公司都有SHP2抑制剂处于临床开发阶段。诺华公司近日也与Mirati公司达成合作协议,将检测该公司的SHP2抑制剂TNO155与Mirati公司的KRASG12C抑制剂MRTX849联用的效果。
4. 间接-抑制KRAS
绕过KRAS蛋白缺乏小分子药物结合靶点的另一个方法是通过创新治疗模式间接KRAS蛋白。在这方面,靶向蛋白降解剂,RNAi疗法,反义寡核苷酸疗法和癌症疫苗都是研究人员探索的方向。目前,靶向KRAS的蛋白降解疗法和RNAi疗法仍然处于早期开发阶段。
阿斯利康与Ionis公司合作开发的靶向KRAS的反义寡核苷酸疗法AZD4785已经被中止。在靶向KRAS的癌症疫苗方面,Elicio公司的KRAS癌症疫苗ELI-002在临床前试验中能够引发对KRAS蛋白突变体的强力免疫反应,导致T细胞对表达KRAS突变体的靶细胞产生强大的细胞裂解功能。Moderna公司也有一款靶向KRAS的mRNA癌症疫苗处于1期临床研究中。
5. 间接-抑制RAS效应子信号传导(如,RAF和PI3K)
鉴于设计直接针对KRAS的抑制剂较难,许多科学家,把更多的精力,放到间接方法如设计针对KRAS下游的信号通路的靶向药物当中去。例如,设计针对B-RAF的靶向药物。靶向RAS下游效应信号传导
阻断下游效应子信号传导是靶向RAS最具吸引力的策略之一。然而,对至少11种不同的下游效应信号途径,靶向哪种效应子以及是否需同时抑制多种效应子仍是关健问题。引起最大关注的两种效应途径是RAF-MEK-ERK促分裂蛋白激酶(MAPK)信号途径和PI3K-AKT-mTOR途径。已知编码这两种途径的组分(BRAF和PIK3CA)的基因中的突变是重要的驱动致癌因素,而它们本身的也是可靶向的蛋白激酶。但BRAF与PIK2CA的突变与RAS的突变很多时候并不重合,它们是相对独立的下游驱动致癌因素。通过筛选生物标记物靶向BRAF或PIK2CA也没有参考RAS的突变状况,所以,严格来讲,靶向BRAF与PIK2CA并不属于靶向RAS突变的主要手段。
已经批准的第一代RAF抑制剂(vemurafenib和dabrafenib)用于治疗BRAF突变黑色素瘤。然而,当在RAS突变癌细胞中评估这些抑制剂时,观察到ERK信号传导的反常激活而非抑制。后来发现第一代RAF抑制剂仅抑制BRAF,不但不抑制CRAF,反而引起CRAF的活性提高,从而激活了MEK-ERK信号通路。新一代的RAF抑制剂包括LY3009120和PLX8394,是广谱型的RAF抑制剂,临床试验正在进行中。
此外还有间接靶向RAS合成致死策略,及干扰RAS调节的癌细胞代谢过程,多限于概念验证阶段,离成药还较远。

更多KRAS研发管线的进展,参见这里
=======
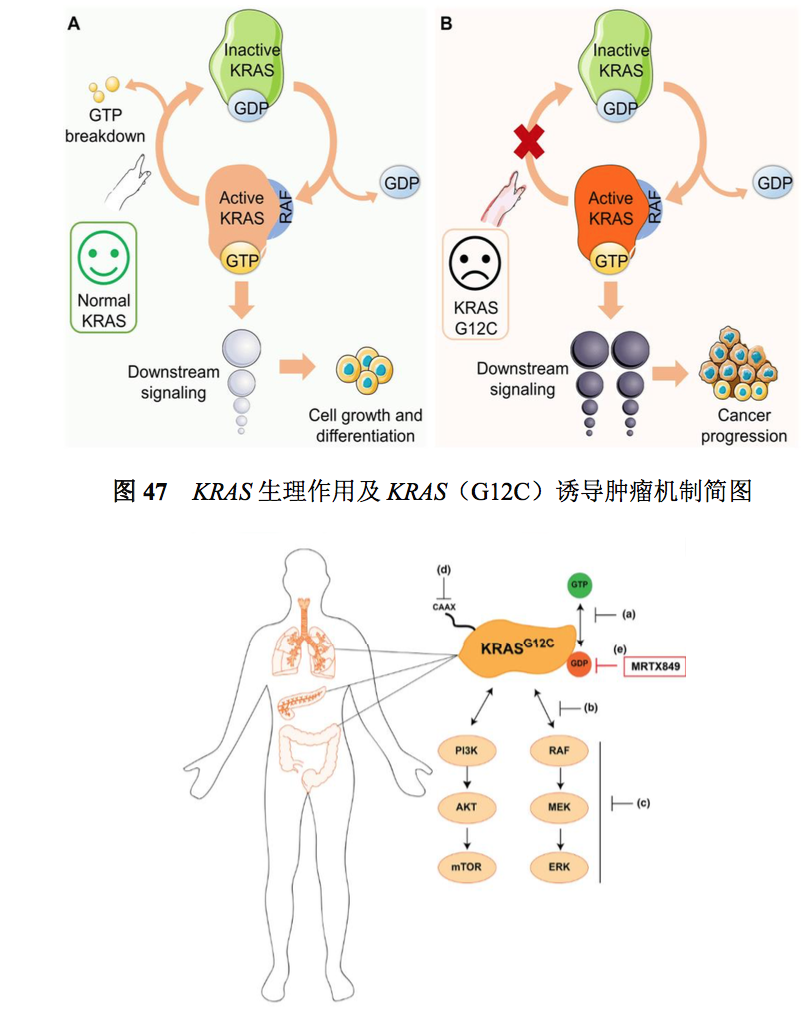
1. 靶点机制(图 47、48)
RAS(rat sarcoma)基因是最早被发现的一种重要的致癌基因,其突变存在于约 30% 的人类肿瘤中,是人类肿瘤最常见的致癌基因突变。在 RAS 家族中,KRAS 是 RAS 的 3 个亚型之一,且相比于其他 2 种 RAS 亚型更易出现突变,在实体瘤中尤为常见,数十年 来 KRAS 一直是精准治疗努力攻克的靶点,包括靶向 KRAS 蛋白本身、或其翻译后修饰、 膜定位、蛋白质-蛋白质相互作用及 RAS 下游信号通路。但既往靶向 KRAS 突变的化合物 研发均以失败告终,直至 2019 年 KRASG12C 抑制剂问世。近年来,研究的不断深入为肿 瘤靶向 KRAS 治疗提供了新的可能性,KRAS 抑制剂的研发也因此取得了显著的进展。
研究发现,KRAS 蛋白作为分子开关发挥作用:它响应上游 EGFR 激活并调下游 MAPK 和 PI3K/mTOR 通路,最终控制细胞增殖、分化和存活。SOS1 是 KRAS 的关键鸟 嘌呤交换因子(GEF),它在其催化结合位点结合并激活 GDP 结合的 RAS 家族蛋白,从而促进 GDP 与 GTP 交换。除催化位点外,SOS1 还可以在变构位点与 GTP 结合的 KRAS 结合,从而增强其 GEF 功能,构成正反馈调节机制。SOS1 的消耗或其 GEF 功能的特定 遗传失活已被证明会降低携带 KRAS 突变的肿瘤细胞的存活率
KRAS 基因在肿瘤中突变有几种主要的亚型,除 G12C 外,还有 G12V、G13V、G12D、 G13D,也就是蛋白的第 12 个或第 13 个氨基酸发生了特殊突变,从而产生强致癌基因。 KRAS-G12C 突变指 KRAS 蛋白序列的第 12 个氨基酸,从正常的甘氨酸(代号为 G)突变 为半胱氨酸(代号为 C),导致其基因功能完全失控,细胞癌变。G12C 突变亚型占 RAS 总突变比例占非小细胞肺癌的 13%,结直肠癌为 3%~5%,其他众多实体瘤为 1%~2%。 KRAS 是完美的抗癌靶点,曾被称为“肿瘤靶向药的圣杯”。靶向 KRAS G12C 抑制剂可 以通过抑制核苷酸交换的重新激活,将癌蛋白捕获在非活性状态,达到显著抑制肿瘤的效 果。基础科研人员和临床医务人员正在共同努力,以期开辟针对其他 KRAS 突变体的靶 向治疗。继 G12C 之后,G12D 有望成为下一个被突破的 KRAS 突变亚型,其中结直肠癌 占 12%,胰腺癌占 36%,非小细胞肺癌占 4%.
资料来源:Christensen JG,Olson P,Briere T,et al.Targeting Krasg12c -mutant cancer with a mutation-specific inhibitor[J].J Intern Med,2020,288(2):183-191.doi:10.1111/joim.13057;https://doi.org/10.1016/j.pharmthera. 2021.108050.
2. 临床研究申报概况
安进公司的索托拉西布(AMG510,Sotorasib)是目前全球范围内首个获批的高选择性、 不可逆转的 KRAS G12C 突变抑制剂。2021 年 5 月 29 日,FDA 批准其上市,用于治疗携 带 KRAS-G12C 突变且一线治疗失败的晚期非小细胞肺癌患者,这是抗癌药物领域一个重 要的里程碑事件。Mirati 公司的阿达格拉西布(MRTX849,Adagrasib)是全球第二个获批 的 KRAS G12C 突变抑制剂。2022 年 12 月 12 日由 FDA 批准上市,用于治疗一线治疗失 败且携带 KRAS G12C 突变的非小细胞肺癌患者。2021 年加科思药业的 KRAS G12 抑制 剂 JAB-21822 于 2021 年 5 月获批 IND 进入临床阶段,同期获批的还有上海益方 D-1553, 劲方医药的 GFH925 等 11 家药企,2022 年新增 5 家药企包括德昇济医药、默沙东、罗氏、 济煜医药、江苏豪森,药物包括 D3S-001、MK-1084、RO7435846、JMKX001899、HS-10370 等。2022 年针对 KRAS G12C 抑制剂有 20 项临床研究在进行中,其中 3 项为III期国际多 中心临床研究,如在既往接受过治疗的局部晚期或转移性 KRAS G12C 突变非小细胞肺癌 受试者中比较 JDQ443 与多西他赛的疗效和安全性的随机、对照、开放性、III期研究;在 携带 KRAS G12C 突变的既往经治的非小细胞肺癌患者中评价 MRTX849 对比多西他赛的 随机、III期研究;在标准一线治疗期间或治疗后疾病进展的携带 KRAS G12C 突变的晚期 结直肠癌患者中评价 MRTX849 联合西妥昔单抗治疗对比化疗的随机、III期研究。其余均 为I期/II期临床研究(包括II期注册临床研究),如 GEC255、MRTX849、D-1553、GFH925、 GH35 片、JAB-21822 和 ZG19018。这些探索主要集中在 KRAS G12C 突变的非小细胞肺癌和结直肠癌,也有在其他的晚期实体瘤患者中安全性、耐受性、药代动力学特征及初步 抗肿瘤活性的I期剂量递增和剂量扩展研究。
图片来源:Christensen JG,Olson P,Briere T,et al.Targeting Krasg12c -mutant cancer with a mutation-specific inhibitor[J].J Intern Med,2020,288(2):183-191.doi:10.1111/joim.13057.
继 KRAS G12C 突变取得进展后,Mirati Therapeutics 公司的 MRTX1133 是首个公布 临床前数据的 KRAS G12D 抑制剂,在体外研究中展现出剂量依赖性抑制 KRAS 信号通 路的活性。2022 年 8 月,恒瑞医药获批启动了“评估在研 1 类新药 HRS-4642 注射液在携 带 KRAS G12D 突变的晚期实体瘤受试者中的安全性、耐受性和药代动力学的临床研究”。 这是国内首个获批临床研究的针对 KRAS G12D 的晚期实体瘤
SOS1 作为 KRAS 通路负反馈调节的重要节点被认识到可能成为 KRAS 突变的肿瘤 治疗的新靶点,因此,勃林格开发了 BI1701963,作为 first-in-class 的小分子泛 KRAS SOS1 抑制剂;据称可防止 KRAS 与关键调节因子 SOS1 结合。初步研究发现,BI1701963 显示 出拮抗 G12、G13 突变 KRAS 等位基因的广泛活性,包括最普遍的 G12C 和 G12V 致癌变 体。其机制可能是pan-KRAS SOS1抑制剂与SOS1结合并抑制KRAS和SOS1蛋白之间 的相互作用,减少负载 GTP 的 KRAS 的形成。SOS1 抑制剂还拮抗由 RAF/MEK/ERK 通 路抑制剂诱导的负反馈环节。由于安全性问题和有限的疗效,勃林格殷格翰公司已主动终 止了 BI1701963 联合伊立替康治疗不可切除的局部晚期或转移性结直肠癌 KRAS 突变阳 性患者的I期、开放、剂量递增试验。
3. 简评
从 1982 年,KRAS 被确定是人类肿瘤的致癌基因,到 2021 年有新药上市,花了整整40 年,才成功开发出了针对该基因的分子靶向药物。KRAS 基因具备 3 个重要的特质:
- 在肿瘤中突变比例高,针对性抑制受益患者多。
- 携带 KRAS 突变肿瘤细胞的生长强烈依赖此基因。一旦被抑制,肿瘤细胞就会停止生长或者死亡。
- 正常细胞无 KRAS 突变, 也不依赖此基因。故理论上,靶向 KRAS 的药物选择性高,毒副作用较小。
因此,从 KRAS 突变被发现开始,科学家便一直在探索各种各样的办法来抑制 KRAS 的功能。无数科学 家和药企前仆后继做出了不懈努力,但由于复杂的生物学原因,接踵失败,无数金钱和时 间付之东流。直到 2013 年,美国科学家 Kevan Shokat 发现一种新的抑制 KRAS 突变的方 法,并发表于《自然》杂志,才为开发 KRAS 靶向药物带来全新的思路。2021 年上市的 索托拉西布就是由此而优化出来的新药。此后的 MRTX849、ARS-3248 等药物,均借鉴了 类似的思路和方法。
继索托拉西布打破了 KRAS 突变无药可医的局面后,国内多家制药企业深耕于 KRAS G12C 领域,临床前研究不断精进,临床研究也正在加速开展,多种 KRAS G12C 抑制剂将 打开新的肿瘤治疗市场,为更多 KRAS 突变患者提供新的用药选择。但有关新药布局较为 拥挤,为目前 KRAS G12C 肿瘤的治疗带来机遇的同时,需要谨慎评估市场风险。由于不 同瘤种中 KRAS 突变亚型分布频率差异较大,开发靶向其他 KRAS 突变亚型药物也是临床 的迫切 需求,而 G12D 抑制剂有望成为下一个突破点。
参考资料
- https://mp.weixin.qq.com/s/_WnnGelbupuljZribdqiTg
- https://mp.weixin.qq.com/s/IaB9Q0R-FEhu9_Jo2EVE7Q
- 晚期结直肠癌新药临床试验设计指导原则
- 《2022年度中国抗肿瘤新药临床研究评述》
