【7.8.2.8】LAG-3(CD223)
LAG-3(ympocyte activation gene-3,淋巴细胞激活基因 3)
由于肿瘤细胞可借助免疫检查点受体躲避免疫系统的识别和杀伤, 使得阻断免疫检查点受体成为近年来肿瘤免疫治疗的新思路。目前开发较为成熟的受体靶点包括程序性死亡蛋白1及其配体(PD-1/PD-L1)和细胞毒性T淋巴细胞相关抗原-4(CTLA-4), 但由于在其相关抗体治疗过程中患者出现耐受, 新靶点的寻找与开发成为新的研究热点。
LAG-3全称为淋巴细胞活化基因3(Lymphocyte Activation Gene-3),又称CD223,主要功能是负调控T细胞的功能,属于免疫球蛋白超家族成员。LAG-3分子最早于1990年被发现,首次分离出LAG-3分子的cDNA克隆, 同年发现该分子的免疫调控机制, 并于1992年证实主要组织相容性复合体II类分子(MHC II) 为LAG-3的主要配体。LAG-3分子可负向调节T细胞, 在维持机体免疫系统稳态和促进肿瘤免疫逃逸方面扮演重要角色。作为新靶点之一,LAG-3在肿瘤免疫治疗方面存在巨大潜力[1]。

LAG-3在多种实体瘤的肿瘤浸润淋巴细胞(TIL)中存在高表达,这些耗竭的CD4+和CD8+TIL表达的细胞因子明显减少。一项对肝癌患者的研究表明人肝癌组织特异性T细胞上LAG-3的表达明显高于无肿瘤肝组织和外周血[2]。LAG-3的阻断可以增强TIL的增殖以及细胞因子的分泌,增强抗肿瘤免疫。阻断LAG-3的临床前癌症治疗模型表明,肿瘤部位的抗原特异性T细胞活化增强,肿瘤生长受到抑制,并且破坏了肿瘤实质部分[3]。LAG-3在人胶质母细胞瘤样品的TIL和与肿瘤相关的血管周围淋巴细胞上表达,单独使用LAG-3或与抗PD-1组合使用,在根除胶质母细胞瘤小鼠方面非常有效[4]。对黑色素瘤,结直肠癌和非小细胞肺癌患者研究发现外周血和肿瘤组织中的Treg细胞上都表达了LAG-3,这种表达LAG-3的Treg细胞产生高水平的免疫调节细胞因子IL-10和TGF-β,并抑制TIL的活化[5]。LAG-3参与了类似PD-1的肿瘤免疫逃逸机制,目前针对LAG-3的免疫治疗开发出的主要抑制方法:LAG-3-Ig融合蛋白和靶向LAG-3的单抗/双抗。
=========
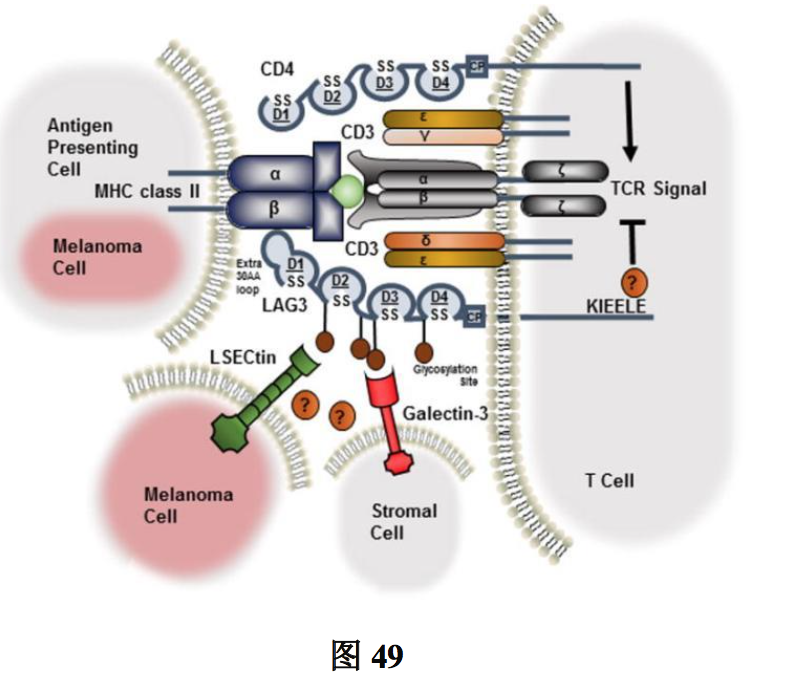
1. 靶点机制(图 49)
LAG-3 定位于人 12 号染色体 20p13.3,包括 8 个外显子,相对应的 cDNA 编码含有 498 个氨基酸的膜蛋白,它是一种在效应 T 细胞和 Treg 表面表达的免疫检查点蛋白,可 调控 T 淋巴细胞和抗原呈递细胞的信号通路,在适应性免疫反应中起到重要作用。与 PD- 1 和细胞毒性 T 淋巴细胞相关蛋白 4(CTLA-4)一样,LAG-3 在原始 T 细胞上不表达, 但在抗原刺激下可在 CD4+和 CD8+T 细胞上诱导表达。LAG-3 的抑制功能与它在细胞表 面的表达水平密切相关,长期感染病毒、细菌和寄生虫引起抗原的持续暴露,会导致 CD4+ 和 CD8+T 细胞上 LAG-3 及其他抑制性共受体的高水平持续表达。这些 T 细胞失去了强大 的效应器功能,称为衰竭性 T 细胞,导致肿瘤杀伤力下降,增强 Treg 活性,使 Treg 免疫 抑制功能上调。研究表明,抑制 LAG-3 可让 T 细胞重新获得细胞毒活性,降低 Treg 抑制 免疫反应的功能,从而增强对肿瘤的杀伤效果;而同时阻断 LAG-3 及 PD-1 或 PD-L1,有 双重抑制效果,包括抑制Treg活性、促进DC成熟及挽救功能异常的CD4+/CD8+T细胞。 LAG-3 的高表达与多种肿瘤的预后不良相关。LAG-3 已成为继 CTLA-4/PD-1/PD-L1 之后 新型的肿瘤免疫治疗靶点。
资料来源:Andrews LP,Marciscano AE,Drake CG,et al.LAG3(CD223) as a cancer immunotherapy target[J]. Immunol Rev,2017,276(1):80-96.doi:10.1111/imr.12519.PMID:28258692; PMCID: PMC 5338468.
2. 临床研究申报概况
根据 ClinicalTrial 上的检索结果,全球针对 LAG-3 靶点正在进行的临床研究有近 60 项,目前绝大多数处于I/II期临床研究阶段,占到所有研究的 80%以上。目前 BMS 的 Relatlimab、默沙东的 Favezelimab(MK-4280)、再生元的 Fianlimab(REGN3767)、Immutep 的 eftilagimod alpha(IMP321)和 MacroGenics 的 Tebotelimab(MGD013)进入了III期临 床研究,其余药物目前仍在I/II期临床研究。
在一项I期临床研究中,默沙东公司的 MK-4280 单药疾病控制率仅达到 17%,提示 LAG- 3 单抗单药使用疗效并不理想。而在与帕博利珠单抗联合治疗组中,其疾病控制率可以达 到 40%,因此,后续的临床研究多采用联合用药模式。在过去的一年里,我国新注册了 17 项以 LAG-3 为靶点的临床研究,药物种类包括 LAG-3 单抗、与纳武利尤单抗或帕博利珠单抗固定剂量复方制剂及融合蛋白。其中国外公司药物进展居前,17 项研究中的 4 项III期 研究均为国外公司开展的国际多中心研究,包括默沙东公司的 MK-4280A(favezelimab 和 帕博利珠单抗组成的复方制剂)和 BMS 公司的 Relatlimab/Nivolumab 固定剂量复方注射液, 瘤种涉及非霍奇金淋巴瘤、黑色素瘤、肝细胞肝癌和结直肠癌,治疗时机包括后线治疗及 黑色素瘤术后辅助治疗。除后线治疗外,BMS 公司已经开始布局 Relatlimab 在肝细胞肝癌 中的一线治疗,该公司注册了一项评价 Relatlimab 联合纳武利尤单抗和贝伐珠单抗用药治 疗初治的晚期/转移性肝细胞癌的I/II期、安全性确认、双盲、安慰剂对照、随机研究 (RELATIVITY-106)。
相比之下,2022 年国产的 LAG-3 单抗产品新注册有 8 项研究,都处在I/II期临床试 验阶段(涉及药物包括 DNV3、HLX 26、LBL-007、GLS-012、MIL98 和 SHR-1802)。时 迈药业、复星医药、誉衡生物、维立志博、天广实生物和恒瑞医药都开发了自己的 LAG- 3 单抗产品。其中有 5 项是联合 PD-1/PD-L1 单抗治疗晚期实体瘤/淋巴瘤的I/II期研究, 1 项是联合卡瑞利珠单抗及苹果酸法米替尼用于晚期实体瘤的I/II期研究,2 项是 LAG- 3 单抗单药用于局部晚期或转移性实体瘤的I/II期研究。国产 LAG-3 融合蛋白产品则是 亿腾景昂的 EOC202,该公司在 2021 年注册了 EOC202 联合紫杉醇治疗转移性乳腺癌的 II期临床研究,2022 年底将 EOC202 与帕博利珠单抗联合开启了 EOC202 治疗头颈部鳞 癌的探索。
3. 简评
LAG-3 是目前免疫检查点二代靶点中,临床数据较多、成药性相对确定的靶点,针对 该靶点的抗体药物将来有可能成为重要的抗肿瘤药物。虽然研究已经很好地阐明了 LAG- 3 作为检查点的免疫抑制效果,但 LAG-3 下游信号转导等具体机制尚不明确。早期临床 研究数据也显示,针对 LAG-3 靶点的单药有效率有限。因此,目前的研究中探索的治疗 方案多是与其他药物联合使用,特别是与 PD-1/PD-L1 单抗联合。与其他靶向药物如多靶 点蛋白酪氨酸激酶抑制剂苹果酸法米替尼的联合也已提上日程。今后的研究中可以期待 LAG-3 单抗与其他靶点药物的联合。同时,针对 LAG-3 的抗体偶联药物仍有待进一步开 发,是否能让 LAG-3 单抗携带 种激活 T 细胞的小分子去激活肿瘤微环境中的耗竭前 T 细胞值得期待。
参考资料
- https://www.cn-healthcare.com/articlewm/20211101/content-1279953.html
- 《2022年度中国抗肿瘤新药临床研究评述》
