【7.8.4.1】TIM-3
TIM-3(T cell immunoglobulin domain and mucindomain-3,T 淋巴细 胞免疫球蛋白黏蛋白-3)
2018 年诺贝尔医学奖获得者 James Allison 和 Tasuku Honjo 证明了利用免疫检查点机制逃避抗肿瘤免疫反应是癌症的主要标志。
此后,以 PD-1/PD-L1 为靶点的药物逐渐被开发出来,一系列的临床研究证明免疫治疗可以改善晚期癌症(如恶性黑色素瘤、非小细胞肺癌等)患者预后,延长生存期。但只有一小部分患者 (~10-30%) 表现出长期、持久的反应,而对于许多其他类型的肿瘤,如胰腺癌,患者对免疫疗法表现出完全的抵抗力。
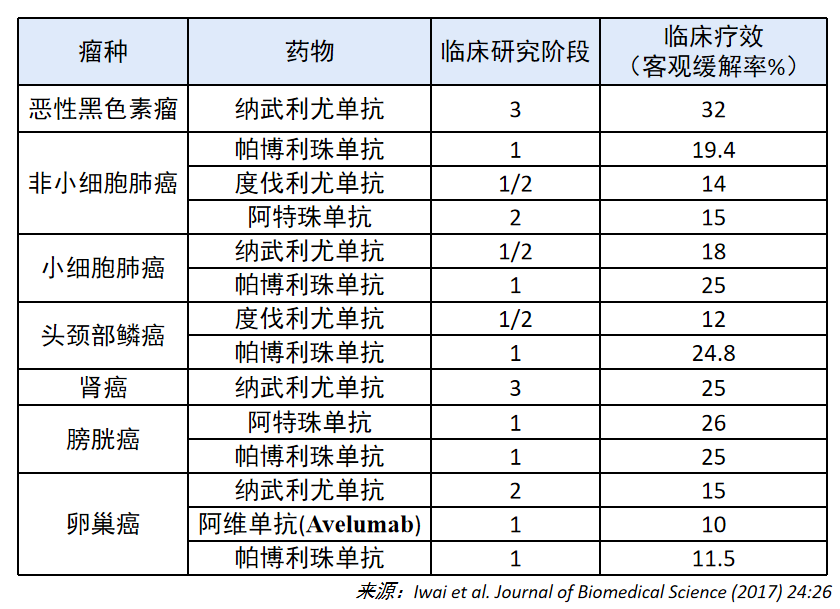
此外一些患者可能会对当前的免疫治疗方案产生适应性抵抗,因此针对新兴的免疫检查点并结合抗 PD-1/PD-L1 治疗方法可能改善临床结果,克服免疫耐药 1。T 淋巴细胞免疫球蛋白黏蛋白 3 (T cell immunoglobulin domain and mucin domain-3, TIM-3) 便是这众多新兴免疫检查点中的一种有希望的抑制性受体。
一、基本信息
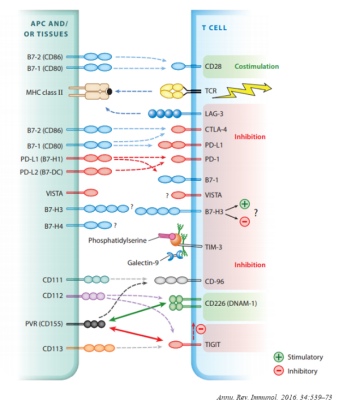
TIM-3(CD366;HAVCR2)是一种跨膜蛋白,是 TIM 家族的成员,TIM 家族由 TIM1-TIM8 八个成员组成,其中 TIM1、TIM3 和 TIM4 在人类中发现。
TIM-3又称HAVCR2,属于TIM基因家族。在人类,TIM家族包括TIM-1、TIM-3和TIM-4,位于染色体5q33.2上。在小鼠中,TIM家族包括TIM-1到TIM-8,位于染色体11B1.1上。
(图源:参考文献 1)
大量证据表明,TIM 基因家族在自身免疫性疾病、感染性疾病、肿瘤免疫监视和免疫逃逸等免疫反应的调节中发挥着不同的作用。尤其是 TIM-3,是适应性免疫中的一种抑制分子。
TIM-3是一种Ⅰ型膜蛋白,由281个氨基酸组成。它由一个胞外区、一个单跨膜结构域和一个C-末端细胞质尾部组成。
TIM-3 由以下三部分组成:
- 胞外区,含有 N-连接糖基化位点的保守的胞外 IgV 结构域,以及含有 O-连接糖基化位点的粘蛋白样结构域;
- 跨膜区;
- 胞内区,含有 5 个酪氨酸的胞浆尾巴 2。
TIM-3有四个配体,包括半乳糖凝集素-9(Gal-9)、癌胚抗原细胞粘附分子-1(CEACAM-1)、高迁移率族蛋白B1(HMGB1)和磷脂酰丝氨酸(PS)。Gal-9是第一个被识别的配体。它是一种碳水化合物结合蛋白,特异性地识别TIM-3免疫球蛋白可变区(IgV)中的N-连接糖链结构。TIM-3/Gal-9通过负性调节T细胞免疫来抑制肿瘤免疫。TIM-3IgV结构域与Gal-9的连接可终止Th1免疫应答。

Int J Hematol.2013 Dec;98(6):627-33.
-
TIM3与其主要配体Gal9的结合导致辅助性T细胞(Th1/Th17)因凋亡而死亡。
-
在肿瘤微环境(TME)中,肿瘤相关树突状细胞表达的TIM3与凋亡肿瘤细胞释放的高迁移率族蛋白1 (HMGB1)分子结合。这种相互作用阻断了核酸向树突状细胞内体的转运,从而抑制了通常由树突状细胞介导的对肿瘤衍生核酸的先天免疫反应。
-
成熟自然杀伤细胞TIM3的上调通常诱导细胞因子IL-12、IL-15和/或IL-18的释放,并增加肿瘤细胞的细胞毒性。
-
在CD8+T细胞中,TIM3与其他抑制性免疫检查点分子如PD-1、CD160的表达;2B4、LAG3等被认为与T细胞分化和活化有关,与IFN-γ和TNF-α水平的增加有关。并且阻断TIM3途径可能会抑制Treg激活。
二、功能
TIM-3 在 CD4+TH1 辅助 T 细胞和 CD8+Tc1 细胞毒性 T 细胞上表达,并在具有增强抑制功能的 Treg 细胞亚群上组成性表达。TIM-3 也可由天然免疫细胞如 DC、NK 细胞、单核细胞和巨噬细胞上表达 3。它在高度功能失调的 T 细胞上表达,并与多种癌症的不良疾病预后有关,包括恶性黑色素瘤和 NSCLC。
一项研究表明,TIM-3 的抑制功能需要与粘附蛋白 CEACAM-1(癌胚抗原相关细胞粘附分子 1) 进行顺式和/或反式的顺式和/或反式相互作用 4。已知还有另外三种配体与 Tim-3 结合并调节抗肿瘤免疫:Galectin-9、PtdSer 和 HMGB15-8。
- Galectin-9 与 TIM-3 的糖链结合,通过诱导凋亡来调节 TH1 细胞免疫,这可能会阻碍抗肿瘤免疫。
- TIM-3 还通过与 PtdSer 的相互作用促进 TME 中凋亡小体的清除,尽管这种相互作用对 TIM-3+T 细胞的生理影响还不完全清楚。
- 最后,HMGB1(一种与损伤相关的蛋白),与肿瘤浸润性 DC 细胞上的 TIM-3 结合。HMGB1 和 TIM-3 的相互作用损害了 Toll 样受体和胞浆感受器介导的对核酸的先天免疫反应,从而阻碍了 DNA 疫苗和细胞毒化疗的效果。

(图源:Nature Immunol. 2019 Nov. 20(11), 1425-1434)
 Das M, et al.Immunol Rev. 2017
Das M, et al.Immunol Rev. 2017
同时TIM-3可诱导免疫耐受,TIM-3分子与哮喘、食物过敏及自身免疫性疾病如多发性硬化症和类风湿性关节炎等有关。TIM-3还能抑制T细胞的免疫应答,并与导致慢性病毒感染的免疫耗竭有关。
TIM-3与PD-1共表达于多种肿瘤上,且在PD-1耐药的肿瘤中表达量增加,提升TIM3的表达可能是PD-1抑制剂的耐药机制之一,也为PD-1和TIM-3抗体联合用药以及双特异性抗体提供了依据。TIM-3表达在分化终末期的T细胞上,并且在Treg上的表达也仅限于肿瘤内,理论上联合用药的安全性也高于PD-1+CTLA-4。
三、药物
据报道,NSCLC 患者 TIM-3 上调是抗 PD-1 适应性耐药的机制 9。小鼠肿瘤模型的临床前研究表明,抗 TIM-3 单一疗法可以改善肿瘤控制,但其与抗 PD-1 或抗 PD-L1 的组合疗法显著降低肿瘤负荷并改善抗肿瘤免疫应答 5,10。
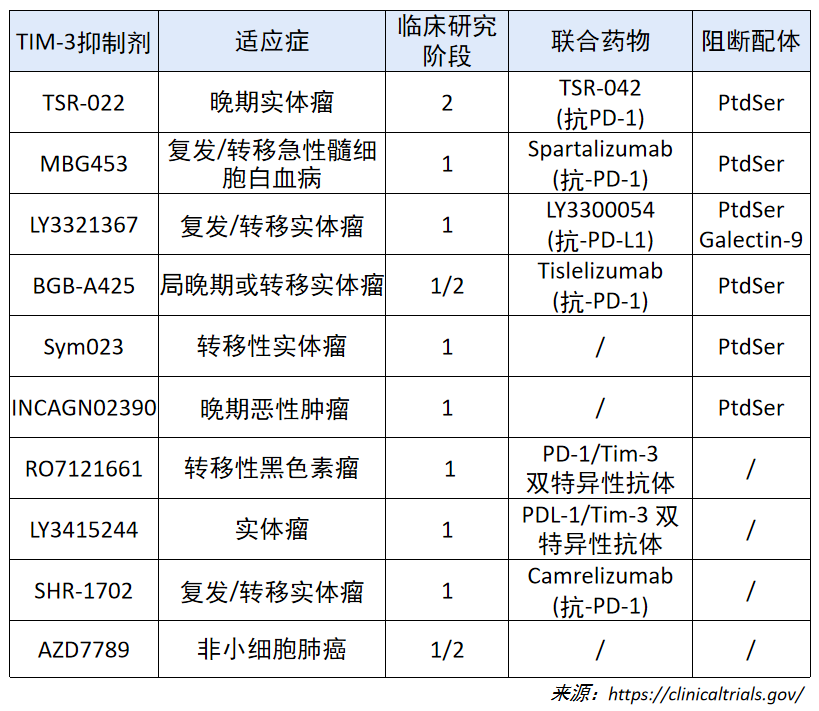
靶向 TIM-3 的几种药物目前正在临床试验中作为单一疗法或与抗 PD-1/PD-L1 药物组合。此外针对 TIM-3 的双特异性抗体 (RO7121661、LY3415244 等) 也已被开发出来。考虑到针对 TIM-3 和 PD-1 的联合治疗所观察到的临床前疗效,以及针对 PD-1 和针对 PD-L1 之间的潜在差异,这些试验的结果令人期待。
==========
1. 靶点机制(图 62)
TIM-3 是由 301 个氨基酸组成的I型穿膜蛋白,属于负调控的免疫检查点,在 T 细胞 及其他免疫细胞表面均有表达,可引起癌症与慢性病毒感染过程中 T 细胞衰竭。TIM-3 配 体是一种广泛表达的可溶分子半乳凝素 9(Gal-9),其与 TIM-3 分子可变区的寡聚糖结合 进而对 Th1 驱动的免疫反应进行负调控。研究发现,共表达 TIM-3/PD-1 的T细胞表现出更 严重的衰竭,并且抗 PD-1 单抗治疗无反应的患者往往与 TIM-3 的表达高度相关,而抗 PD- 1 单抗治疗产生耐药的患者也与 TIM-3 被选择性地高表达相关,导致肿瘤免疫逃逸。

资料来源:Duw,Yangm,Turnera,etal.TIM-3asatargetforcancerimmunotherapyandmechanismsofaction[J]. Int JMol Sci,2017,18(3):645.doi:10.3390/ijms18030645.PMID:28300768; PMCID: PMC5372657.
2. 临床研究申报概况
目前全球范围内尚无靶向 TIM-3 药物获批上市,研究该靶点成药的企业数量较 2021 年无显著增加。2022 年,正在开展 4 项 TIM-3 抑制剂I期临床研究,涉及药物包括沙巴 托利单抗、TQB2618 及 BIS5。
沙巴托利单抗(MBG453)是开发进度较快的 TIM-3 单克隆抗体,目前一项Ib 期多 中心、开放标签临床研究,正在评价较低危(极低危、低危、中危)成年骨髓增生异常综 合征患者接受沙巴托利单抗的安全性及有效性。TQB2618 为另一种 TIM3 受体单克隆抗 体,一项Ib 期研究评价 TQB2618 联合 TQB2450 注射液(抗 PD-L1 单抗)在晚期实体瘤 患者中的有效性和安全性;一项I期临床试验评价 TQB2618 联合去甲基化药物在复发/难 治性急性髓系白血病、骨髓增生异常综合征受试者安全性及有效性。BIS5 是国内首创的 TIM-3/PD-1 双特异性抗体,目前正在晚期恶性肿瘤中开展安全性、耐受性、药代动力学、 药效学和免疫原性的多中心、开放的I期临床研究。
3. 简评
TIM-3 是抗肿瘤免疫治疗领域重要靶点之一,具有逆转免疫抵抗、潜在提高免疫治疗整 体疗效的作用。然而,目前布局 TIM-3 靶点的制药企业数量有限,亦无成功前例可循,整体 研发尚处于谨慎探索阶段。随着药物研发理念的推进,除单克隆抗体外,双特异性抗体、ADC 药物的出现为靶向 TIM-3 药物研发提供新的思路,该靶点未来研发前景仍然可期。
参考资料
-
Baumeister, Susanne H et al. 「Coinhibitory Pathways in Immunotherapy for Cancer.」 Annual review of immunology vol. 34 (2016): 539-73.
-
Freeman, Gordon J et al. 「TIM genes: a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity.」 Immunological reviews vol. 235,1 (2010): 172-89.
- 《2022年度中国抗肿瘤新药临床研究评述》
