【1.4.4】免疫应答--固有免疫应答
一、参与固有免疫应答的组织、细胞和效应分子
固有免疫应答(innate immune response)是指体内固有免疫细胞和分子识别、 结合病原体及其产物或其他抗原性异物后,迅速活化并吞噬杀伤、清除病原体及 其产物或其他抗原性异物,以保护机体的过程。固有免疫应答在机体抗感染免疫 中具有重要意义,在适应性免疫应答的启动、调节和效应阶段也起重要作用。参 与固有免疫应答的物质主要包括:组织屏障、固有免疫细胞和固有免疫分子。
1.1 组织屏障及其作用
1.1.1 皮肤黏膜屏障
(1)物理屏障:由致密上皮细胞组成的皮肤和黏膜组织具有机械屏障作用, 在正常情况下可有效阻挡病原体侵入。黏膜的物理屏障作用相对较弱,但黏膜上 皮细胞的迅速更新、呼吸道黏膜上皮细胞纤毛的定向摆动及黏膜表面分泌液的冲 洗作用,均有助于清除黏膜表面的病原体。
(2)化学屏障:皮肤和黏膜分泌物中含有多种杀菌、抑菌物质,主要包括: 皮脂腺分泌的不饱和脂肪酸,汗腺分泌的乳酸,胃液中的胃酸及唾液、泪液、呼 吸道、消化道和泌尿生殖道黏液中的溶菌酶、抗菌肽等。这些抗菌物质在皮肤黏 膜表面形成抗御病原体的化学屏障。
(3)微生物屏障:寄居在皮肤和黏膜表面的正常菌群,可通过与病原体竞 争结合上皮细胞和营养物质的方式,或通过分泌某些杀菌、抑菌物质对病原体产 生抵御作用。例如:正常菌群可对局部细菌的生长产生拮抗作用,临床不适当地 大量和长期应用广谱抗生素,可破坏消化道正常菌群,致使耐药性金黄色葡萄球 菌和白色念珠菌大量生长,而引发葡萄球菌性肠炎和白色念珠菌性肠炎;口腔中 的唾液链球菌能产生 H2O2,对白喉杆菌和脑膜炎球菌具有杀伤作用;肠道中大 肠杆菌产生的细菌素对某些厌氧菌和 G+菌具有抑制和杀伤作用。
1.1.2 血-脑屏障
由软脑膜、脉络丛毛细血管壁和包在血管壁外的星形胶质细 胞组成。其组织结构致密,能阻挡血液中的病原体和其他大分子物质进入脑组织 及脑室,从而对中枢神经系统产生保护作用。婴幼儿血-脑屏障尚未发育完善,故 易发生中枢神经系统感染。
1.1.3 血-胎屏障
由母体子宫内膜的基蜕膜和胎儿的绒毛膜滋养层细胞共同构 成。血-胎屏障不妨碍母子间营养物质交换,正常情况下可防止母体内病原体和有害物质进入胎儿体内,从而保护胎儿免遭感染、使之正常发育。妊娠早期(12 周内)血-胎屏障发育尚未完善,此时孕妇若感染风疹和巨细胞病毒等,可导致胎 儿畸形或流产。
1.2 固有免疫细胞及其作用
固有免疫细胞主要包括单核/巨噬细胞、中性粒细胞、树突状细胞、NK 细 胞、NKT 细胞、B1 细胞、γδT 细胞、肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞 等。固有免疫细胞不表达特异性抗原识别受体,可通过模式识别受体或有限多样 性抗原识别受体对病原体及其感染细胞或衰老损伤和畸变细胞表面某些共有特 定表位分子的识别结合,产生非特异性抗感染抗肿瘤等免疫保护作用,同时参与 适应性免疫应答的启动和效应过程。
1.2.1 模式识别受体和病原体相关模式分子
模式识别受体(pattrn recognition receptor,PRR)指存在于吞噬细胞和树突状 细胞等多种免疫细胞膜表面、胞内器室膜上和血清中的一类能够直接识别病原体 及其产物或宿主凋亡细胞和衰老损伤细胞表面某些共有特定分子结构的受体。膜 型 PRR 主要包括:1甘露糖受体(mannose receptor,MR)能识别表达于细菌、 真菌(如分枝杆菌、克雷伯菌、卡氏肺孢菌、酵母菌等)细胞壁糖蛋白和糖脂分 子末端的甘露糖和岩藻糖残基;2清道夫受体(scavenger receptor,SR)可识别 G- 菌脂多糖、G+菌磷壁酸、衰老损伤细胞表面乙酰化低密度脂蛋白和凋亡细胞重要 标志——磷脂酰丝氨酸;Toll 样受体(Toll like receptor,TLR)家族包括 11 个 成员,其中 TLR1、2、3、4、5、6 表达于细胞膜上,TLR 3、7、8、9 表达于胞 内器室如内体/溶酶体膜上。分泌型 PRR 存在于血清中,主要包括甘露糖结合 凝集素和 C 反应蛋白等急性期蛋白。
病原体相关模式分子( pathogenassociatedmolecularpattern,PAMP)是指某 些病原体或其产物所共有的高度保守、可被模式识别受体识别结合的特定分子。 PAMP 种类有限,在病原微生物中广泛分布,而不表达于正常组织细胞表面。因 此固有免疫细胞可通过 PRR 对 PAMP 的识别,区别“自身”与“非己”,并对病原 体及其产物发生应答。分泌型 PRR 能够识别结合病原微生物表面的甘露糖残基 或磷酰胆碱,并通过激活补体产生溶菌和调理作用,发挥抗感染免疫效应。
1.2.2 吞噬细胞
吞噬细胞( phagocyte )包括也学中的单核细胞、中性粒细胞和组织器官中的 巨噬细胞。单核细胞(monocyte)约占血液中白细胞总数的 3%~8%,胞质富含 溶酶体颗粒,其内含过氧化物酶、酸性磷酸酶和溶菌酶等多种酶类物质。单核细 胞在血液中短暂停留(12-24 小时),进入表皮棘层分化为朗格汉斯细胞,进入组 织器官分化为巨噬细胞
1.2.2.1 巨噬细胞(maophage,Mφ )
由定居和游走两类细胞组成:定居在不 同组织中的 Mφ 有不同的命名 ,如肝脏中的库普弗细胞,中枢神经系统中的小 胶质细胞、骨组织中的破骨细胞,游走巨噬细胞广泛分布于结缔组织中,寿命较 长(可存活数月),胞质内富含溶酶体颗粒及其相应的酶类物质,具有很强的变 形运动和吞噬杀伤、清除病原体等抗原性异物的能力。
(1)巨噬细胞表面的受体
Mφ 表面具有多种模式识别受体、调理性受体和 细胞因子受体。模式识别受体主要包括甘露糖受体、清道夫体、Toll 样受体等, 它们可介导 Mφ 对病原体的吞噬作用。调理性受体主要包括 IgGFc 受体(FcγR) 和补体受体 C3bR/C4bR,它们可通过抗体-FcγR、C3b-C3bR 或 C4b-C4bR 的结 合方式,促进 Mφ 对抗体结合或 C3b、C4b 黏附的病原体的吞噬作用。Mφ 表达 多种与其趋化和活化相关的细胞因子受体,如单核细胞趋化蛋白-1 受体(MCP- IR)、巨噬细胞炎症蛋白-1α/β 受体(MIP-1α/βR)和 IFN-γ、M-CSF、 GM-CSF 等细胞因子的受体,在上述趋化/活化性细胞因子作用下,大量游走 Mφ 被吸引 募集到感染或炎症部位并被活化,使其吞噬杀菌和分泌功能显著增强,有效发挥 抗感染免疫作用。
(2)巨噬细胞的主要生物学功能
-
杀伤清除病原体:Mφ 通过以下两种途径杀伤摄取的病原体:1氧依赖性 杀菌系统:包括反应性氧中间物和反应性氮中间物的杀伤作用:前者是指在吞噬 作用激发下使细胞膜上还原型辅酶 I/II 及分子氧活化,生成超氧阴离子,游离羟 基、过氧化氢和单态氧产生杀菌作用的系统;后者是指 Mφ 活化后产生的诱导型 一氧化氮合酶,在还原型辅酶II或四氢生物蝶呤存在条件下,催化 L-精氨酸与氧 分子反应,生成一氧化氮产生杀菌和细胞毒作用的系统。2氧非依赖杀菌系统: 包括胞内乳酸累积形成对病原体具抑杀作用的酸性环境;溶酶体内溶菌酶破坏细 菌胞壁肽聚糖产生的杀菌作用;抗菌肽等阳离子蛋白和多肽对病原体的裂解破坏作用。杀伤破坏的病原体在吞噬溶酶体内蛋白酶、核酸酶、脂酶和磷酸酶等多种 水解酶作用下,可进一步消化降解。
-
杀伤胞内寄生菌和肿瘤等靶细胞:Mφ 接受 Th 细胞反馈剌激和被 LPS 或 IFN-γ、GM-CSF 等细胞因子激活后,可有效杀伤胞内寄生菌和某些肿瘤细胞。 Mφ 还能通过 ADCC 效应杀伤肿瘤和病毒感染的靶细胞
-
参与炎症反应:感染部位产生的 MCP-1、GM-CSF 和 IFN-γ 等细胞因子 可募集和活化 Mφ;活化 Mφ 又可通过分泌 MIP-1α/β、MCP-1、IL-8 等趋化因子 和 IL-1 等促炎细胞因子或其他炎性介质参与和促进炎症反应。
-
加工提呈抗原启动适应性免疫应答:Mφ 是专职性抗原提呈细胞(APC), 可将摄入的外源性抗原加工处理为具有免疫原性的小分子肽段,并以抗原肽- MHCII类分子复合物的形式表达于细胞表面,供抗原特异性 CD4+ T 细胞识别, 增强适应性免疫应答。Mφ 也可将摄入的外源性抗原通过交叉抗原途径,以抗原 肽-MHCI类分子复合物的形式表达于细胞表面,供抗原特异性 CD8+ CTL 识别, 增强 CTL 的杀伤效应。
-
免疫调节作用:活化 Mφ 可分泌多种细胞因子发挥免疫调节作用。例如: IFN-γ 可上调 APC 表达 MHC 分子,增强抗原提呈能力;IL-12、IL-18 可促进 T 细胞增殖分化,增强 NK 细胞杀伤活性,促进 Th1 分化;IL-10 可抑制 Mφ 和 NK 细胞活化,下调 APC 表达 MHCII类分子和共剌激分子。
1.2.2.2 中性粒细胞 (neutrophil)
约占白细胞总数的 60%-70%,其产生快(1 ×107 个/分钟),存活期仅 2-3 天,中性粒细胞胞质颗粒中含有髓过氧化物酶 (myeloperoxidase,MPO)、酸性磷酸酶、碱性磷酸酶、溶菌酶和防御素等杀菌 物质。中性粒细胞主要通过氧依赖和氧非依赖系统杀伤病原体,此外还有巨噬细 胞所不具备的由 MPO 与过氧化氢和氯化物组成的 MPO 杀菌系统。中性粒细胞 表达多种趋化因子受体(IL-8R,C5aR)、模式识别受体和调理性受体,具有很强 的趋化和吞噬能力,可迅速穿越血管内皮细胞进入感染部位,吞噬杀伤病原体; 亦可通过调理作用或 ADCC 作用使其吞噬杀菌能力显著增强或使某些病原体感 染的组织细胞裂解破坏。
1.2.3 树突状细胞
骨髓来源的树突状细胞(DC)分为两类
-
经典 DC(conventional DC,cDC) 以往所指的髓样 DC 即 cDC,其中朗 格汉斯细胞等未成熟髓样 DC 高表达 TLR、调理受体和趋化因子受体,而低表达 MHCII类分子和共刺激分子;它们摄取加工抗原能力强,而提呈抗原、启动适应 性免疫应答能力弱。未成熟 DC 摄取病原体等抗原性异物后开始迁移,进入外周 免疫器官后发育成熟。成熟 DC 高表达 MHC-II类分子和共刺激分子,可有效提 呈抗原、激活初始 T 细胞启动适应性免疫应答。
-
浆细胞样 DC(plasmacytoidDC,pDC) pDC 低表达上述受体和分子,但 其胞质器室膜上高表达 TLR7 和 TLR9,可识别病毒核酸产生大量I型干扰素 (IFN-α/IFN-β),在机体抗病毒固有免疫应答中发挥重要作用。
1.2.4 自然杀伤细胞
自然杀伤(natural killer,NK)细胞来源于骨髓淋巴样干细胞,其分化、发 育依赖于骨髓微环境,主要分布于骨髓、外周血、肝脏、脾脏、肺脏和淋巴结。 目前将具有 TCR-、mlg-、CD56 +、CD16+表型的淋巴样细胞鉴定为人 NK 细胞; NK1.1 和 Ly49 是小鼠 NK 细胞表面特征性标志。
NK 细胞不表达特异性抗原识别受体,而是通过表面活化性受体和抑制性受 体对“自身”与“非己”进行识别,并直接杀伤某些肿瘤和病毒感染的靶细胞 。 NK 细胞表面具有 IgGFc 受体,也可通过 ADCC 作用杀伤肿瘤和病毒感染等靶 细胞。NK 细胞表达多种与其趋化和活化相关的细胞因子受体,可被招募到肿瘤 和病毒感染部位,在 IFN-γ 和 IL-12 等细胞因子作用下活化,使其抗肿瘤、抗病 毒作用显著增强。活化 NK 细胞还可通过分泌 IFN-γ 和 TNF-α 等细胞因子发挥 免疫调节作用。
1.2.4.1 NK 细胞杀伤活化受体和杀伤抑制受体
NK 细胞表面具有两类功能截然 相反的受体:-类受体与靶细胞表面相应配体结合后,可激发 NK 细胞产生杀伤 作用,称为杀伤细胞活化受体;另一类受体与靶细胞表面相应配体结合后,可抑 制 NK 细胞产生杀伤作用,称为杀伤细胞抑制受体。
(1)识别 MHCI类分子的活化或抑制性受体:NK 细胞表达多种以经典/非 经典 MHCI类分子为配体的受体,包括两种结构不同的分子家族。
-
杀伤细胞免疫球蛋白样受体(killer immunoglobulin-like receptor,KIR): KIR 是免疫球蛋白超家族成员,其胞外区含有 2 个或 3 个能与 HLA I 类分子结 合的 Ig 样结构域,据此可将 KIR 分为 KIR2D 和 KIR3D 两个亚类。两个亚类中,胞质区氨基酸序列较长的称为 KIR2DL 和 KIR3DL,其胞质区含免疫受体酪氨酸 抑制基序(ITIM),可转导活化抑制信号,是 NK 细胞表面的抑制性受体;胞质 区氨基酸序列较短的称为 KIR2DS 和 KIR3DS,它们本身不具信号转导功能,但 可通过跨膜区带正电荷的氨基酸,与跨膜区带负电荷氨基酸、胞质区含免疫受体 酪氨酸激活基序(ITAM)的 DAP12 同源二聚体分子非共价结合,而获得转导活 化信号的功能,因此是 NK 细胞表面的活化性受体。
-
杀伤细胞凝集素样受体(killer lectin-like receptor,KLR):是由 C 型凝集 素家族成员 CD94 与不同 C 型凝集素 NKG2 家族成员,通过二硫键结合组成的 异二聚体。CD94 和 NKG2 胞外区均有能与 MHCI类分子结合的结构域:NKG2 家族中的 NKG2A 胞质区较长,含 ITIM,CD94/NKG2A 异二聚体是 NK 细胞表 面的抑制性受体。NKG2C 胞质区氨基酸序列短小,CD94/NKG2C 异二聚体本身 不具信号转导功能;但 CD94/NKG2C 能与胞质区含 ITAM 的 DAP12 非共价结合 而获得转导活化信号的功能,因此是 NK 细胞表面的活化性受体。
(2)识别非 MHCI类分子配体的杀伤活化受体:包括 NKG2D 和自然细胞 毒性受体(natural cytotoxicity receptor,NCR),识别的配体通常是在某些肿瘤和 病毒感染细胞表面异常或高表达,而在正常组织细胞表面缺失或表达低下的膜分 子。NK 细胞可通过此类杀伤活化受体选择性攻击杀伤某些肿瘤和病毒感染的靶 细胞,而不攻击杀伤正常组织细胞。
- NKG2D:是 NKG2 家族成员,但与该家族中其他成员的同源性较低,也 不与 CD94 结合。NKG2D 胞质区氨基酸不具信号传导功能,但能与胞质区含 ITAM 的 DAP10 非共价结合而获得转导活化信号功能(图 7-1)。NKG2D 可识 别 MHCI类链相关分子(MICA 和 MICB)。MICA 和 MICB 在乳腺癌、卵巢癌、 结肠癌、胃癌和肺癌等上皮肿瘤细胞表面高表达,而在正常组织细胞表面缺失或 表达低下。
2.自然细胞毒性受体(NCR):是 NK 细胞特有的表面标志,也是 NK 细胞 表面主要的活化性受体,但其识别的配体目前还不十分清楚。NCR 包括 NKp46、 NKp30 和 NKp44,其中 NKp46 和 NKp30 胞质区不含 ITAM,可通过跨膜区带正 电荷的氨基酸与跨膜区带负电荷氨基酸、胞质区含 ITAM 的 CD3ζζ同源二聚 体非共价结合,而获得转导活化信号的功能(图 7-1)。NKp44 是活化 NK 细胞 的特异性标志,其胞质区氨基酸不具信号转导功能,但能与胞质区含 ITAM 的DAP12 非共价结合而获得转导活化信号的功能。近来研究发现,NKp46 和 NKp44 可识别结合流感病毒血凝素,提示 NK 细胞可借此攻击杀伤流感病毒感染的靶细 胞。
1.2.4.2 NK 细胞对肿瘤或病毒感染靶细胞的识别、活化和细胞毒作用
活化受体 和抑制受体共表达于 NK 细胞表面,二者均可识别结合正常表达于自身组织细胞 表面的经典/非经典 MHCI 类分子。在生理条件,自身组织细胞正常表达 MHCI 类分子,NK 细胞表面杀伤抑制受体的作用占主导地位,可抑制各种杀伤活化受 体的作用,因此 NK 细胞不能杀伤自身正常组织细胞(图 7-2A)。在发生病毒感 染或细胞癌变时,病毒感染细胞和肿瘤细胞表面 MHCI 类分子缺失或下调表达, 同时其表面某些可被 NK 细胞识别的非 MHCI 类分子配体异常或上调表达。此 时,NK 细胞可因靶细胞表面丧失正常表达的自身 MHCI 类分子而使其抑制受体 功能丧失;与此同时 NK 细胞通过表面杀伤活化受体识别靶细胞表面异常或上调 表达的非 MHCI 类分子配体而被活化,并通过释放穿孔素、颗粒酶、TNF-α和 表达 FasL 等作用方式杀伤病毒感染和肿瘤等靶细胞。
1.2.5 固有样淋巴细胞
NKT 细胞、γδT 细胞和 B1 细胞是一类介于适应性免疫细胞和固有免疫细 胞之间的固有样淋巴细胞(innaie lymphocytes,ILLs)。此类细胞存在于某些特 殊部位,其抗原识别受体(TCR 或 BCR)为有限多样性,可直接识别某些靶细 胞或病原体所共有的特定表位分子,并在未经克隆扩增条件下,通过趋化募 集、迅速活化发生应答,产生免疫效应。
1.2.5.1 自然杀伤 T 细胞(NKT 细胞)
NKT 细胞是指既表达 NK 细胞表面 标志 CD56(小鼠 NK1.1)又表达 T 细胞表面标志 TCRαβ-CD3 复合体的淋巴细 胞。NKT 细胞在胸腺或胚肝分化发育,主要分布于骨髓、肝脏和胸腺,在脾 脏、淋巴结和外周血中也有少量存在。NKT 细胞可直接识别靶细胞表面 CD1 分子提呈的磷脂和糖脂类抗原,并迅速活化产生应答;也可被 IL-12 和 IFN-γ 等细胞因子激活迅速产生应答。活化 NKT 细胞可通过分泌穿孔素、颗 粒酶或 Fas/FasL 途径杀伤某些肿瘤和病原体感染的靶细胞;也可通过分泌 IL-4 或 IFN-γ,分别诱导初始 T 细胞向 Th2 或 Thl 细胞分化,参与体液免疫 应答或细胞免疫应答,增强机体抗感染和抗肿瘤作用。
1.2.5.2 γδT 细胞
γδT 细胞在胸腺中分化发育,主要分布于肠道、呼吸道及泌 尿生殖道等黏膜和皮下组织,是皮肤黏膜局部参与早期抗感染、抗肿瘤免疫 的主要效应细胞。γδT 细胞不识别 MHC 分子提呈的抗原肽,可直接识别: 1某些肿瘤细胞表面的 MICA 和 MICB 分子;2某些病毒蛋白或感染细胞表 面的病毒蛋白;3感染细胞表达的热休克蛋白;4感染细胞表面 CD1 分子 提呈的糖脂或磷脂类抗原等。活化 γδT 细胞可通过释放穿孔素、颗粒酶和表 达 FasL 等方式杀伤病毒感染细胞和肿瘤细胞;还可分泌 IL-17、IFN-γ 和 TNF-α 等细胞因子介导炎症反应或参与免疫调节。
1.2.5.3 B1 细胞
Bl 细胞主要分布于胸膜腔、腹膜腔和肠道固有层中,是具有自 我更新能力的 CD5+、mIgM+ B 细胞。Bl 细胞分化发育与胚肝密切相关,也可由 成人骨髓产生。Bl 细胞表面 BCR 缺乏多样性,可直接识别结合某些病原体或变 性自身成分所共有的抗原表位分子,迅速活化产生应答。Bl 细胞识别的抗原主要 包括:
- 某些细菌表面共有的多糖类 TI 抗原,如细菌脂多糖、细菌荚膜多糖和 葡聚糖等;
- 某些变性的自身抗原,如变性 Ig 和变性单股 DNA 等。
Bl 细胞介 导的体液免疫应答具有以下特点:
- 接受细菌多糖或变性自身抗原剌激后,48 小 时内即可生以 IgM 为主的低亲和力抗体,这对机体早期抗感染免疫和清除变性 自身抗原具有重要作用;
- 增殖、分化过程中一般不发生 Ig 类别转换;
- 无免 疫记忆,再次接受相同抗原剌激后,其抗体效价与初次应答无明显差别。
1.3 固有免疫效应分子及其作用
1.3.1 补体系统
补体系统是参与固有免疫应答的重要效应分子。研究证实,病 原体侵入机体后,可通过旁路途径和 MBL 途径迅速激活补体系统,并产生多种 补体裂解产物:C3a、C5a 具有趋化和致炎作用,可吸引吞噬细胞、到达感染部 位,发挥吞噬杀菌作用和引起炎症反应; C3b、C4b 具有调理和免疫黏附作用, 可促进吞噬细胞对病原体的吞噬清除。上述作用可在特异性抗体产生之前,即病 原体侵入机体后迅速产生的,因此在机体早期抗感染免疫应答中具有十分重要的 意义。当特异性抗体产生后,侵入体内的病原体与相应抗体结合,也可通过经典 途径激活补体,产生溶菌和促进病原体清除等抗感染免疫效应(详见第四章)。
1.3.2 细胞因子
病原体感染机体后,可刺激免疫细胞和感染的组织细胞产生 多种细胞因子,如 IFN-α/β、IFN-γ、IL-1、IL-6、TNF、GM-CSF 等,可参与 抗病毒、诱导和促进炎症反应及抗肿瘤等多种免疫功能(详见第五章)。
1.3.3 防御素(defensin)
防御素是一类耐受蛋白酶的小分子多肽,对细菌、真菌、病毒、原虫、肿瘤细胞等具有直接杀伤作用。人和哺乳动物体内存在的α -防御素为阳离子多肽,主要由中性粒细胞和小肠潘尼细胞(Paneth’s cell)产生, 可通过以下作用机制杀伤病原体:1通过与病原体带负电荷成分(如 G-菌的脂多 糖、G+菌的磷壁酸和病毒包膜脂质等)的静电作用,使病原体膜屏障破坏、通透 性增加,导致病原体死亡;2诱导病原体产生自溶酶,干扰 DNA 和蛋白质合成; 3具有致炎和趋化作用,可增强吞噬细胞对病原体的吞噬杀伤和清除作用。
1.3.4 溶菌酶(lysozyme)
溶菌酶是一种不耐热的碱性蛋白,广泛存在于各种 体液、外分泌液和吞噬细胞溶酶体中。溶菌酶能够裂解 G+菌细胞壁中 N-乙酰葡 萄糖胺与 N-乙酰胞壁酸之间的β-1,4 糖苷键,使细胞壁的重要组分肽聚糖破坏, 从而导致细菌溶解破坏。G-菌由于在肽聚糖外还有脂多糖和脂蛋白包裹,所以对 溶菌酶不敏感。但在特异性抗体和补体存在条件下,G-菌也可被溶菌酶溶解破坏。
1.3.5 乙型溶素(β-lysin)
乙型溶素是血清中一种对热较稳定的碱性多肽,在 血浆凝固时由血小板释放,故血清浓度显著高于血浆水平。乙型溶素可作用于 G+ 菌细胞膜,产生非酶性破坏效应,但对 G-菌无效。
二、固有免疫应答的作用时相
2.1 即刻固有免疫应答阶段
即刻固有免疫应答(immediate innate immunity)阶段发生于 感染 0~4 小时之内,在此期间产生的抗感染免疫作用主要包括:1皮 肤黏膜及其附属成分对入侵病原体的屏障作用;2补体旁路途径激活 介导产生的抗感染免疫作用;3中性粒细胞在感染部位募集活化及其 对病原体的吞噬杀伤作用。此阶段也是位于表皮和黏膜上皮细胞组织 中的未成熟 DC 摄取病原体等抗原性异物,开始迁徙和加工处理抗原 的阶段。
2.1.1 皮肤黏膜及其附属成分的屏障作用
皮肤黏膜及其附属成 分所组成的物理、化学和微生物屏障是机体阻挡和抗御外来病原体入 侵的第一道防线。
(1) 物理屏障:由致密上皮细胞组成的皮肤和黏膜组织具有机械 屏障作用,可有效阻挡病原体侵入体内。呼吸道黏膜上皮细胞纤毛定 向摆动及黏膜表面分泌液的冲洗作用,均有助于清除黏膜表面的病原 体。
(2) 化学屏障:皮肤和黏膜分泌物中含多种杀/抑菌物质,如皮 脂腺中的不饱和脂肪酸、汗腺中的乳酸、胃液中的胃酸、多种分泌物 中的溶菌酶、抗菌肽和乳铁蛋白等,可形成抗御病原体感染的化学屏 障。
(3)微生物屏障:寄居在皮肤和黏膜表面的正常菌群,可通过 竞争结合上皮细胞、竞争吸收营养物质和分泌杀菌/抑菌物质等方式抗御病原体的感染。例如:唾液链球菌产生的 H2O2 可杀伤白喉杆菌和 脑膜炎球菌;大肠杆菌产生的细菌素对某些厌氧菌和 G+菌具有抑杀作 用。临床长期大量应用广谱抗生素可抑杀消化道正常菌群,导致耐药 性葡萄球菌和白色念珠菌大量生长,引发葡萄球菌性和白色念珠菌性 肠炎。
2.1.2 补体旁路途径激活介导产生的抗感染免疫作用
补体系统是 参与固有免疫应答最重要的免疫效应分子。某些病原体进入皮肤或粘 膜下组织后,可直接激活补体旁路途径在其表面形成 C5b6789 攻膜 复合物使之裂解破坏。补体活化裂解产物具有以下抗感染免疫作用:
- C3a/C5a 作为过敏毒素可直接激活组织中肥大细胞,使之脱颗粒释 放组胺和白三烯等炎性介质和促炎细胞因子,导致局部血管扩张通透 性增强,有助于血管内中性粒细胞和单核细胞进入感染部位;
- C5a 作为趋化性炎性介质可将血管内中性粒细胞招募到感染部位,并使之 活化显著增强其吞噬杀菌作用;
- C3b/C4b 具有调理作用,可增强局 部巨噬细胞和中性粒细胞的吞噬杀菌能力。
2.1.3 中性粒细胞募集活化及其对病原体的杀伤作用
病原体进入 皮肤或黏膜下组织后可被局部有限数量的巨噬细胞吞噬杀伤,并由此 导致巨噬细胞活化释放 IL-8、MCP-1 等趋化性细胞因子和 IL-1、IL- 6、TNF 等促炎细胞因子,使感染部位血管内中性粒细胞和单核细胞外 渗进入局部感染组织并被活化:前者立即发挥强大吞噬杀菌作用;后 者发育分化为巨噬细胞后在早期固有免疫应答阶段发挥重要作用。中 性粒细胞是机体抗细菌/真菌感染的主要效应细胞,对局部感染的病原体具有强大吞噬杀伤作用,通常绝大多数病原体感染终止于此阶段。
2.2 早期诱导性固有免疫应答阶段
早期诱导性固有免疫应答(early induced innate immune response)阶段发生于感染后 4~96 小时。此时被募集到感染部位的 单核细胞已分化发育为巨噬细胞;他们与感染周围组织中募集的巨噬 细胞汇集在一起,被某些病原体或其产物如细菌脂多糖(LPS)和感 染部位组织细胞产生的 MIP-1α/β、IFN-γ和 GM-CSF 等细胞因子激 活后,使其吞噬杀菌能力显著增强;同时产生大量趋化因子、促炎细 胞因子和其他炎性介质增强扩大局部炎症反应和机体固有免疫应答。 该时相也是 NK 细胞、NKT 细胞、γδT 细胞和 B1 细胞活化发挥免疫 效应,产生非特异性抗感染、抗肿瘤免疫保护作用的阶段。
2.2.1 活化巨噬细胞的抗感染免疫作用
募集活化的巨噬细胞可产 生大量趋化因子、促炎细胞因子和其他炎性介质,其中:
- 白三烯和 前列腺素 D2 等炎性介质能使局部血管扩张通透性增强,有助于血管 内补体、抗体和吞噬细胞进入感染部位;同时 IL-8、MIP-1α/β和 MCP-1 等趋化因子可募集更多中性粒细胞和单核细胞进入感染部位, 使机体感染免疫作用显著增强。
- TNF-α和血小板活化因子可使局部 血管内皮细胞和血小板活化,引起凝血形成血栓封闭血管,从而阻止 局部病原体进入血流向全身扩散。
- TNF-α、IL-1 和 IL-6 等促炎细 胞因子作为内源性致热源,可作用于下丘脑体温调节中枢引起发热, 对体内病原体生长产生抑制作用。
- 上述促炎细胞因子也是引发急性 期反应的主要物质,可促进骨髓造血细胞生成并释放大量中性粒细胞 入血,以提高机体抗感染免疫应答能力;还可刺激肝细胞合成分泌一 系列急性期蛋白,其中甘露聚糖结合凝集素(MBL)能与病原体表面 甘露糖、岩藻糖和 N 氨基半乳糖胺残基结合而使补体系统激活,即通 过激活补体 MBL 途径有效杀伤清除病原体,产生抗感染免疫保护作 用。
2.2.2 NK 细胞和固有样淋巴细胞的免疫作用
NK 细胞是具有非特 异性抗肿瘤、抗病毒感染的固有淋巴细胞;NKT 细胞、γδT 细胞和 B1 细胞是一类不同于 αβT 细胞和 B2 细胞的固有样淋巴细胞。
(1) NK细胞介导的免疫保护作用:NK细胞不表达特异性抗原识 别受体,可通过表面杀伤细胞活化/抑制受体对“自身”与“非己”的 识别机制,直接杀伤清除体内某些畸变肿瘤细胞和病毒感染的组织细 胞,有效发挥免疫监视作用。
(2)NK T 细胞和 γδT 细胞介导的免疫保护作用: NK T 细胞 和γδT 细胞为固有样淋巴细胞,其表面抗原识别受体(TCR)较少多 样性,可直接识别结合某些肿瘤、胞内寄生菌或病毒感染细胞表面异 常表达的磷脂/糖脂类抗原和磷酸化抗原等共同抗原成分而被激活。 活化 NK T 和γδT 细胞可通过分泌穿孔素、颗粒酶和表达 FasL 等细 胞毒性介质,对某些肿瘤和病毒感染靶细胞发挥泛特异性杀伤作用, 在机体早期抗肿瘤、抗病毒和胞内寄生菌感染的免疫应答中具有重要 作用。
(3)B1细胞介导的免疫保护作用: B1细胞为固有样淋巴细胞,可通过表面抗原识别受体(BCR)直接识别结合某些细菌共有多糖抗 原(如脂多糖、荚膜多糖等)或变性自身抗原(如变性 Ig、变性单股 DNA)而被激活,并在 48 小时内产生以 IgM 为主的泛特异性抗体。此 类抗体能与多种细菌或变性自身抗原结合,并在补体和吞噬细胞协同 作用下将上述病原菌或变性自身抗原从体内及时清除,对机体早期抗 感染免疫防御和维持免疫自稳状态具有重要意义。
2.2.3 内部屏障的保护作用
当病原体突破机体早期固有免疫防御 体系进入血液循环后,体内血-脑屏障或血-胎屏障可阻止病原体进入 患者中枢神经系统或胎儿体内,对机体重要器官和胎儿产生保护作用。
(1)血-脑屏障:由软脑膜、脉络丛的毛细血管壁和包在壁外的 星形胶质细胞形成的胶质膜组成。其组织结构致密,能阻挡血液中病 原体和其他大分子物质进入脑组织及脑室,对中枢神经系统产生保护 作用。婴幼儿血-脑屏障发育不完善,易发生中枢神经系统感染。
(2)血-胎屏障:由母体子宫内膜的基蜕膜和胎儿的绒毛膜滋养 层细胞共同构成。此屏障不妨碍母子间营养物质交换,但可防止母体 内病原体和有害物质进入胎儿体内,对胎儿产生保护作用。妊娠早期 (3 个月内)血-胎屏障发育尚未完善,此时孕妇感染风疹病毒和巨细 胞病毒有可能导致胎儿畸形或流产。
2.3 适应性免疫应答启动阶段
适应性免疫应答(adaptive immune response)启动阶段发生于 病原体感染和抗原性异物刺激 96 小时后。此时接受病原体刺激的未 成熟 DC 从局部感染组织迁移到外周免疫器官分化发育成熟;成熟 DC 高表达病原体抗原肽-MHC 分子复合物和 B7 等共刺激分子,可有效激 活抗原特异性初始 T 细胞、启动适应性细胞免疫应答。外周免疫器官 中滤泡 DC 捕获病原体等抗原性异物后,可将其滞留在细胞表面供抗 原特异性初始 B 细胞识别、启动适应性体液免疫应答。
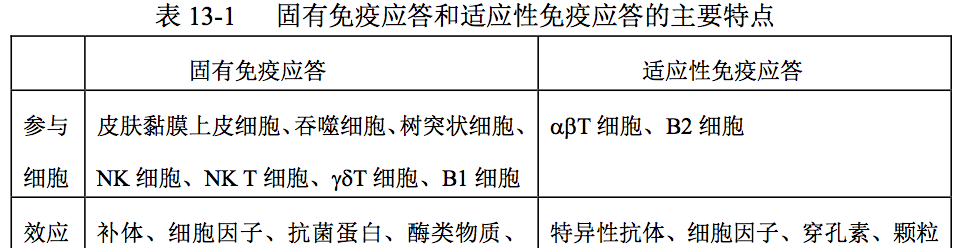
三、固有免疫应答的特点及其与适应性免疫应答的关系
3.1 固有免疫应答的特点
固有免疫细胞介导的免疫应答与适应性免疫应答相比,具有以下 主要特点(表 13-1):
- 固有免疫细胞不表达特异性抗原识别受体, 可通过非特异模式识别受体(PRR)或有限多样性抗原识别受体直接 识别结合病原体及其产物所共有的病原相关模式分子(PAMP)或某些 病原体感染的组织细胞、衰老损伤细胞、畸变肿瘤细胞和变性自身抗 原而被激活迅速产生免疫效应;
- 固有免疫细胞可通过趋化募集, 即“集中优势兵力”之方式,而不是通过克隆扩增、分化为效应细胞 后产生免疫效应;
- 固有免疫细胞参与适应性免疫应答的全过程, 可通过产生不同种类的细胞因子影响适应性免疫应答的类型和强度;
- 固有免疫细胞寿命较短,在其介导的免疫应答过程中不能产生 免疫记忆细胞,因此固有免疫应答维持时间较短,也不会产生再次应 答。

3.2 固有免疫应答与适应性免疫应答的相互关系
固有免疫应答参与适应性免疫应答的全过程,并能影响初始 T 细 胞分化和适应性免疫应答的类型。生理条件下,固有免疫应答与适应 性免疫应答相互依存,密切配合共同完成宿主免疫防御、监视和自稳 功能,产生对机体有益的免疫保护作用。
3.2.1.启动适应性免疫应答
髓样 DC 是体内诱导初始 T 细胞活化能 力最强的抗原提呈细胞,也是机体特异性免疫应答的始动者。他们可 有效激活初始 T 细胞,使之增殖分化为 CD4+Th1/Th2/Th17/Tfh 细胞 和 CD8+CTL 细胞,启动 CD4+ /CD8+T 细胞介导的适应性免疫应答。巨 噬细胞作为专职 APC 可有效激活 CD4+Th1/Th17 细胞和相应 CD4+记忆 T 细胞,启动适应性细胞免疫应答。B 细胞作为专职 APC 将滤泡 DC 表 面滞留或脱落的可溶性抗原或抗原-C3d 复合物摄取加工后表达于细 胞表面,可有效激活 CD4+Th2/Tfh 细胞和相应 CD4+记忆 T 细胞,启动 适应性体液免疫应答。
3.2.2 调节适应性免疫应答的类型和强度
固有免疫细胞可通过对 不同病原体的识别,产生不同类型的细胞因子,影响初始 T 细胞的分 化和适应性免疫应答的类型。例如:
- 在胞内病原体感染情况下,可 诱导髓样 DC 分泌以 IL-12 为主的细胞因子;IL-12 可有效激活 NK 细 胞使之合成分泌 IFN-γ;上述细胞因子可诱导初始 T 细胞分化为 Th1 细胞或 CTL,参与适应性细胞免疫应答。
- 在某些病原体(蠕虫)感 染或蛋白质抗原作用下,可诱导髓样 DC、NKT 细胞和肥大细胞合成 分泌以 IL-4 为主的细胞因子;上述细胞因子可诱导初始 T 细胞分化 为 Th2 细胞,参与适应性体液免疫应答。
- 活化 NK 细胞产生的 IFN- γ 可促进 APC 表达 MHC 分子和抗原提呈,使机体适应性免疫应答能 力增强。
3.2.3 协助效应 T 细胞进入感染或肿瘤发生部位
感染和肿瘤发生 部位是效应 T 细胞发挥免疫作用的部位。效应 T 细胞在外周免疫器官 形成后,停止表达 L-选择素等与其归巢相关的黏附分子和趋化性受 体,为其离开外周免疫器官做好准备;同时新表达迟现抗原-4(VLA- 4)和高表达 LFA-1 等与其从血管内外渗相关的黏附分子和趋化性受 体,为其进入感染/肿瘤发生部位做好准备。感染/肿瘤发生部位固有 免疫细胞和补体活化产生的趋化因子、促炎细胞因子和其他炎性介质, 可使局部血管内皮细胞活化表达 VCAM-1 和 ICAM-1 等多种与效应 T 细 胞表面 VLA-4 和 LFA-1 相对应的黏附分子和对多种免疫细胞具有募 集/活化作用的 RANTEs 等趋化因子,并由此导致效应 T 细胞能与局部 血管内皮细胞黏附、继而定向进入感染/肿瘤发生部位。任何效应 T 细胞都能进入感染/肿瘤发生部位,但只有抗原特异性效应 T 细胞进 入感染/肿瘤发生部位才能发挥免疫作用;其他效应 T 细胞则因局部 组织中没有相应抗原存在,而迅速通过组织输入淋巴管重返血流或发 生凋亡。
3.2.4 协同 CD4+Th1 细胞和抗体发挥免疫效应
胞内病原体感染 的巨噬细胞作为专职 APC 与相应 CD4+Th1 细胞结合,可产生以下主 要作用:
- 诱导 Th1 细胞活化产生以 IFN-γ 为主的细胞因子和表达 CD40L;
- 刺激巨噬细胞高表达 CD40 和 IFN-γR;
- 巨噬细胞通过表 面 CD40 和 IFN-γR 与活化 Th1 细胞表面 CD40L 及其分泌的 IFN-γ 结 合而被活化,使其杀伤能力显著增强,导致胞内病原体被彻底清除。
抗体本身没有杀菌和清除病原体的作用,只有在吞噬细胞、NK 细胞 和补体等固有免疫细胞和分子参与下,通过调理吞噬、抗体依赖细胞 介导的细胞毒作用(ADCC)和补体激活介导的溶菌效应(CAC)等 作用方式,才能有效杀伤和/或清除病原体等抗原性异物。
参考资料
- 《医学免疫学》课件 新乡医学院 宋向凤、张国俊、徐春阳、孙爱平、孙书明、赵铁锁等老师
