【5.7.1】亲和力
一、亲和力概念
1.1 分子互作的检测对象
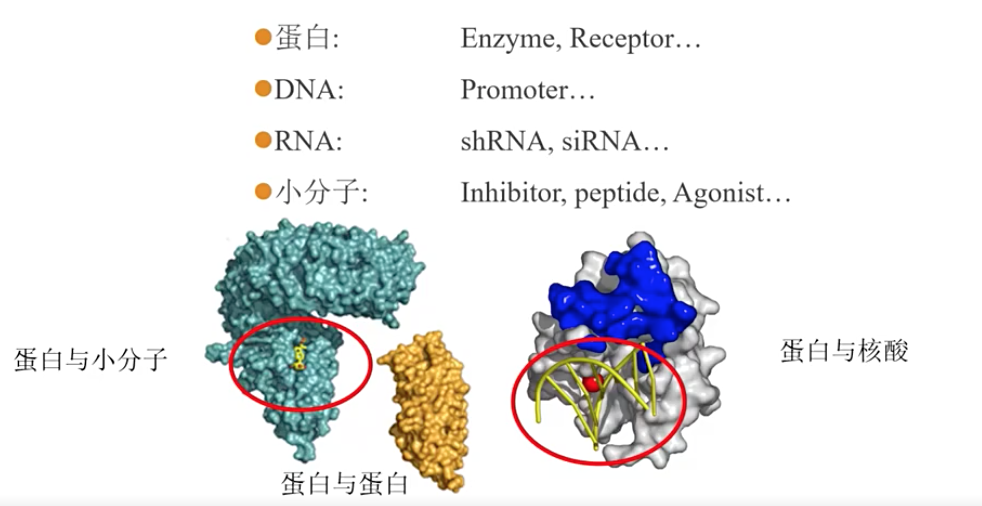
“有结合才会有有功能,有功能一定有结合。”Binding(结合)和Function(功能)是体外药效初步评价中最重要的两环,对于候选药物来说,结合是其药物发挥功能的必要条件,但并非充分的条件。评价一个候选药物,其与靶点分子的结合能力是最基础也是最重要的一方面。药物和靶点分子的结合可分为不可逆结合和可逆结合,上市药物中,绝大数药物和靶点分子的结合可逆结合,这有利于药物进入人体内后能够更容易的代谢,减少可能存在的长期蓄积和安全性风险。不论小分子药物还是大分子药物的研发过程中均会使用亲和力(affinity)来评价候选分子和靶点分子之间结合的强弱,这里需要明确的是亲和力(affinity)是可逆反应过程中候选分子,靶点分子表位和候选分子-靶点分子结合物之间的相对状态的特征函数,其更加专业性和术语化的名称是解离平衡常数KD,单位mol/L(和浓度单位一致)。如果一个靶点提供多个结合位点,有时候也称这种结合强弱为结合力(Avidity)。一般来讲,候选分子和靶点分子的结合越强,即亲和力越大,其解离平衡常数越小。解离平衡常数的单位是浓度单位,这个和在药物研发过程中进行生物学功能评价常常会得到IC50,EC50等单位一致,也常常会使得这些专有名词出现乱用,混用乃至相互比较的情况,从而得到错误的结论。
二、可逆反应
在生物体内,可逆反应是最常见也是最重要的化学反应过程,配体和受体的反应,抗体和抗原的反应,酶和底物反应都是可逆反应的过程。可逆反应过程中以抗原和抗体的反应为例,既有正相的反应过程,即抗原和抗体结合反应生成抗原-抗体复合物的正反应过程,也有逆向反应,抗原-抗体复合物解离反应生成抗原,抗体的逆反应过程,当一个可逆反应中正反应和逆反应的速度相等时,反应体系中抗原的浓度,抗体的浓度和抗原-抗体复合物浓度不再增加也不再减少,可逆反应完成,反应体系中各成分浓度处于动态平衡。针对同一抗原,不同的抗体A,B,相同分子浓度的抗体A,B和同一分子浓度的抗原反应,如果A抗体相对于抗原的亲和力要强于B抗体,那么可逆反应完成各物质形成动态平衡后,A抗体-抗原复合物的浓度要比B抗体-抗原复合物浓度高,也可以说抗原提供的结合位点中,A占据的位点要比B占据的位点要多。这只是对于可逆反应和亲和力简单的描述,怎么将亲和力进行量化进行比较,在无机化学,生物学和药物研发过程中对于亲和力的检测已经有了很多测量方法。
三、亲和力检测的化学原理
基础研究对于可逆反应的过程,以及其化学动力学,热力学原理已经有比较清晰的研究,假设R(受体)和L(配体)是单价反应,如下图所示,可以用下面几个数学公式进行概括1:
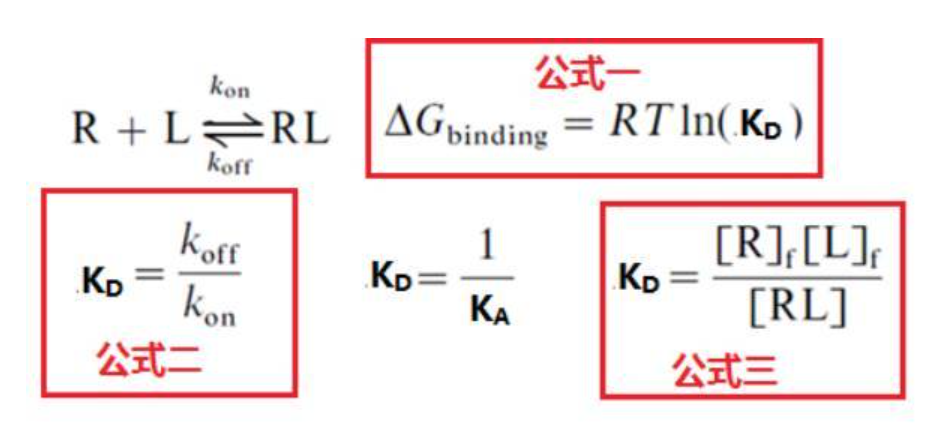
Kon(Ka):结合速率常数,用于评估R(受体)和L(配体)结合形成RL(受体配体复合物)速率快慢的常数,R和L正反应速度V=[R]f*[L]f*Kon(动力学参数)
´ Koff(Kd): 解离速率常数,用于评估RL(受体配体复合物)逆向解离形成R(受体)和L(配体)速率快慢的常数,RL解离形成R和L的逆反应速度V=[R]f*[L]f*Koff。(动力学参数)
´ KA:结合平衡常数:用于评估可逆反应强弱的常数参数,进入平衡状态时,反应体系中自由的R(受体),自由的L(配体)和RL(受体配体复合物)三者之间相关关系的常数。该常数越大,说明R(受体)和L(配体)的亲和力越强。
´ KD:解离平衡常数:用于评估可逆反应强弱的常数参数,进入平衡状态时,反应体系中自由的R(受体),自由的L(配体)和RL(受体配体复合物)三者之间相关关系的常数。结合平衡常数的倒数,该常数越小,说明R(受体)和L(配体)的亲和力越强,单位为mol/L,和因为浓度单位相同便于比较和书写,一般用于表示亲和力的大小,该常数越小,说明R(受体)和L(配体)的亲和力越强。
三个公式分别代表了三种进行亲和力检测的方法,热力学检测方法(公式一);动力学检测方法(公式二)和平衡动力学检测方法(公式三),那么三种检测方法具体的实验方法又有哪些呢?
二、常用的检测方法:
1.2 分子互作的检测方法

亲和力检测常用的方法
- 热力学检测方法: 等温滴定量热法(ITC)
- 动力学检测方法: 采用表面等离子共振技术,英文简写SPR ; 生物膜干涉技术测定方法(BLI)
- 动态平衡测定法(饱和浓度法)
具体介绍见后续章节
2.2 三类检测亲和力方法比较
可逆反应中两个物质的亲和力受到温度和反应体系中溶液环境(盐离子强度,PH值)等影响,不同测定方法在相同反应条件下理论上是一致的。如下图文献记载的流式测定方法和SPR动力学测定方法4,ELISA测定方法和同位素标记测定方法5或者ELISA测定方法和生物膜干涉技术测定方法(动力学检测)进行亲和力测定结果的比较。
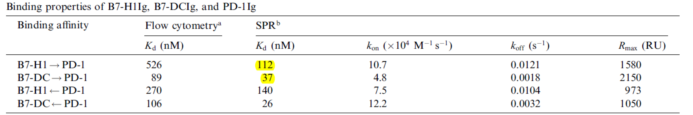
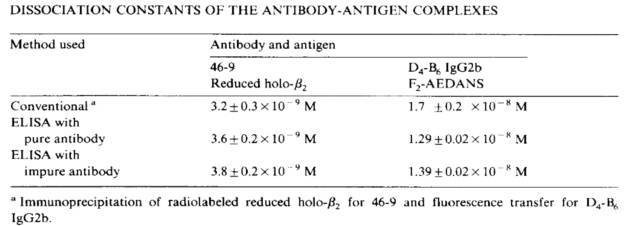
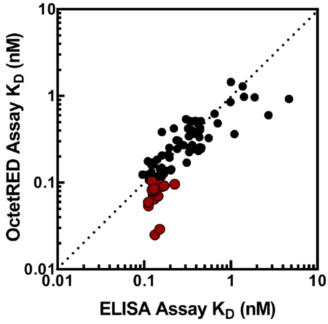
三类检测方法中,热力学检测方法在药物研发过程用的相对较少,动力学检测方法更偏向于仪器分析方法,有很高灵敏度,亲和力测定范围和稳定性,能够得到动力学参数,Konkoff但是仪器成本和维护成本较高,通量较少,适合做最终的功能学评价和质量表征。动态平衡测定法(饱和浓度法)是最为通用的检测方法,其形式也多样,适合从初期的高通量筛选,中期的亲和力评价到最终的产品放行,但检测往往是间接的,需要对检测方法进行多方面验证。不同化学原理亲和力检测方法和检测形式之间的相互关联对照有利于对亲和力检测方法的准确性进行评价和验证。
2.3 亲和力测定方法之竞争法
在动态平衡测定法(饱和浓度法)往往会用到竞争法对待测样品的亲和力进行评价。竞争法的基本过程是选择少量的靶点分子和能够占据该靶点分子80%结合位点的标记的信号分子浓度,加入梯度稀释的待测样品,将三者进行混合反应后检测靶点分子-信号分子复合物的信号值,绘制待测样品浓度和信号的剂量曲线,该曲线往往是反S型,得到IC50值,IC50越小,说明该待测样品和靶点分子的亲和力越强。值得说明的是采用竞争法进行亲和力的检测,其得到的IC50和KD值之间具有相关性,但是并不是等价的。KD值和IC50相关,同时也跟标记分子的加入浓度和标记分子相对于靶点分子的KD值有关,所以得到的IC50值和其他亲和力测定方法测到的KD值不具有可比性。如下图所示采用ELISA技术采用直接法和竞争法得到的EC50(C值)和IC50值(C值),EC50值可认为等价于KD值,而IC50值却不能等价于KD值,EC50值和IC50值相差10倍以上。需要明确的是只有当剂量曲线描述的是分子间相互作用关系即抗原和抗体的反应时,EC50值才能够等价于KD值(如细胞表面的受体和抗体的结合),如果抗原和抗体相互作用后发挥的其他的功能效用得到的EC50(配体引起细胞的增殖,信号代表细胞的数目),其和KD值之间有相关性,但不能够等同。
在有对照品的情况下,采用竞争法可进行亲和力相对强弱的比较,无需标记待测样品,这个在高通量筛选过程中显得比较重要,能够节省大量纯化样品,标记样品的时间和耗费,而且能够避免标记对待测样品可能存在对亲和力的影响,在初期筛选过程中是比较常用的检测方式。需要说明的是采用竞争法是待测样品和标记分子竞争同一靶点分子上相同的结合位点,这样进行筛选能够筛选出针对特定靶点分子结合位点的阳性样品,如果待测样品能够和靶点分子结合但不是该特定的位点,检测结果的阴性,这种情况下为假阴性情况。
2.3 展望
亲和力是评价可逆反应过程中两个分子间相互作用强弱的特征参数。根据其化学原理有热力学测定方法,动力学测定方法和平衡浓度测定法,三种方法在相同的反应条件下测得的亲和力值即解离平衡常数KD值是可比的。但是需要根据具体的实验方案谨慎评估和区分的亲和力KD值和实验结果EC50,IC50之间的关系。
亲和力是药物是否药效的关键功能属性之一,但也不是说越强的亲和力就能发挥越强效果,很多时候需要根据药物作用的机理来选择合适亲和力乃至合适亲和力相关的动力学参数Kon,Koff。准确的评价候选药物亲和力是了解候选药物作用机理的第一步,如在抗体药物进行实体瘤治疗的过程中,太强的亲和力抗体可能会导致大分子抗体只能在实体瘤血管附近聚集,从而影响抗体在实体瘤部位的扩散和蓄积,导致药效的较少,这个时候亲和力较弱10-8nM的抗体要比10-10nM抗体可能会有更好的疗效,更大Koff参数会有更好的效果。又如将抗体的CDR区部分氨基酸突变成组氨酸后,突变抗体可以获得在酸性PH值比中性PH值更弱的亲和力,这个可能有利于抗体在细胞内部核内体和溶酶体酸性条件的解离和扩散,有利于抗体结合的内化受体重新回到细胞表面,继续激活受体介导的细胞活性等。
平衡浓度测定法用来进行待测样品的高通量亲和力筛选最为通用的实验方法,而待测样品往往是混合样品,如在96微孔板中用ELISA方法进行小鼠免疫血清滴度测定,杂交瘤培养上清中的抗体亲和力测定,噬菌体展示淘选筛选过程阳性噬菌体克隆的选择等。这样的样品往往成分比较复杂干扰性强,待测样品中有效成分较少浓度不确定,进行的是单点测定。如何建立起信号强度值和待测样品相对于靶点分子亲和力之间的直接可信的相关联系,排除杂质成分和有效成分浓度不均一造成的影响,这个是简单的了解亲和力的化学原理和理想条件下亲和力评价实验方案无法解决的问题,需要更加深入的理论推导,实验经验和实验条件综合判断。有机会笔者可以进行这方面Case by Case的经验分享。
参考资料
