【6.8.3】别构酶(Allosteric Enzymes)
- 别构酶除了含有活性中心以外,还有别构中心。这是别构酶名称的由来,也是判断一种酶是不是别构酶的主要标准。在酶分子上引入别构中心的目的是通过别构中心来控制的活性中心的催化活性。
- 别构中心是底物以外的分子结合的位点,这些分子被统称为别构效应物(allosteric effectors)。特定的小分子物质可以结合别构中心,引导酶的构象发生变化,进而控 制酶的活性。与别构中心结合的各种小分子物质统称为别构效应物或别 构调节物.
- 其中起激活酶活性的物质称为别构激活剂(allosteric activators),相反,起抑制作用的称为别构抑制剂。
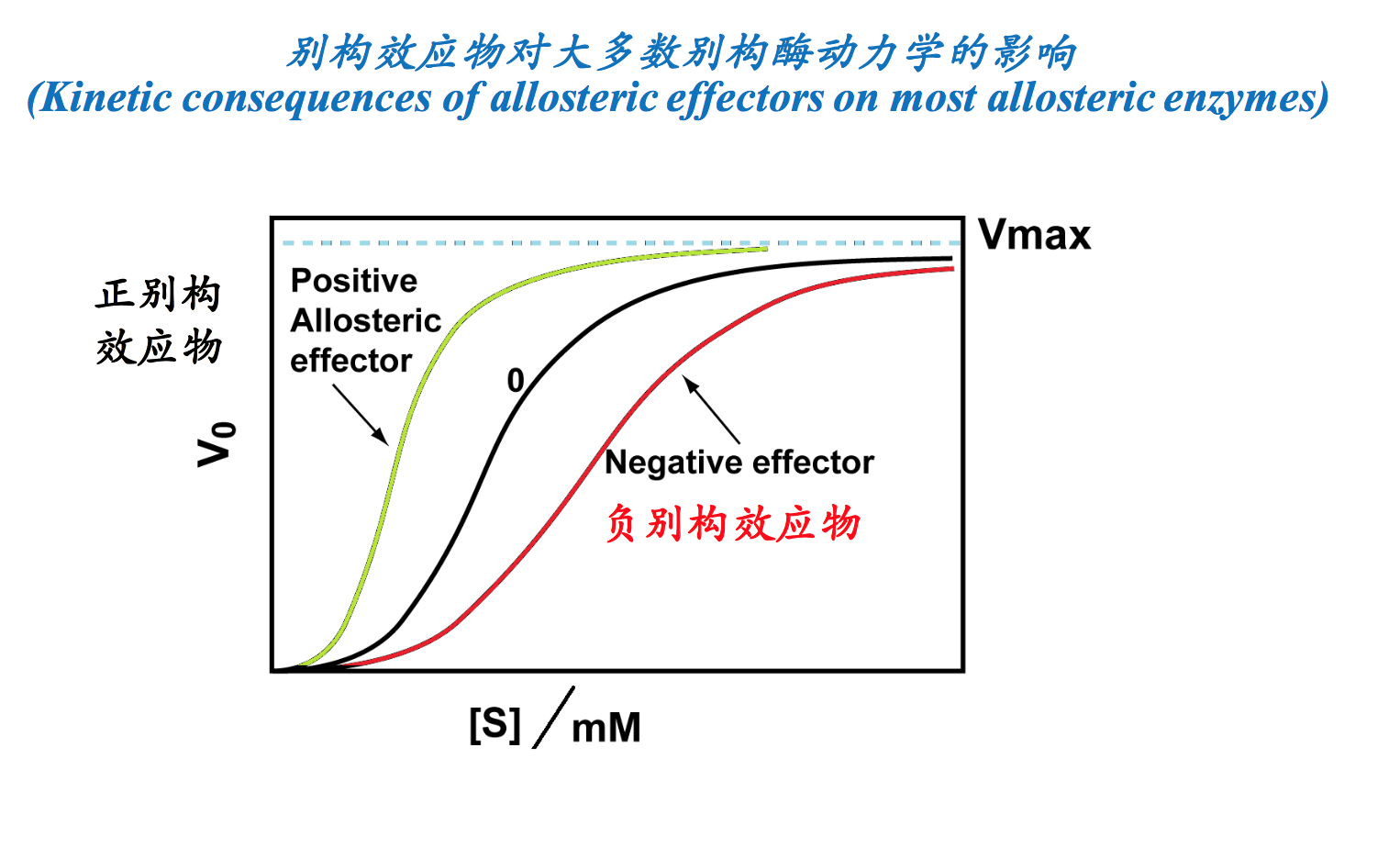
- 通过别构效应物调节酶活性是细胞代谢调控的重要手段之一。而别构效应物的存在可以改变一个典型的对底物呈正协同性别构酶的动力学行为。
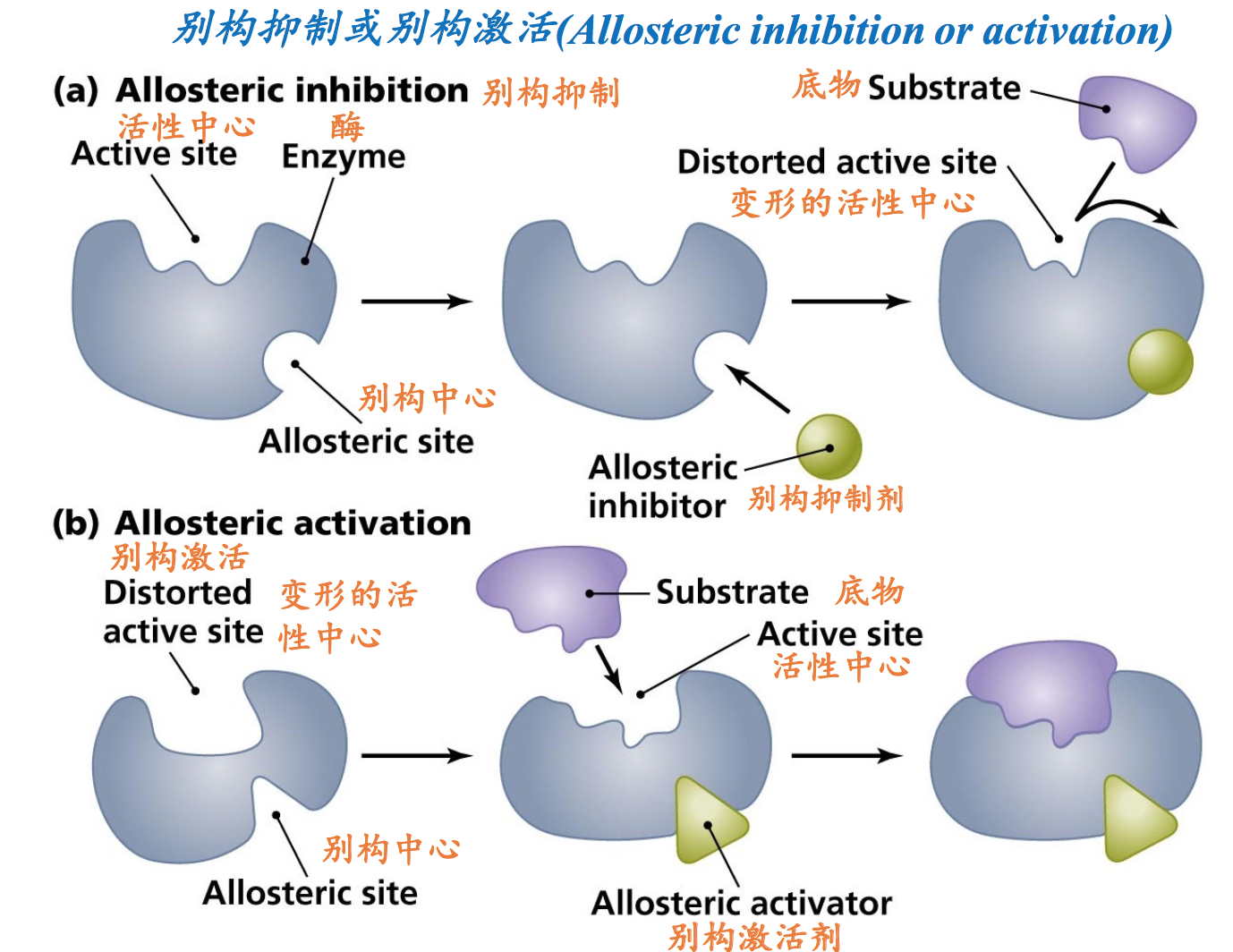
别构酶的性质包括:
- 别构酶一般都是寡聚酶,含有两个或两个以上亚基;
- 具有活性中心和别构中心,活性中心负责底物结合和催化,别构中心负责调节酶反应速率。活性中心和别构中心处在不同的亚基上或同一亚基的不同部位上;
- 多数别构酶不止一个活性中心,活性中心间有同种效应,底物就是调节物。有的别构酶不止一个别构中心,可以接受不同代谢物的调节;
- 别构酶不遵循米氏方程,动力学曲线也不是典型的双曲线型。别构酶的反应速率对底物浓度作图,即V对[S]的作图不服从米氏方程,所得曲线一般不是双曲线。许多别构酶的V对[S]作用呈S形曲线(图6-27)。这种S形曲线表明了结合1分子底物(或效应物)后,酶的构象发生了变化,这种新的构象非常有利于后续分子与酶的结合,大大促进酶对后续底物分子(或效应物)的亲和性,即产生了正协同效应。因此当底物浓度发生较小的变化时,别构酶就可大幅度地控制反应速度,这也是别构酶可以灵敏地调节反应速度的原因。
- 对竞争性抑制的作用表现双相应答(biphasic response)除了别构抑制剂以外,别构酶还可能像其他非别构酶一样受到竞争性抑制剂的作用,典型的竞争性抑制剂是通过模拟底物的化学结构起作用的。但对于一个具有正底物协同性的别构酶来说,如果一种竞争性抑制剂在结构上与其底物过分相似,这种抑制剂就可以像底物一样诱发正协同效应的发生。在这样的情况下,低浓度的竞争性抑制剂能够提高酶与底物的结合能力,反而可以提高反应速度(似乎作为激活剂);而高浓度的抑制剂则以通常的方式减慢反应速度。这样的竞争性抑制剂对别构酶活性的双面影响称为双相应答。
- 与非别构酶相比,别构酶占少数。
特点:
- 含有别构中心,这是判断一个酶是不是别构酶的唯一标准(Possess allosteric sites, which is the only standard for us to judge whether one enzyme is an allosteric enzyme or not).
- 别构效应物与被调节的酶的结合是可逆的Allosteric effectors bind noncovalently to the enzymes they regulate.
- 别构酶一般是寡聚酶(With few exceptions, regulated enzymes are multisubunit proteins)
- 动力学曲线一般是S型(An allosteric enzyme usually has at least one substrate for which the v0 versus [S] curve is sigmoidal rather than hyperbolic)
- 竞争性抑制剂在非常低的浓度下可激活别构酶(Competitive inhibitors can activate allosteric enzymes at a very low concentration)
- 与米氏酶相比,别构酶占少数(As compared to Michaelis enzyme, allosteric enzyme are minorities)

参考资料
- 南京大学 杨荣武老师 《结构生物学》课件
这里是一个广告位,,感兴趣的都可以发邮件聊聊:tiehan@sina.cn
![]() 个人公众号,比较懒,很少更新,可以在上面提问题,如果回复不及时,可发邮件给我: tiehan@sina.cn
个人公众号,比较懒,很少更新,可以在上面提问题,如果回复不及时,可发邮件给我: tiehan@sina.cn

