【8.3.1】α角蛋白
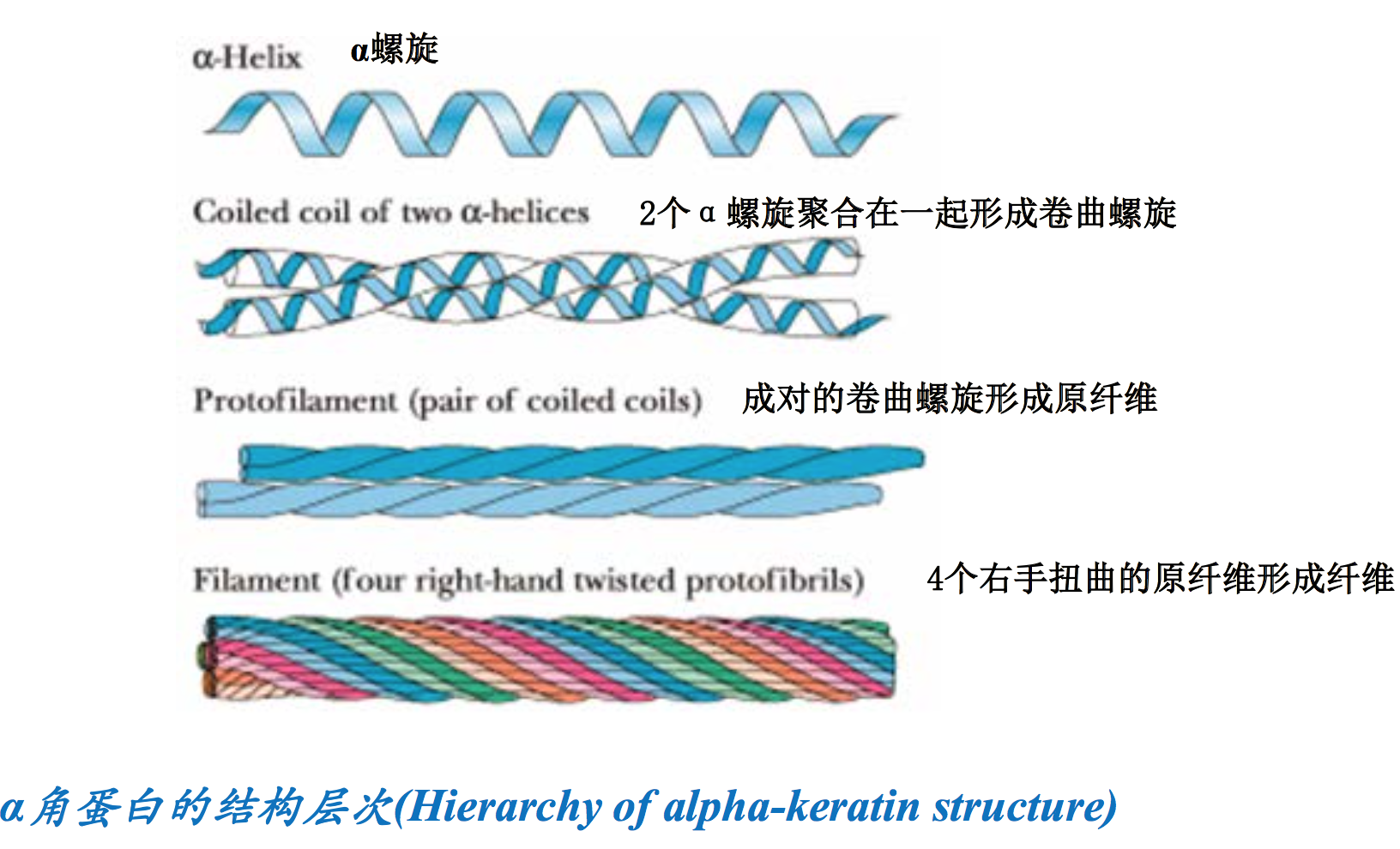
α角蛋白来源于动物的毛发、角、鸟喙和爪子。其一级结构由311~314个氨基酸残基组成。每一个α角蛋白分子在肽链的中央形成典型的α螺旋,而两端为非螺旋区。
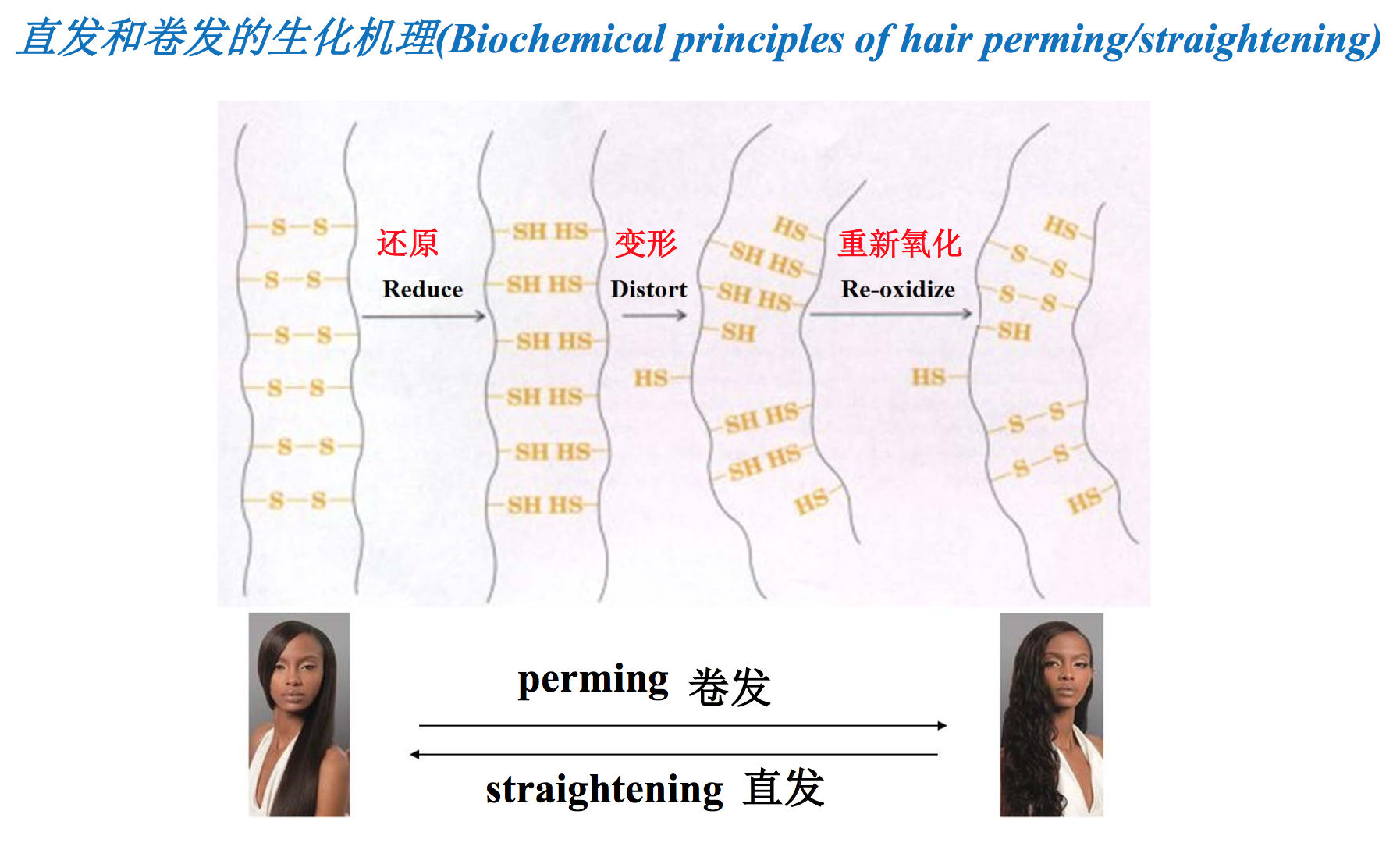
螺旋区由HXXHCXC七肽重复序列组成,这使得两个α角蛋白分子能够通过H位的疏水R基团结合,相互缠绕形成双股的卷曲螺旋。双股卷曲螺旋大大地提高了α螺旋的稳定性。此外,在链间还形成了多个二硫键,这种共价交联可进一步提高α角蛋白的强度。指甲的强度比毛发高是因为含有更多的Cys残基,能形成更多的二硫键。
α角蛋白分子还可以在双股的卷曲螺旋的基础上,先形成原纤维,然后再由原纤维组装成纤维。
总结:
- 一级结构:七肽重复序列——(a-b-c-d-e-f-g)n,a和d为疏水氨基酸,有利于螺 旋之间的聚合(Primary structure:7-residue repeats- (a-b-c-d-e-f-g)n, where a and d are nonpolar. Promotes association of helices)!
- 二级结构:主要为α螺旋(Secondary structure: mainly alpha-helix).
- α螺旋之间通过疏水键和二硫键结合(α-helices associate with each other by hydrophobic interaction and by disulfide bonds)
参考资料
- 南京大学 杨荣武老师 《结构生物学》课件
这里是一个广告位,,感兴趣的都可以发邮件聊聊:tiehan@sina.cn
![]() 个人公众号,比较懒,很少更新,可以在上面提问题,如果回复不及时,可发邮件给我: tiehan@sina.cn
个人公众号,比较懒,很少更新,可以在上面提问题,如果回复不及时,可发邮件给我: tiehan@sina.cn

