【5.1.1.4】毛细管电泳CE
毛细管电泳(CE,capillary electrophoresis),又称高效毛细管电泳(HPCE,high performance capillary electrophoresis)或毛细管电分离法(CESM,capillary electro-separation method)。毛细管电泳包容电泳、色谱及其交叉内容,是一类以毛细管为分离通道,以高压直流电场为驱动力,以样品的多种特性(电荷、大小、等电点、极性、亲和行为、相分配特性等)为根据的分离分析技术。毛细管电泳研究正在向多种前沿领域推广应用,其中 DNA 与 RNA 分析、复杂药物分析、环境分析、医学(特别是代谢组学与临床医学)研究、蛋白质组(多维)分离、糖组分析、手性分离、单细胞分析等工作进展很快
一、 毛细管电泳的基本理论
1.1 电泳
在电解质溶液中,位于电场中的带电离子在电场力的作用下,以不同的速度向其所带电荷相反的电极方向迁移的现象,称之为电泳。
1808年,Reuss(俄国)首次发现电泳现象。
1937年,Tiselius(瑞典)将电泳用于人血清蛋白质混合液的分离:发现样品的迁移速度和方向由其电荷和淌度决定;这是第一次实现自由溶液电泳,同时他也发明了第一台电泳仪。
1948年,Tiselius因对电泳分析和吸附方法的研究,特别是发现了血清蛋白的组分而获得1948年诺贝尔化学奖。
1.2 传统电泳
利用电泳现象对某些化学或生物物质进行分离分析的方法和技术叫做电泳法或电泳技术。传统电泳具有以下分类
(1)按形状分类:U 型管电泳、柱状电泳、板电泳。
(2)按载体分类:滤纸电泳、琼脂电泳、聚丙烯酰胺电泳、自由电泳。
传统电泳分析,操作繁琐,分离效率低,定量困难,因此无法与其它分析相比。1981年,Jorgenson 和 Luckas 用 75 μm 内径石英毛细管进行电泳分析,柱效高达40万/米,这促进电泳技术发生了根本变革,迅速发展成为可与 GC、HPLC 相媲美的崭新的分离分析技术—毛细管电泳。
1.3 毛细管电泳
毛细管电泳在传统电泳技术上采取了两项重要改进:
(1)采用了25-100 μm内径的毛细管。标准毛细管的外径为375 μm,有些管的外径为160 μm。毛细管的特点是:容积小(一根100 cm×75 μm 管子的容积仅4.4 μL);侧面/截面积比大,因而散热快、可承受高电场(100-1000 V/cm);可使用自由溶液、凝胶等为支持介质;在溶液介质下能产生平面形状的电渗流。
(2)采用了高达数千伏的电压。毛细管的采用使产生的热量能够较快散发,大大减小了温度效应,使电场电压可以很高;电压升高,电场推动力大,又可以进一步使柱径变小,柱长增加;毛细管电泳的柱效远高于HPLC,理论塔板数高达几十万块/米,特殊柱子可以达到数百万。
二、 毛细管电泳的原理
2.1 基本原理
带电离子在电场中定向移动时不同的离子具有不同的迁移速度,物质离子在电场中的差速迁移是电泳分离的基础。
当带电离子以速度 v 在电场中移动时,受到大小相等、方向相反的电场推动力(FE=qE)和平动摩擦阻力(F=fv)的作用,得到 qE = fv(q为离子所带有效电荷,E为电场强度,v为离子在电场中的迁移速度,f为平动摩擦系数)。
对于球形离子,f=6πηγ,所以迁移速度 v=qE/6πηγ。
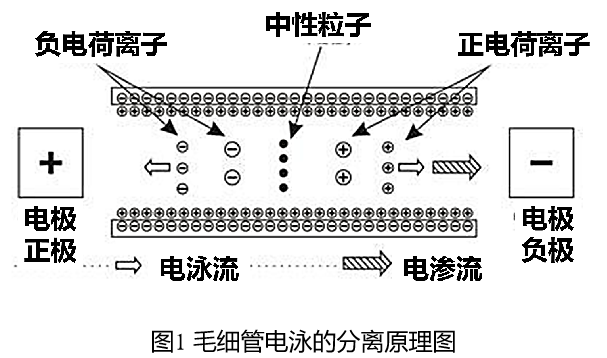
2.2 电渗透现象与电渗流
在电泳过程中,当固体与液体接触时,固体表面由于某种原因带一种电荷,则因静电引力使其周围液体带有相反电荷,在液-固界面形成双电层(图2),二者之间存在电位差。当液体两端施加电压时,就会发生液体相对于固体表面的移动,这种液体相对于固体表面的移动的现象叫电渗现象。电渗现象中整体移动着的液体叫电渗流(electroosmotic flow,简称EOF)。
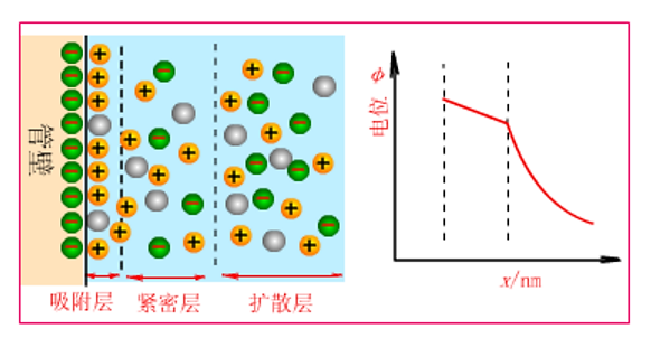
图2 双电层示意图 电渗透的方向取决于毛细管内表面电荷的性质:
(1)内表面带负电荷,溶液带正电荷,电渗流流向负极
(2)内表面带正电荷,溶液带负电荷,电渗流流向正极
以石英毛细管柱为例,内充液pH>3时,表面电离成-SiO-,管内壁带负电荷,形成双电层。在高电场的作用下,带正电荷的溶液表面及扩散层向阴极移动,由于这些阳离子实际上是溶剂化的,故将引起柱中的溶液整体向负极移动。
改变电渗流方向的方法:
(1)毛细管改性:表面键合阳离子基团。
(2)加电渗流反转剂:内充液中加入大量的阳离子表面活性剂,使石英毛细管壁带正电,溶液表面带负电。
在毛细管电泳中,电渗流的速度约等于一般离子电泳速度的5-7倍,因此控制电渗流非常重要。阳离子运动方向与电渗流一致,阴离子运动方向与电渗流相反,中性粒子运动方向与电渗流一致,如图3所示。
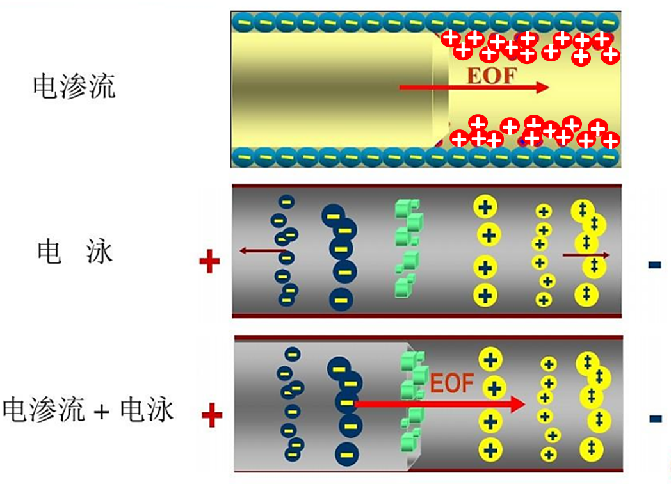
图3 电渗流对电泳中离子迁移的影响
三、 毛细管电泳仪
3.1 工作原理
毛细管电泳仪以毛细管为分离通道,以高压直流电场为驱动力,依据样品中各组分的淌度(单位电场强度下的迁移速度)和分配行为的差异而实现各组分分离。
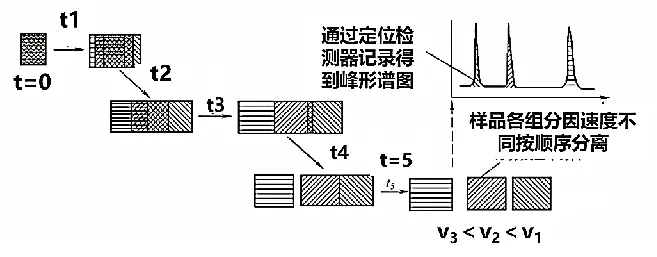
图4 样品的分离过程示意图
3.2 主要构造
毛细管电泳仪的基本结构包括一个高压电源,一根毛细管,一个检测器及两个供毛细管两端插入而又可和电源相连的缓冲液贮瓶,如图5所示。
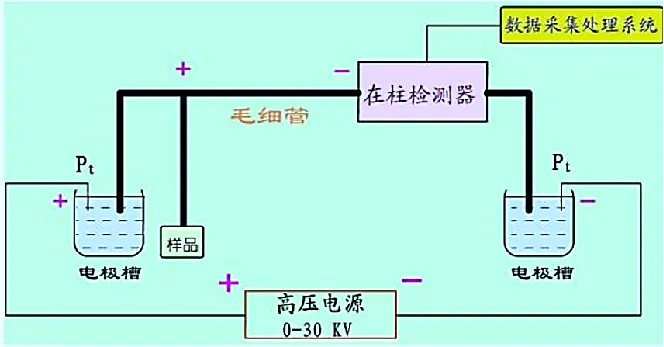
图5 毛细管电泳系统基本构造
(1)高压电源
毛细管电泳仪的高压电源是稳定、连续可调的直流电源;可恒压(电压范围为0-30千伏)、恒流、恒功率输出;具有电场强度程序控制系统;电压稳定性达到0.1%;能做到电源极性易转换。
(2)毛细管柱
毛细管是CE分离的心脏,理想的毛细管必须电绝缘、紫外/可见光透明和富有弹性,目前可以使用的有塑料管、玻璃管、石英管等,其中弹性熔融石英毛细管被普遍使用。毛细管柱内径一般为20-75 μm,外径350-400 μm,长度≤1m。
毛细管上具有检测窗口,一般使用的外涂聚酰亚胺的石英毛细管由于聚酰亚胺涂层不透明,必须使用硫酸腐蚀法、灼烧法、刀片刮除法等对涂层进行剥离得到检测窗口。
(3)缓冲液池
缓冲液池要求化学惰性,机械稳定性好。缓冲液内含电解质,充填于缓冲液池和毛细管中,通过电极、导线与电源连通,是分离室中的导体。
(4)检测器
检测器要求具有极高的灵敏度,可柱端检测,检测器、数据采集和计算机数据处理一体化。CE具有多种检测方法,比如光吸收法、电化学法、电导法、化学发光法、磷光法、荧光法、质谱法等,其中紫外吸收已经非常成熟,是绝大多数商品仪器的主力检测手段,部分商品仪器采用激光诱导荧光检测法(LIF)和高频电导检测法(hfCD)。紫外吸收法既能采用柱上检测方式(图6),也可采用柱后检测方式(图7)。
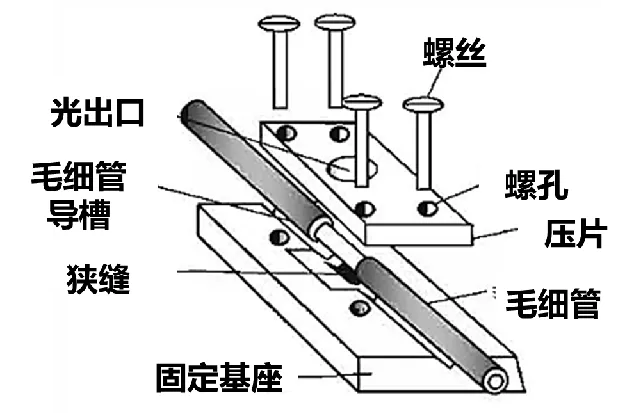
图6 毛细管柱上检测固定方法
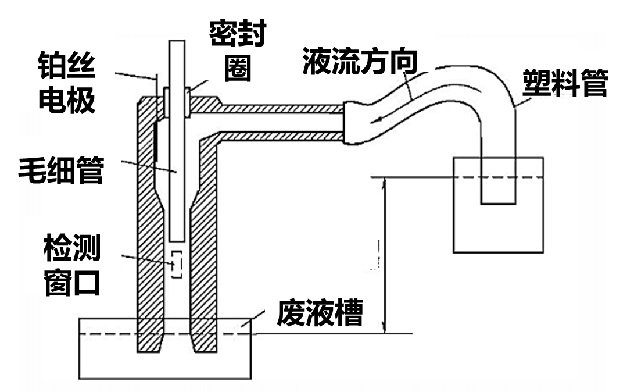
图7 利用鞘流池进行柱后紫外吸收检测
3.3 进样方式
(1)压力进样:压力进样要求毛细管的填充介质具有流动性,比如溶液等。将毛细管的两端置于不同压力环境中时,管中溶液即能流动,将样液带入。利用压缩空气可以实现正压进样,并能和毛细管清洗系统共享,因此商业化的仪器常采用此法。压力进样没有偏向问题,但选择性差,样品及其背景都同时被引进管中,对后续分离可能产生影响。
(2)电动进样:当把毛细管的进样端插入样品溶液中并加上电场E时,组分就会迁移进入管内。电动进样对毛细管内的填充介质没有特别要求,能够完全自动化操作,也是商品仪器必备的进样方法。但是电动进样对离子组分存在进样差别,会降低分析的准确性和可靠性。
(3)扩散进样:利用浓差扩散原理可将样品引入毛细管。扩散进样对管内介质没有任何限制,具有双向性,在样品分子进入毛细管的同时,管中的背景物质也向管外扩散,能抑制背景干扰,提高分离效率。
3.4 分离方式
毛细管电泳有许多不同的模式,因而在分离样品前必须选择合适的分离模式以达到最佳的分离结果。根据简单性原则,首先应该考虑自由溶液分离模式,最后才考虑填充形式的分离模式,如图8所示。

图8 毛细管电泳模式选择流程 不同的分离模式所采用的分离机理有所不同,如图9所示。
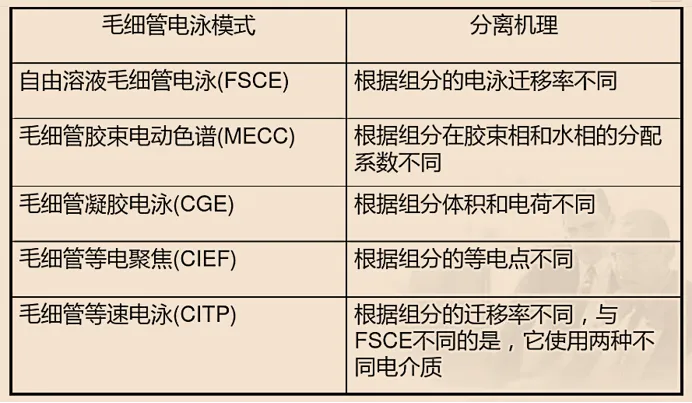
图9 不同的毛细管电泳模式对应的分离机理
四、 毛细管电泳的应用
毛细管电泳分析技术发展迅速,具有分离效率高、所需样品少、应用范围广、分析成本低等诸多优点,是生物化学、分析化学、环境分析中备受关注的分离分析技术之一。
4.1 手性分析
在现代社会中,与人类健康息息相关的医药生产必须考虑手性问题,国际科学界十分重视手性药物的分离分析,毛细管电泳是一种简单高效的手性分析方法。
实例:柯诺辛碱B(Corynoxine B)具有降压,抗心律失常,保护脑缺氧缺血的作用。柯诺辛碱(Corynoxine)是柯诺辛碱B异构体,在不同的神经元细胞系诱导细胞自噬,结构如图10所示。Zhiying Wang等人[1]以环糊精(HP- β -CD)和谷氨酸(TBA-L-Glu)用作分离系统的添加剂,建立了一种灵敏、快速,有效的方法,用于毛细管电泳中的场放大样品堆叠(FASS),成功分离和测定钩藤中的柯诺辛碱和柯诺辛碱B(图11) 。
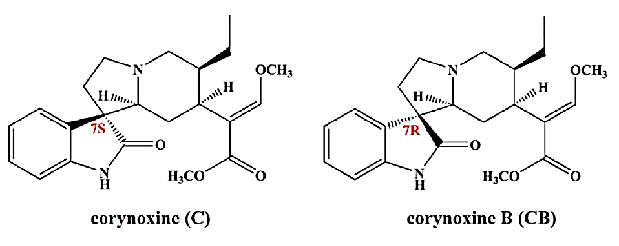
图10 柯诺辛碱和柯诺辛碱B的分子结构图
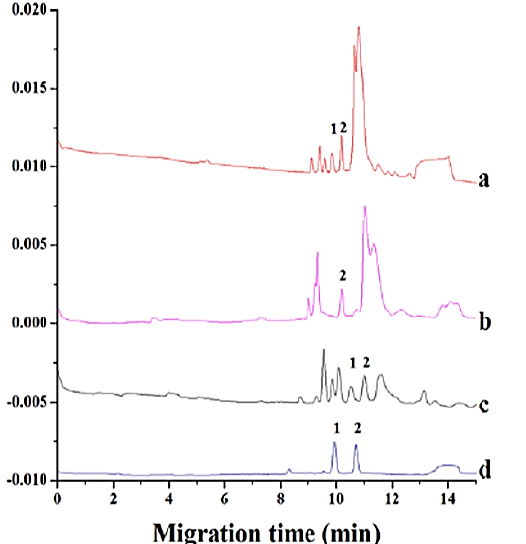
图11 不同样品的毛细管电泳色谱图:峰1为柯诺辛碱B,峰2为柯诺辛碱
4.2 蛋白质分析
蛋白质不仅是有机体的构建材料,也是生物功能分子,如激素、神经递质、酶、抗体等。天然蛋白来自于基因分宜,但不一定能与基因一一对应,翻译后的修饰、代谢、复合或络合等过程会使蛋白质分子的种类复杂化,因此蛋白质的分离分析是一个挑战性的课题。毛细管电泳可用于蛋白质分离研究中的诸多方面。
实例:Huan-Huan Zhao等人[2]结合压力介导微分析(PMMA)和毛细管电泳的毛细管电泳方法建立了电泳介导的微量分析(EMMA),如图12所示,并将其应用于α-葡萄糖苷酶的动力学和抑制动力学研究,以及从天然黄酮中筛选出α-葡萄糖苷酶抑制剂。
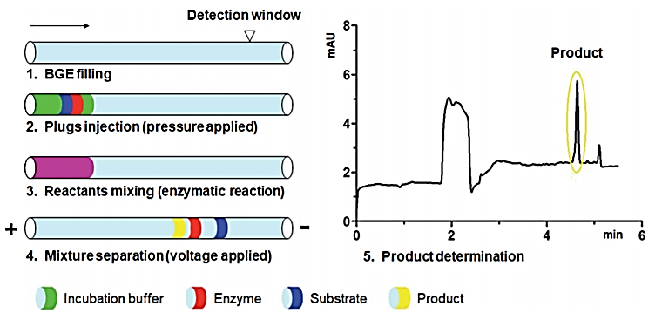
图12 电泳毛细管内酶法测定过程示意图
4.3 DNA及其碎片分析
从1988年毛细管电泳被用于DNA分析后,DNA分析中的测序、PCR产物鉴定、基因突变研究、DNA损伤分析、临床诊断等都开始大量使用毛细管电泳技术。
实例:急性腹泻在全球均有较高的发病率和死亡率,主要发生在儿童和老年人群。目前引起婴幼儿及儿童腹泻的最常见病毒包括轮状病毒(rotaviruses,RV)、诺如病毒(norovirus,NoV)、肠道腺病毒(adenoviruses,Adv)、扎如病毒(sapovirus,SV)及星状病毒(humanastroviruses,HAstV)。目前约40%的腹泻并不能快速准确诊断出病因。病毒的分离培养及鉴定周期较长,免疫学方法在窗口期通常不能反映现症感染,而且单病原体的PCR方法检测通量较低。
蔡德丰等人[3]首次以儿童常见腹泻病毒RV、NoV、Adv、SV及HAstV作为诊断目标,建立多重PCR-毛细管电泳法检测体系,以提高儿童腹泻病毒诊断的效率。5种病毒阳性参考品扩增产物经毛细管电泳后均检测到相应片段,无明显的干扰杂峰出现,其他腹泻病原体核酸对反应体系无影响,见图13。
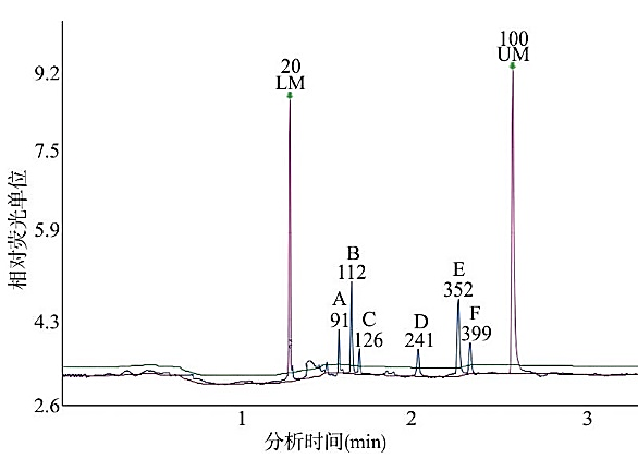
图13 5种腹泻病毒阳性参考品毛细管电泳检测结果
4.4 糖及其缀合物分析
糖是自然界中广泛存在、被人类长期利用的化学物质。糖不仅是动植物的能源(储能材料如糖元)和燃料,也是代谢过程的中间产物。在植物和微生物体中,糖是主要的结构材料。糖也是糖缀合物的重要部件。已经证明,糖及其缀合物在细胞识别以及其他生物分子识别中,具有不可替代的或直接的作用。糖及其缀合物的分析因此受到了越来越广泛的重视。利用毛细管电泳分离糖首先必须解决电荷问题。除糖醒酸、唾液酸、氨基糖以及一些硫酸化糖(硫酸软骨素、硫酸皮肤素、硫酸角质素、肝素等)外,天然糖是不带电荷的,不能在电场中迁移。理论上,可以采用络合、解离、衍生等方法使糖带电。
实例:牛舌草为紫草科植物意大利牛舌草Anchusa italica Retiz.或琉璃苣Borage officinales L.的地上部分,是维吾尔医治疗心脑血管疾病的常用药材之一,具有祛寒补心、爽心悦智、润燥消炎、止咳平喘等功效。多糖有显著的免疫兴奋、抗衰老、抗氧化活性和抗肿瘤等特性。研究牛舌草中的营养成分,特别是其中的糖类成分,对于深入研究其药用价值具有重要意义。依明·尕哈甫等人[4]采用苯酚-硫酸法测定了牛舌草中多糖的含量,同时利用高效毛细管电泳法(HPLCE)测定了单糖组分(图14),旨在为牛舌草的质量评价和进一步研究开发该中药资源提供有益参考。
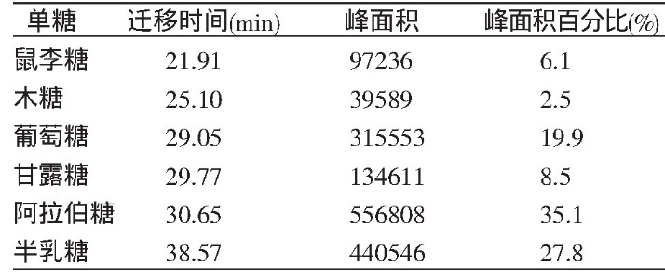
图14 牛舌草多糖中单糖迁移时间、峰面积及峰面积百分含量
4.5 毛细管电泳联用及微流控芯片技术
常规的毛细管电泳虽然具有诸多优点,但是也存在一些问题,比如(1) 由于进样量少,因而制备能力差;(2) 由于毛细管直径小,使光路太短,用一些检测方法(如紫外吸收光谱法)时,灵敏度较低;(3)电渗会因样品组成而变化,进而影响分离重现性。因此,毛细管电泳的联用技术对样品处理、分离和检测具有重要的改进作用。
目前毛细管电泳的联用技术主要分为分离-分离、分离-检测、分离-鉴定、样品处理-分离等类型,比如二维(多维)毛细管电泳、毛细管电泳-质谱联用、毛细管电泳-核磁共振联用、毛细管电泳-化学发光联用、流动注射-毛细管电泳联用等等。
此外,微流控芯片技术也是毛细管电泳的一个重要发展方向。微流控芯片技术是把化学、生物、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上, 自动完成分析全过程。芯片毛细管电泳的通道虽有各种变化,但基础是十字交叉结构,如图15所示,将样品置于连接进样通道的任一电极槽中,在通道两端加上合适的电压,离子样品便会迁移经过分离通道。欲分离时,只需在垂直于进样通道的方向上施加电压,位于交叉口的样品就会进入分离通道.关闭或降低进样通道两端的电压,可以使进样通道中的样品不动或向两边回迁,而进入分离通道的样品则向检测窗口方向迁移并发生分离,经LIF或其他检测器检出样品信号。
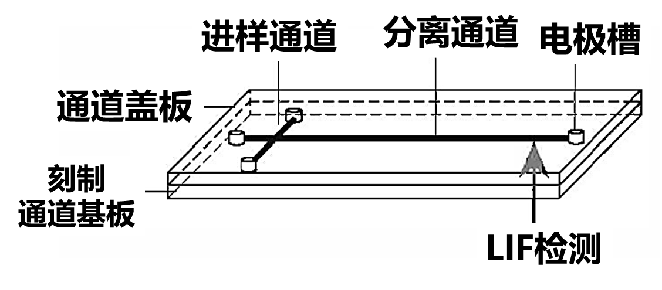
图15 十字型电泳芯片结构
其他补充
在毛细管电泳的多种分离模式中,CEZ法分析主要依靠分子量大小进行分离,cIEF 分析依靠单抗的等电点进行分离,而CEZ 法是依靠单抗类药物电荷/质量比进行分析,是最简单、最常用的毛细管电泳类型。
由于单抗类药物各个变异体之间的质量差别不大,主要变异来自氨基酸的翻译后修饰,具体体现在表面电荷的不同。CEZ 法的分离模式与cIEF 法相似,但前者比后者更简单、更便捷。CEZ法与质谱联用后可以依靠后者对毛细管电泳分离的电荷变异体进行结构分析。在对IgG2 型单抗电荷异质性进行毛细管区带电泳分析时证实CZE 法可以有效分离IgG2 单抗电荷异构体,精密度良好,峰面积RSD < 3. 0%,提示CZE 法可以对该类单克隆抗体的电荷异构体有效分离[53]。在对常用的单克隆抗体电荷异质性分析时证实IEC 法和CZE 法在检测的电荷异构体峰面积时结论基本一致,但二者与CIEF 法和iCIEF 法检测的抗体主峰等电点存在一定差异[38]。虽然CEZ 法操作简单便捷,但单抗类药物的多样性决定了没有任何一个分离条件能对所有的药物实现最佳的分离效果。在采用CZE 法分析单抗类药物的电荷异质性时,应综合考虑pH值、三乙烯四胺( TETA) 浓度、羟丙基甲基纤维素( HPMC) 或羟丙基纤维素( HPC) 等聚合物添加剂等因素。
参考资料
-
https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST2021&filename=ZXYZ202106008&uniplatform=NZKPT&v=Av9WMjErqYR_zD-ILWPlPpufmHkUemdaNxNo5lSsZvjEwH0FfhHnxr8yEMq3wesU . 治疗性单克隆抗体类药物分析技术及其应用
-
Zhiying W , Haitao G , Meng C , et al. Separation and determination of corynoxine and corynoxine B using chiral ionic liquid and hydroxypropyl-β-cyclodextrin as additives by field-amplified sample stacking in capillary electrophoresis. Electrophoresis 2018, 39, 2195–2201.
-
Zhao H H , Liu Y , Chen J . Screening of α-glucosidase inhibitors from natural flavonoids by in-capillary assay combining PMMA and EMMA. Analytical Methods, 2019, 11, 13712019.
-
蔡德丰,陈运生,朱纯青等. 多重PCR-毛细管电泳检测儿童5种腹泻病毒的方法建立及应用. 临床检验杂志, 2020, 38(01):15-18.
-
依明·尕哈甫,王晓梅,热娜·卡斯木等. 牛舌草多糖的含量测定以及毛细管电泳分析. 中医药导报, 2019, 25(03):80-82.
