【3.7.3】蛋白质-蛋白质界面的表征(interface)
我们使用可从蛋白质数据库(PDB)获得的最大数据集来分析蛋白质-蛋白质界面的特征。我们首先比较具有蛋白质核心和非界面( non-interface)表面的界面。结果表明,界面(interfaces)在残基组成,序列熵和二级结构方面与蛋白质核心和非界面表面不同。由于界面,蛋白质核心和非界面表面具有不同的溶剂可及性,因此重要的是研究观察到的差异是由于溶剂可及性的差异还是功能性的差异所致。通过将界面与一组具有与界面相同的溶剂可及性的残基进行比较,我们分离出溶剂可及性的影响。该策略揭示了通过比较具有蛋白质核心的界面和非界面表面无法观察到的残基分布倾向。我们的结论是,界面中存在大量的疏水残基,尤其是芳族残基,并且显然在界面中有利的相互作用包括相反的电荷对和疏水对。出乎意料的是,Pro-Trp对在接口(interfaces)中被过度表示,大概是由于有利的几何形状。使用对序列相似性和结构质量有不同约束的三个数据集重复进行分析。在这些数据集上获得一致的结果。我们还分别研究了异聚体(heteromeric)界面和同聚体(homomeric)界面的特征。
一、前言
蛋白质之间的相互作用在许多生物学功能中起着至关重要的作用。阐明相互作用的机理对分子生物学提出了挑战。研究两种蛋白质之间相互作用的一种通用方法是获得蛋白质-蛋白质复合物的晶体结构,然后研究蛋白质-蛋白质界面的原子特性。许多研究分析了蛋白质-蛋白质界面的特征,以寻找有助于蛋白质-蛋白质相互作用的亲和力和特异性的因素[1-5]。这些分析表明,蛋白质-蛋白质界面的两个表面通常显示出高度的几何和化学互补性。静电力也被认为在蛋白质间相互作用中起着重要的作用[6-8]。多项研究表明,界面在残基组成和残基间接触方面存在偏见[9,10]。 Miyazawa和Jernigan [11]开发了一种从蛋白质中不同残基之间的接触频率中提取残基间电势的方法。后来,Keskin等。 [12]表明,残基间相互作用的平均力的潜力在分子内和分子间相互作用中均保持不变。疏水力在蛋白质间相互作用中的重要作用已被几位研究者证实[13,14]。但是,最近的一项研究[15]认为,对蛋白质-蛋白质结合起主要作用的是亲水作用而不是疏水作用。界面的另一个很好表征的性质是“热点”残基的存在,这些残基对复合物的形成贡献最大[16]。
一些研究将蛋白质-蛋白质界面划分为几种亚型,并分析了每种亚型的特征。琼斯和桑顿[17]提出了强制性相互作用和短暂性相互作用之间的区别。使用机器学习方法,Block等 [18]能够提取预测强制性和短暂相互作用的理化特性。 Ofran和Rost [10]将蛋白质-蛋白质界面分为六种类型:域内,域-域,均聚物,杂聚物,同型复合和异型复合(intra-domain, domain–domain, homo-obligomer, hetero-obligomer, homo-complex, and hetero-complex)。 Chakrabarti和Janin [19]基于溶剂的可及性将界面分为芯层和边缘(core and a rim)。 Cho等 [20]表明不同功能类型的蛋白质-蛋白质相互作用具有特定于它们的不同分子相互作用。
我们从蛋白质数据库(PDB)中提取了所有蛋白质-蛋白质界面[21],并获得了三个数据集,这些数据集比以前的研究中使用的任何其他数据集都大得多。每种蛋白质分为三个不相交的组:界面,蛋白质核心和非界面表面。比较表明,这三组在残基组成,序列熵和二级结构上有显着差异。由于界面,蛋白质核心和非界面表面具有不同的溶剂可及性,因此不知道这些差异是由于溶剂可及性的差异还是功能性的差异所致。为了排除溶剂可及性的影响,我们将界面与一组残基进行了比较,这些残基是从总残基中随机选择的,并且具有与界面相同的溶剂可及性。结果显示出明显的趋势,即疏水性残基和芳族残基在界面中更常见,而亲水性残基则较不常见。请注意,无法通过比较具有蛋白质核心的界面和非界面表面来发现这种趋势。我们使用这三个数据集重复分析,并获得一致的结果。基于交互链的相似性,我们将接口分为异构接口和同源接口(heteromeric interfaces and homomeric interfaces)。比较显示两种类型的界面在残基组成,序列熵,二级结构,大小和接触偏好方面存在显着差异。
二、材料和方法
2.1 Dataset100,Dataset30和Dataset30_3选择结构
- 获得了具有至少两条蛋白质链的PDB中的所有蛋白质复合物,其中每条链中具有至少50个氨基酸。我们尝试了不同的最小长度阈值,范围从20到100个氨基酸。没有观察到界面特性的明显差异。
- 为了消除晶体堆积,基于蛋白质四级结构(PQS)数据库将PDB配合物分为单个四级结构[22]。在PQS数据库的构建中,根据掩埋面积,掩埋残留物的数量,折叠的δ-溶剂化能,界面上盐桥的数量和二硫键的存在,使用一种程序来区分晶体堆积和生物界面。然后在每个四级结构中,如果一条链上的掩埋面积至少为200Å2,则一对蛋白质链被视为相互作用。 SPIN-PP数据库( http://honiglab.cpmc.columbia.edu/SPIN/intro.html )中使用了相同的掩埋区域阈值。在某些研究中,一条链上的最小掩埋面积为400Å2,用于定义生物界面(在[3]中进行了综述)。在这项研究中,我们还尝试了最小埋入面积为400Å2。观察到的唯一区别是,在接口大小的分布中,较少的接口具有较小的大小,因为已删除了一些较小的接口。没有观察到其他性质的明显差异。使用NACCESS [23,24]计算掩埋面积。因此,从一组四元结构中获得了一个界面数据集。
- 然后,从PDB提供的序列簇(ftp://ftp.rcsb.org/pub/pdb/derived_data/NR/)中获得序列相似性信息。两个界面之间的相似性定义为界面蛋白质链之间的最高序列相似性。首先,删除冗余数据,以便数据集中没有相同的接口。
- 结果数据集包含6,545个接口。此数据集称为Dataset100,其中100表示任意两对之间的相似度低于100%。具有高度相似性的接口已从Dataset100中删除,因此任何两个接口之间的相似性都低于30%。结果数据集(称为Dataset30)具有2557对交互链。然后,从Dataset30中移除所有分辨率> 3Å的结构。结果数据集(称为Dataset30_3)由2,310对相互作用的链组成。
2.2 蛋白核心,界面和非界面表面 Protein Cores, Interfaces, and Non-interface Surfaces
我们根据Ofran和Rost [10]中的描述定义了残基接触:如果两个残基之间的距离小于6Å,则两个残基会接触。蛋白质的界面残基是与相互作用蛋白质的残基接触的残基。蛋白核心残基是其相对溶剂可及性(rASA)小于25%的非界面残基。非界面表面残基是其rASA至少为25%的非界面残基。使用NACCESS程序计算残留物的rASA [23,24]。与所有其他研究一样,界面残基是基于PDB配合物上已知的相互作用表面定义的。获得的一些非界面残基可在其他未知相互作用中充当界面残基。为了评估其对分析结果的影响,必须知道蛋白质上相互作用位点的全部知识。不幸的是,我们今天的数据还远远不够完整。
2.3 异构接口和同质接口 Heteromeric Interfaces and Homomeric Interfaces
如果两个相互作用的链具有大于95%的序列同一性,则该接口为同源接口,否则为异源接口。我们使用Dataset100来比较异构接口和同源接口的属性。数据集100包含3990个同质异构接口和2555个异质异构接口。
2.4接口倾向(原始接口倾向,RIP) Interface Propensity (Raw Interface Propensity, RIP)
设Fi为数据集中类型i的残基数,fi为接口中类型i的残基数,wi = fi /Σmfm和Wi = Fi /ΣmFm。残基i的界面倾向由log2(wi / Wi)给出。用wi分别替换蛋白质核心和非界面表面中的残基类型i的分数,来计算残基对蛋白质核心和非界面表面的倾向。
2.5标准化接口倾向(NIP) Normalized Interface Propensity (NIP)
从总残留物中随机提取残留物,以使生成的组具有与界面残留物相同的相对溶剂可及性(rASA)分布。结果集将称为SetrASA,其中rASA表示数据集与接口具有相同的rASA分布。设si为SetrASA中类型i的残基数,且Si = si /Σmsm。残基类型i的归一化界面倾向由log2(wi / Si)给出,其中wi如上定义。
2.6 Contact Preferences
令Cij为类型i和j的残基形成的界面交叉接触的数量。类型i和j的残基之间的原始接触频率由(Cij / Σm,nCmn)给出。类型i和j的残基之间的接触优先级由log2((Cij /Σm,nCmn)/(wi × wj))给出,其中wi和wj如上定义。注意,接触优先级由原始接触频率的对数除以残基类型i和j的频率给出。
三、结果
3.1接口特性 Characteristics of Interfaces
每种蛋白质分为三个不相交的组:蛋白质核心,界面和非界面表面。使用Dataset100分析包括残基组成,二级结构,序列熵,接触偏好和大小的界面属性。
3.1.1 残留成分 Residue Composition
图1A比较了蛋白质核心,界面和非界面表面的残基组成。根据Kyte和Doolittle亲水指数[25],残留物以增加疏水性的顺序排列。比较表明,在这三组中,蛋白质核心具有最高的疏水残基部分(例如,Met,Cys,Phe,Ile,Leu和Val),而非界面表面的最少。这表明疏水残基在蛋白质核心中是优选的,并且对于非界面表面是不利的。对于亲水性残基(例如,Arg,Lys,Glu和Asp)观察到相反的趋势。图1B显示,所有残基类型对蛋白质核心和非界面表面都具有相反的倾向,并且His,Tyr和Gly是一个例外,界面倾向介于蛋白质核心和非界面表面之间。
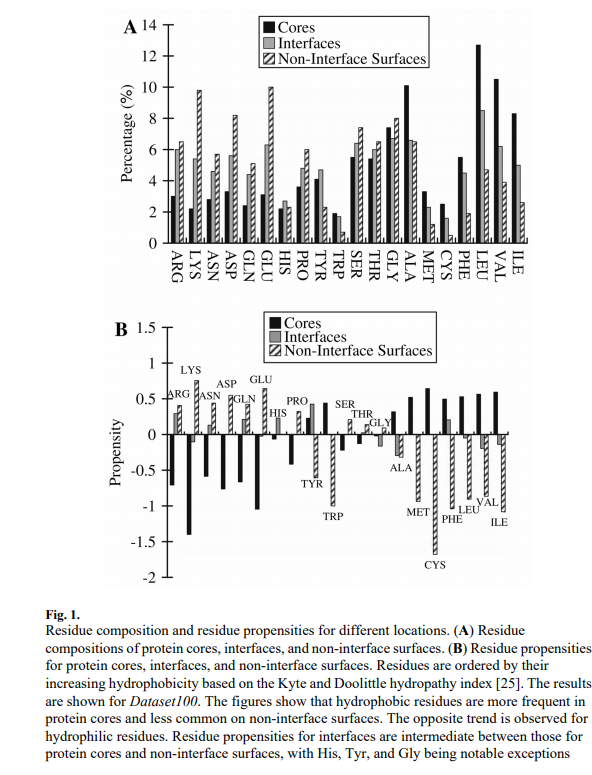
3.1.2 序列熵 Sequence Entropy
从HSSP数据库( http://www.cmbi.kun.nl/gv/hssp/ )中提取残基的序列熵值。序列熵显示每个残基位置的保守性。在0–100的范围内将其标准化,最低的序列熵值对应于最保守的位置。图2比较了蛋白质核心,界面和非界面表面的序列熵分布。比较表明,在这三组中,蛋白质核心在低序列熵区域(序列熵<40)中具有最高比例的残基,而非界面表面的残基比例最低。在高序列熵区域(序列熵≥40),观察到相反的趋势。 令A»B表示A比B更保守。结果表明,保守的趋势是蛋白质核心残基»界面残基»非界面表面残基。在一项基于少量瞬时蛋白质-蛋白质复合物的研究中,Nooren等人[26]表明界面残基比表面残基更保守。在这里,对于更大的数据集可以获得一致的结果。

3.1.3 二级结构 Secondary Structure
我们考虑DSSP程序定义的八类二级结构[27]。 图3比较了蛋白质核心,界面和非界面表面的二级结构组成。 比较表明,在这三组中,非界面表面在S(弯曲)和T(转向)中的残基比例最高,蛋白质核心最小,界面处于中间。 对于E类(延伸链),观察到相反的趋势。 对于其他类别的二级结构,没有观察到明显的位置偏好。

3.1.4 Contact Preferences
图4A显示了由(Cij /Σm,nCmn)给出的界面上的接触频率,其中Cij是类型i和j的残基之间的接触数。图4B显示了log2((Cij /Σm,nCmn)/(wi×wj))给出的接触偏好,其中wi和wj是残基类型i和j的频率。在图4B中,以红色显示积极偏好,以蓝色显示消极偏好,以绿色显示中性偏好。通过增加疏水性将残基按顺序放置。图4A和B的比较表明,通过各个残基类型的频率对原始接触频率进行归一化,使得疏水性接触,芳族接触和带相反电荷的残基之间的接触具有较高的优先级(图4B中的红色)。图4B显示疏水残基之间的接触在界面中是优选的。这些高度优选的触点对应于图4B右下角的红色区域。 Cys-Cys接触具有最高的偏好之一,这一事实表明这种接触在蛋白质-蛋白质相互作用中具有重要作用。带有相反电荷的残基之间的接触(Arg-Asp,Arg-Glu,Lys-Asp和Lys-Glu)在界面中也是优选的。这些联系人在图4B的左上角附近形成几个红色条目。这些结果与先前的主张一致,即二硫键,盐桥和疏水相互作用代表了蛋白质与蛋白质相互作用的主要力量[6、9、10、28]。据报道,两个芳环的面对面排列有利于相互作用[9]。在此,观察到对于不同芳族残基之间的接触的高度偏好。脯氨酸环和芳香环之间的相互作用类似于两个芳香环之间的相互作用[9],这可以从对Pro-Trp(P-W)对的更高偏爱中看出。 Keskin等。 [12]使用“溶剂介导的”电位和“残基介导的”电位研究了蛋白质-蛋白质界面上的残基接触。本研究中观察到的界面中Cys-Cys接触,疏水接触和芳族接触的丰度与Keskin等人报道的这些接触的残基介导电势的低值一致。 [12]。

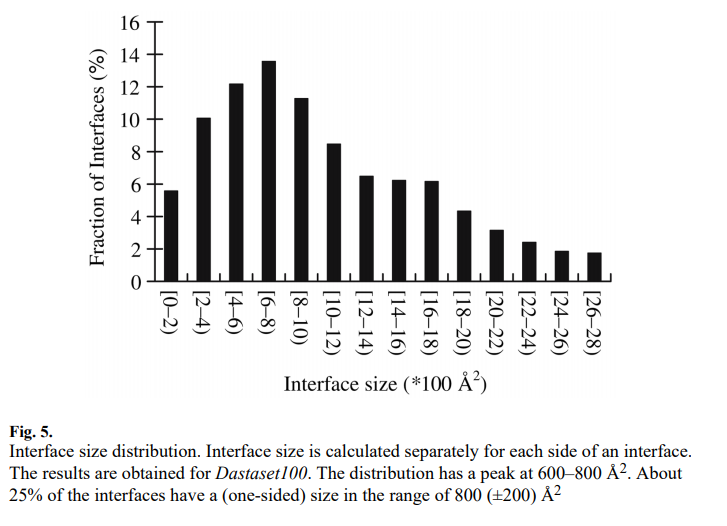
3.1.5 接口尺寸 ( Interface Size)
接口大小是针对接口的每一侧分别计算的。 图5显示,界面尺寸范围很广,并且分布的峰值在600-800Å2的范围内。 平均界面尺寸为1,227 Å2。 数据集中14%的界面尺寸在600–800Å2之间。 在基于一组75个杂合体的研究中,Lo Conte等人 [29]发现大多数界面的总掩埋面积(即界面两侧的总掩埋面积)在1600(±400)Å2的范围内,大约等于界面的每一侧 800(±200)Å2。 此处,约25%的界面(单面)尺寸在800(±200)Å2范围内。
3.2 残留物组成,保守性和二级结构的差异是由于溶剂可及性或功能性的差异引起的吗?
根据我们的定义,蛋白质核心残基的相对溶剂可及性(rASA)低于25%,非界面表面残基的rASA等于或大于25%,界面残基的rASA介于0%至100%之间。以上结果表明,蛋白质核心,界面和非界面表面在残基组成,保守性和二级结构方面存在差异。但是,由于这三个组具有不同的可及性,因此不清楚这些差异是由于溶剂可及性的差异还是其他原因所致。为了区分溶剂可及性的影响,我们从总残留物中随机提取残留物,以使所得的残留物组具有与界面相同的rASA分布。结果数据集将称为SetrASA,其中rASA表示该数据集具有与接口相同的rASA分布。然后,我们将接口与SetrASA进行比较。从Dataset100中独立提取了五个不同的SetrASA。每个SetrASA的大小约为全部残留物的60%。
3.2.1 残留物组成和界面倾向 Residue Composition and Interface Propensity
图6比较了SetrA-SA和界面的残基组成。比较表明,与SetrASAs相比,界面具有更多的芳族残基(Tyr,Trp和Phe)和疏水性残基(Cys,Met,Ile,Leu和Val)。具有中等疏水性的残基(Ser,Thr,Gly和Ala)在界面中的含量不足。除Arg外,所有带电残基在界面中的含量均不足。
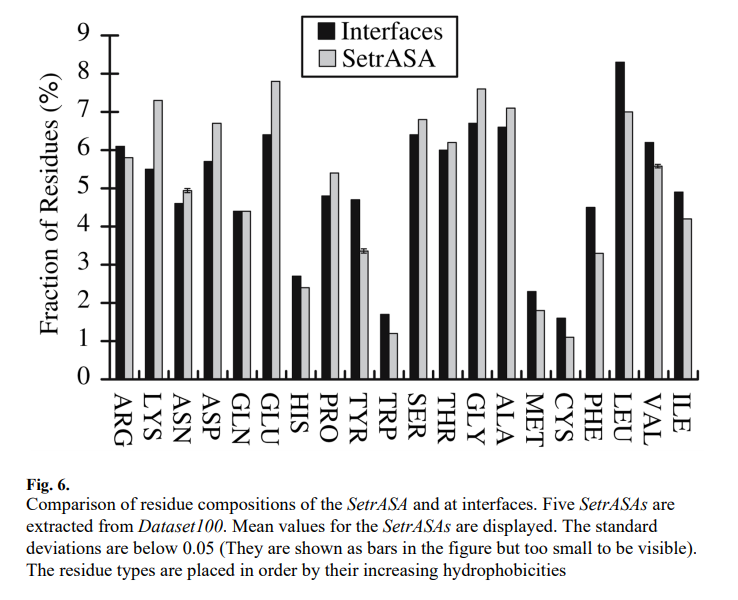
通过将界面的残基组成与SetrASA的残基组成进行比较,我们计算残基的界面倾向性(归一化界面倾向,NIP),即倾向(i)= log2(wi / Si),其中Si是残基的分数SetrASAs中的i和wi是接口中残基i的分数。我们将这个倾向命名为标准化接口倾向(NIP),因为可以将SetrASA视为根据接口的rASA分布进行了标准化的总残留量的一个版本。结果显示在图7中,其残基类型由于疏水性的增加而按顺序排列。图7显示NIP揭示界面对疏水残基具有较高的偏好,而亲水残基在界面处不是优选的。在图7的右侧(疏水端),残基的界面倾向很高,Cys的总体倾向最高。在左侧(亲水端),残基(Arg和His除外)具有负倾向。这表明界面比基于其暴露的预期更疏水。图7还显示了芳族残基具有很高的界面倾向。

我们将NIP与通过比较接口与所有残基的接口倾向(原始接口倾向,RIP)进行比较,这由log2(wi / Wi)给出,其中Wi是总残基i的比例,wi是界面中残渣i的分数。图8显示NIP揭示了一种趋势,疏水性残基在界面中是优选的,而亲水性残基在界面中是不利的,而RIP并未揭示这种趋势。 RIP和NIP中许多残基具有相反的符号。在疏水和极性残基上看到了惊人的差异。 Ile,Val,Leu和Met的NIP值较高,但RIP值为负值。 Asn,Asp,Gln和Glu的NIP为负或中性,而RIP的相应值为正或中性。 Cys和芳香族残基(Tyr,Trp和Phe)具有较高的正NIP,但仅具有较弱的正RIP。 RIP和NIP定义的区别在于,将NIP接口中的残基与具有相同rASA分布的一组残基进行比较,而将RIP接口中的残基与溶剂可及性与溶剂可及性不同的所有残基进行比较。RIP和NIP值之间的差异表明溶剂可及性会影响残留物的分布。因此,在寻找可以将界面与蛋白质其余部分区分开的特征时,考虑溶剂可及性的影响至关重要。
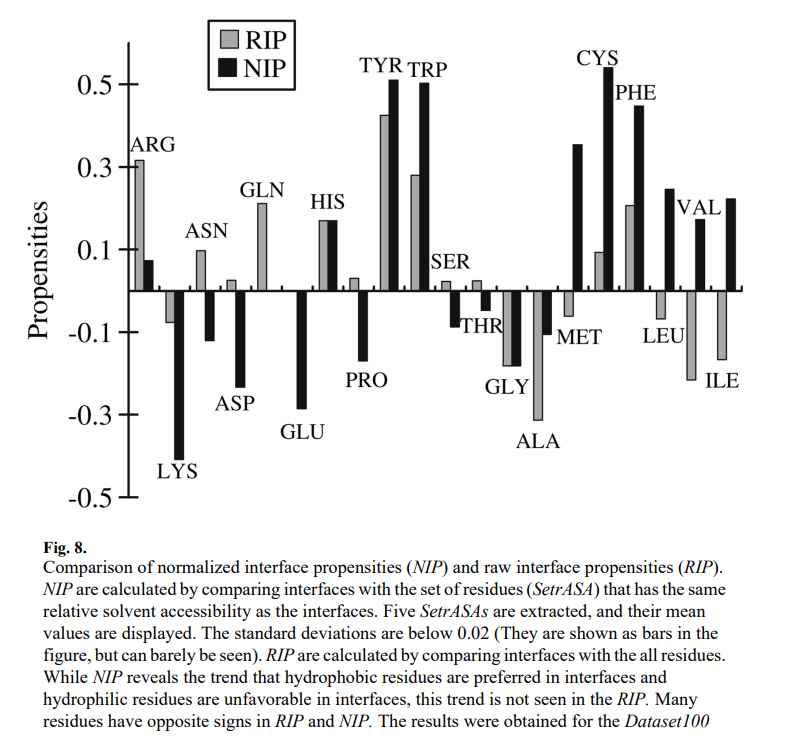
先前的研究在界面倾向方面得出了矛盾的结论。 例如,一些研究表明,Ile,Val和Leu具有较高的界面正倾向[17、29、30],而Ofran和Rost的研究[10]则表明这些残基对界面具有负或弱的蛋白质界面正倾向。 。 我们的结果表明,使用NIP评估时,这三个残基具有较高的正倾向,而使用RIP评估时,这三个残基具有负的倾向。 在Ofran和Rost的研究中,界面倾向是使用SWISS-PROT作为背景来计算的,因此结果类似于本研究中基于RIP的结果,后者是以总残留物为背景来计算的。 在琼斯和桑顿的研究中[31],卢孔戴等人[29],以及Bahadur等。 [32],基于残留物的可及表面积计算界面倾向,其结果与此处基于NIP的结果相似。
3.2.2 序列熵 Sequence Entropies
SetrASA和接口的序列熵在图9中进行了比较。结果显示,接口具有更多的残基,序列熵较低(保守)。 这表明接口比SetrASA更保守。 从上面的结果(见图2)表明,蛋白质核心比界面更保守,而蛋白质界面又比非界面表面更保守。 在这里,图9显示界面比其暴露更保守。
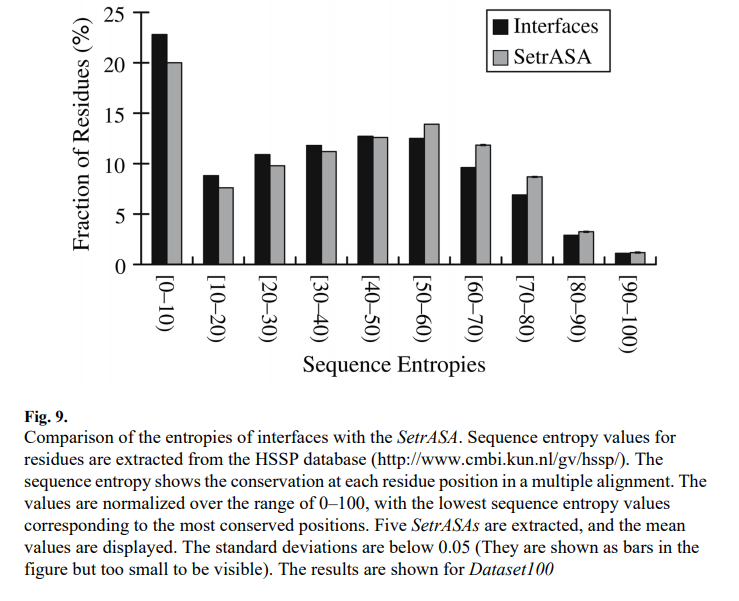
3.2.3 二级结构 Secondary Structures
SetrASAs的二级结构组成与界面的比较如图10所示。与SetrASAs相比,界面在E(延伸链)和H(α螺旋)中的残基略多,而在S(弯曲)和T(转弯)。尽管如此,就二级结构组成而言,接口和SetrASA之间没有显着差异。尽管上一节中的结果(如图3所示)显示了蛋白质核心,界面和非界面表面之间的二级结构组成有些差异,但是在此,图10显示界面与一般情况没有太大差异。校正溶剂可及性的影响后,蛋白质的二级结构组成。这表明蛋白质核心,界面和非界面表面之间二级结构组成的差异主要是由于三组内可及性的差异,而不是功能不同。 Raih等。 [33]通过比较界面和表面来研究二级结构类型的界面倾向。他们的结果表明,_(循环)和S(弯曲)在接口处更为频繁。该观察结果可以直接归因于界面和表面可及性的差异。

总而言之,为了排除溶剂可及性的影响,我们比较了具有与溶剂可及性相对分布相同的残基集(SetrASA)的界面。 结果表明,疏水残基和芳香残基具有很高的界面倾向。 亲水性残基(Arg和His除外)具有负性; 并且界面比其余蛋白质更保守。
3.3 结果是否在不同数据集中一致?
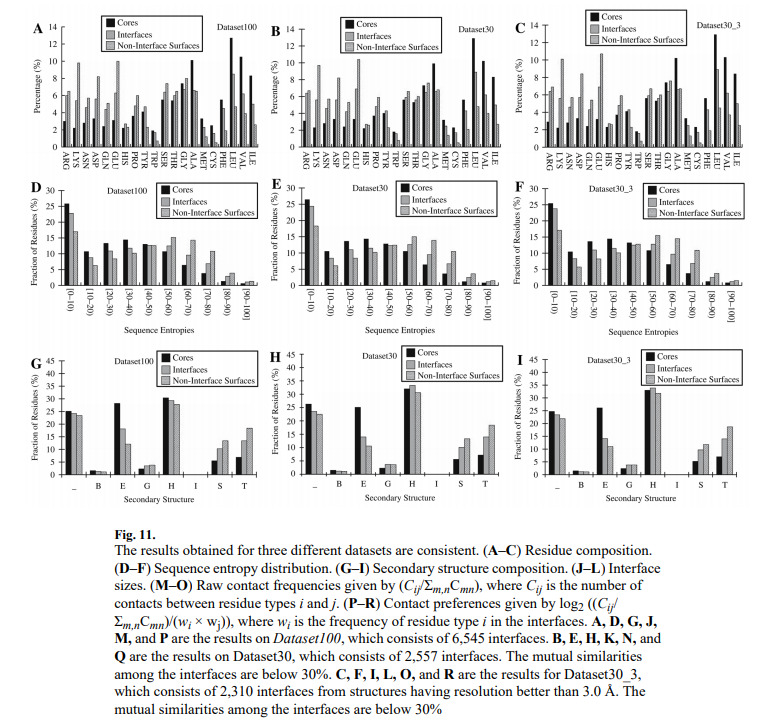
到目前为止,我们报告的结果是使用Dataset100获得的。 为了评估结果在不同数据集之间是否一致,我们分析了三个数据集的界面属性,这些数据集对序列相似性和结构质量有不同的约束:Dataset100,Dataset30和Dataset30_3。 图11显示使用这三个数据集获得的结果是一致的。
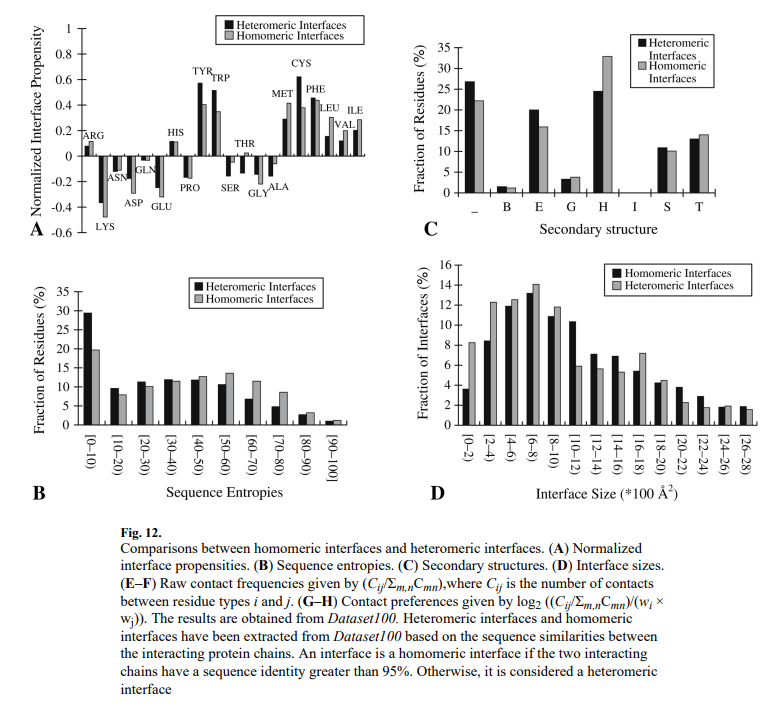
3.4 同质界面与异质界面的比较 Homomeric Interfaces Compared with Heteromeric Interfaces
一些研究表明,不同类型的接口具有不同的特点[17,30]。我们根据相互作用链之间的序列同一性将Dataset100分为异源界面和同质界面,并比较两种类型界面的特征(图12)。图12A显示了残基的归一化界面倾向。结果表明,疏水残基(Ile,Val,Leu,Phe,Cys和Met)对同聚体界面和异聚体界面均具有较高的正倾向,而亲水性残基(Lys,Asn,Asp,Gln和Glu)具有负倾向。这表明两种类型的界面均比其余蛋白质疏水性更高。图12A还显示,Cys和芳族残基(Phe,Trp和Tyr)在异聚界面上比在同聚界面上具有更高的倾向。疏水残基(Ile,Val,Leu和Met)的同质性界面比异质性界面的倾向更高,带电残基(Arg除外)则相反。这表明同质界面比异质界面更疏水。 该结果与以前的研究结果一致[17,30]。图12B显示,异源界面比同质界面具有更多的具有低熵(保守的)的残基,这表明异源界面比同质界面更保守。这可能与以下事实有关:异聚体界面涉及两种不同的蛋白质,并且一种蛋白质中的突变需要相互作用蛋白质中的互补突变以恢复相互作用功能,而同聚体界面涉及两条相同的链,一个突变会影响两者接口的侧面。因此,在异聚体界面上突变的耐受性较差。二级结构组成的比较(图12C)显示,与同聚体界面相比,异聚体界面具有更多的环(_)和延伸链(E)和更少的α-螺旋(H)。图12D示出了异聚界面和同聚界面的界面尺寸的分布。两种类型的接口的峰值范围都在600–800Å2之间。但是,同分异构体的界面要比异聚体界面大:63%的同分异构体界面大于800Å2,而只有53%的同分异构体界面大于800Å2。同聚体界面的平均尺寸为1,311Å2,异聚体界面的平均尺寸为1,112Å2。这一结果与以前的研究结论一致,即同质异构体的界面大于异质异构体的界面[30]。图12G–H显示带有相反电荷的残基之间的接触(Arg–Asp,Arg–Glu,Lys–Asp和Lys–Glu)和疏水残基之间的接触(图右下角的红色区域)。在两种类型的接口中均首选12G–H。与同聚体界面相比,异聚体界面具有相对更多的涉及Cys或芳族残基(Phe,Tyr和Trp)的接触。这些残基的图12G中的列和行比图12H中的相应条目更频繁(红色)。
四、结果讨论
在这项研究中,我们比较了蛋白质核心,界面和非界面表面的各种特性,通过分离出溶剂可及性的影响来分析界面特性,并研究了同质性界面和异质性界面之间的差异。
与以前的研究相比,这项研究的重要方面包括:(1)使用蛋白质-蛋白质界面的大型数据集; (2)使用对序列相似性和结构分辨率有不同约束的三个数据集来确认结果; (3)分离溶剂可及性对分析蛋白质-蛋白质界面特征的影响。
我们发现溶剂可及性会影响残基的分布,因此在寻找可以区分界面与蛋白质其余部分的功能时,考虑溶剂可及性的影响至关重要。通常,亲水性残基在蛋白质中高度易接近溶剂的部分更常见,而疏水性残基在掩埋部分中更常见。因为蛋白质核心残基的溶剂可及性比界面残基低,非界面表面残基的溶剂可及性比界面残基高,所以这些基团之间的残基分布不仅受到这些基团功能的不同,而且还受到其差异的影响。要评估残留物是否因功能而对界面具有特殊的偏好,必须将溶剂可及性的影响分开。在这里,我们通过将蛋白质-蛋白质界面与一组具有相同溶剂可及性的残基进行比较来做到这一点。这使我们能够分离出溶剂可及性对残基分布,二级结构和序列熵的影响。比较表明趋势是疏水残基在界面中是优选的,而亲水残基不是。相反,当我们将界面与全部残留物进行比较时,也就是没有分离出溶剂可及性的影响时,则没有观察到这种趋势。
结果清楚地表明,界面具有更多的疏水残基和更少的亲水残基。疏水残基的界面对于稳定蛋白质复合物至关重要。据报道,蛋白质-蛋白质复合物在水溶液中的形成是由熵驱动的过程[34]。人们认为掩埋疏水表面补丁会产生很大的熵增益,从而为形成蛋白质复合物提供了动力,从而稳定了所得复合物。结果还表明,接口更加保守。保守的界面对于维持进化过程中蛋白质间的相互作用至关重要。
我们发现,Cys–Cys接触,带相反电荷的残基之间的接触以及疏水性残基之间的接触在整个蛋白质-蛋白质界面上更为频繁。疏水相互作用已被广泛接受为两种蛋白质相互作用的主要稳定力。一些研究表明,带电残基之间的相互作用也促进了蛋白质之间的相互作用[35,6]。 Bahar和Jernigan [35]指出,在近距离处,成对的亲水性残基之间的相互作用尤为重要。而疏水相互作用在更长的距离上很重要。 Cys–Cys对可以通过形成二硫键来促进相互作用[9]。我们获得的结果证实,二硫键,盐桥和疏水性相互作用是蛋白质间相互作用的重要力量。
我们还发现,芳族残基在界面处更常见。芳族残基可在庞大的疏水性侧链之间形成强烈的疏水性相互作用。除疏水作用外,两个芳香环的平行排列通过产生更紧密的堆积和更好的几何配合,进一步发挥了作用。界面中芳族残基的丰度提高可能意味着这些环结构可实现更精确的几何拟合。在这项研究中观察到芳香族残基之间频繁的相互作用。
参考资料
- Protein J. Author manuscript; available in PMC 2008 Oct 10.Characterization of Protein–Protein Interfaces. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2566606/#R27
