【6.4.4】反竞争性抑制剂
这是一类只能与酶和底物复合物(ES)结合,但不能与游离的酶结合的抑制剂。一旦与ES结合,它们就导致与活性中心结合的底物不再能够转变为产物。
反竞争性抑制剂之所以只能与ES结合,可能是因为底物本身直接参与抑制剂的结合,也可能是因为与底物结合将导致原来不能结合抑制剂的位点构象发生改变,转变成能够结合抑制剂的构象。抑制剂抑制的机理可能是因为它的直接作用,也可能是因为其结合导致活性中心的构象发生了变化。
反竞争性抑制剂的存在可能只有理论上的可能,因为迄今为止,还没有文献报道过现实中有哪一种酶受到一种反竞争性抑制剂的作用,因此,有关对它们的描述仅有理论上的价值。
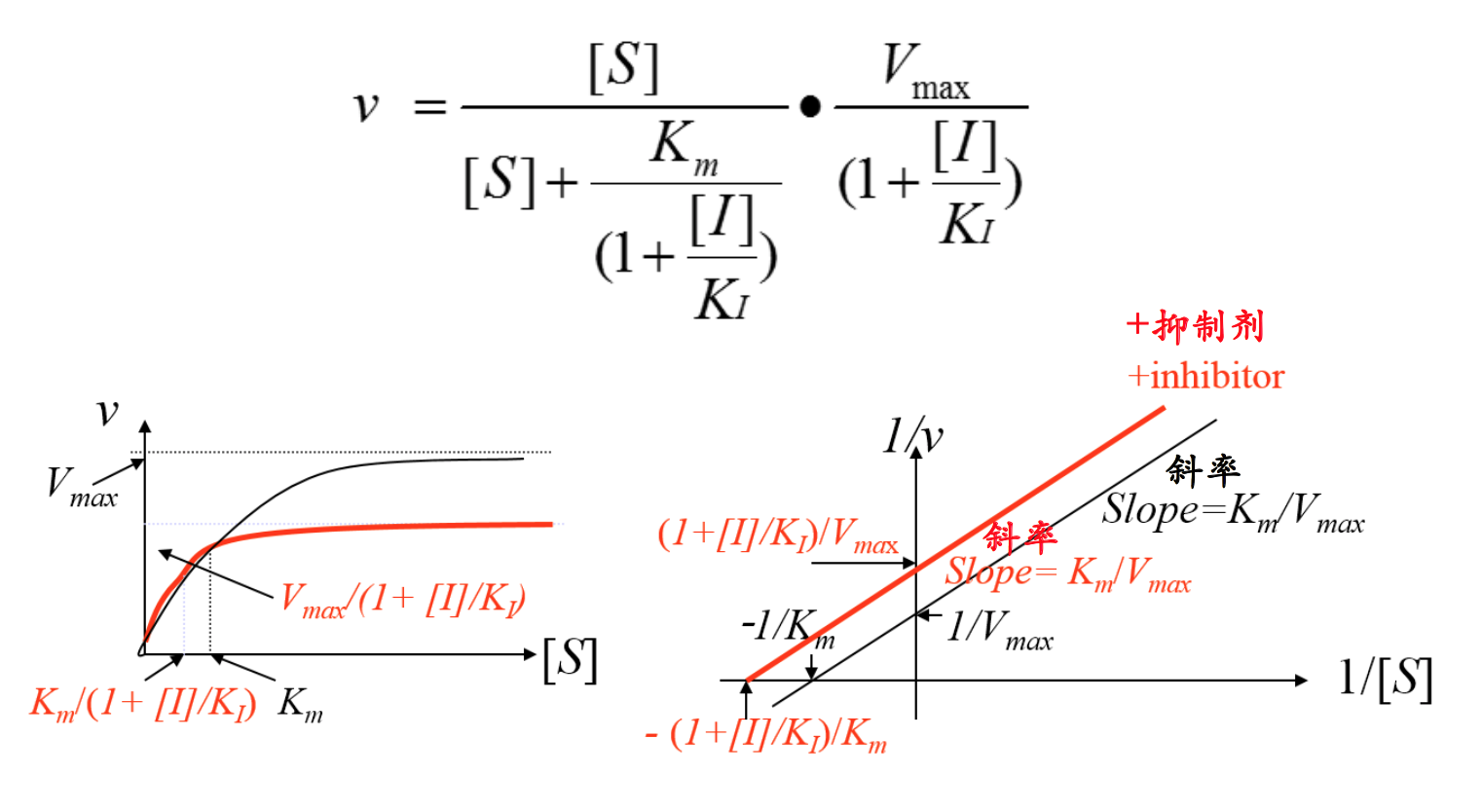
反竞争性抑制剂的存在能降低酶的表观Km。Km的降低有点出乎意料,对此的解释是:抑制剂能有效地与ES复合物结合,形成EIS三元复合物,从而减少了ES浓度。根据化学平衡理论,这相当于把酶与底物结合反应的平衡拉向右边,即有利于酶与底物的结合,从而导致酶与底物结合的亲和力的增加,即表观Km降低。
- 反竞争性抑制剂单独不能与酶结合,只能与结合有底物的酶结合(Uncompetitive inhibitors alone cannot bind to enzymes, only bind to the ES complex)
- 其存在可导致Vmax和Km下降(Uncompetitive inhibitors can decrease both Vmax and Km)
- 为什么反竞争性抑制剂似乎能够提供酶与底物的亲和力?你必须用化学平衡移 动的理论来解释( Why do uncompetitive inhibitors seem to increase the enzyme affinity for binding substrates? You have to explain it using “The Chemical Equilibrium Theory”)

反竞争性抑制的动力学(Kinetics for uncompetitive Inhibition)
参考资料
- 南京大学 杨荣武老师 《结构生物学》课件
这里是一个广告位,,感兴趣的都可以发邮件聊聊:tiehan@sina.cn
![]() 个人公众号,比较懒,很少更新,可以在上面提问题,如果回复不及时,可发邮件给我: tiehan@sina.cn
个人公众号,比较懒,很少更新,可以在上面提问题,如果回复不及时,可发邮件给我: tiehan@sina.cn

