【9.6.2】真核 mRNA 的 5'-非翻译区的翻译控制
真核 5' 非翻译区 (UTR) 对于核糖体募集到信使 RNA (mRNA) 和起始密码子选择至关重要,并且在控制翻译效率和塑造细胞蛋白质组方面起着重要作用。核糖体起始复合物通过帽依赖性或帽非依赖性机制组装在 mRNA 上。我们描述了通过 5' 上游开放阅读框、翻译起始因子以及 5' UTR 的一级和二级结构(包括特定序列基序)控制核糖体扫描和起始密码子选择的各种机制。我们还讨论了通过真核起始因子 2 的磷酸化进行的翻译控制,这与学习和记忆、神经退行性疾病和癌症有关。
大多数真核 mRNA 是通过扫描机制翻译的,该机制从组装 43 S预启动复合物 (PIC,preinitiation complex )开始,该复合物包含三元复合物 (TC)中的甲硫氨酰引发剂 tRNA (Met-tRNAi ),并结合三磷酸鸟苷 (GTP)真核起始因子 2 (eIF2)。43 S PIC 组件受 eIF 1、1A、3 和 5 刺激(图 1)。eIF4F 复合物(由帽结合蛋白 eIF4E、eIF4G 和 RNA 解旋酶 eIF4A 组成)和聚 (A) 结合蛋白 (PABP) 促进了其随后在 m 7 G 加帽的 5' 末端与 mRNA 的连接。PIC 使用与 Met-tRNA i反密码子的互补性扫描 mRNA 5' 非翻译区 (UTR) 中的 AUG 核苷酸三联体起始密码子. AUG 识别引起与 eIF2 结合的 GTP 的水解,以产生稳定的 48 S PIC。eIF2-GDP 释放之后是加入大 (60 S ) 核糖体亚基,由 eIF5B 催化,产生 80 S起始复合物,准备开始蛋白质合成(图 1)(1)。扫描机制有例外,其中 PIC 由 5’UTR 中的特殊序列招募,称为内部核糖体进入位点 (IRES)。
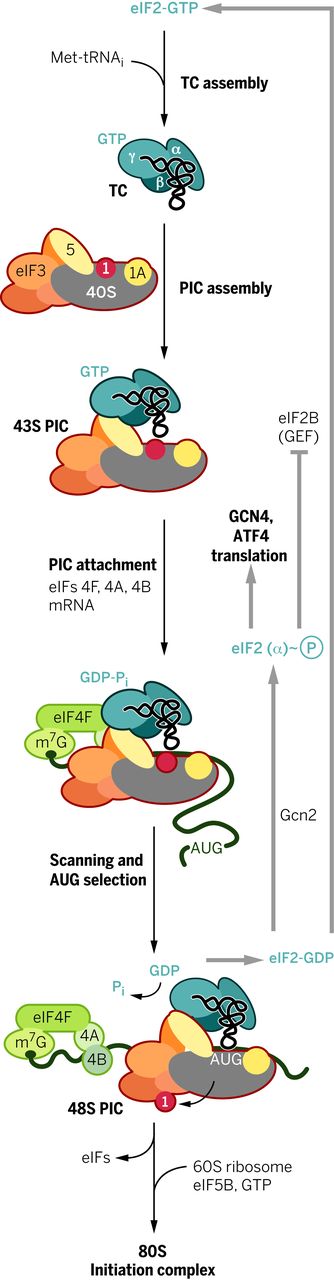
图 1 翻译起始扫描机制。 描述了萌芽酵母 eIF3 的更简单的 5 亚基版本。
翻译起始扫描机制
扫描的性质,其 5' 到 3' 的方向性,决定了起始密码子通常是最接近 5' 末端的 AUG 三联体,首先被扫描 PIC 遇到。当第一个 AUG 被不利(unfavorable )序列(称为“泄漏扫描”(leaky scanning)的过程)两侧时,可以跳过第一个 AUG 以使用下游 AUG。哺乳动物中一个有利的序列背景是“Kozak 共识”,5' (A/G)CC AUG G 3' ( 2 )。尽管在植物和真菌中并不总是相同,但 AUG 中 –3 位的嘌呤既是保守的,并且在所有生物体中的功能上都优于其他位置(1)。当上游 AUG (uAUG) 与下游 AUG 处于读框内且没有插入终止密码子时,可能会以某种频率发生泄漏扫描,以允许产生仅 N 端延伸不同的两种蛋白质异构体,较长的形式通常被靶向到特定的细胞室。如果 uAUG 后跟相同开放阅读框 (ORF) 中的终止密码子,则上游 ORF (uORF) 的翻译将减弱下游主要 ORF 的翻译,因为重新启动通常效率低下(图 2A)。一些 uORFs 抑制下游翻译主要是因为核糖体在翻译过程中停滞,并为扫描绕过 uORF 起始密码子的 PICs 设置了障碍(图 2B))。这些原理解释了这样一个事实,即细菌中常见的多顺反子 mRNA 在真核生物中很少见 ( 1 )。
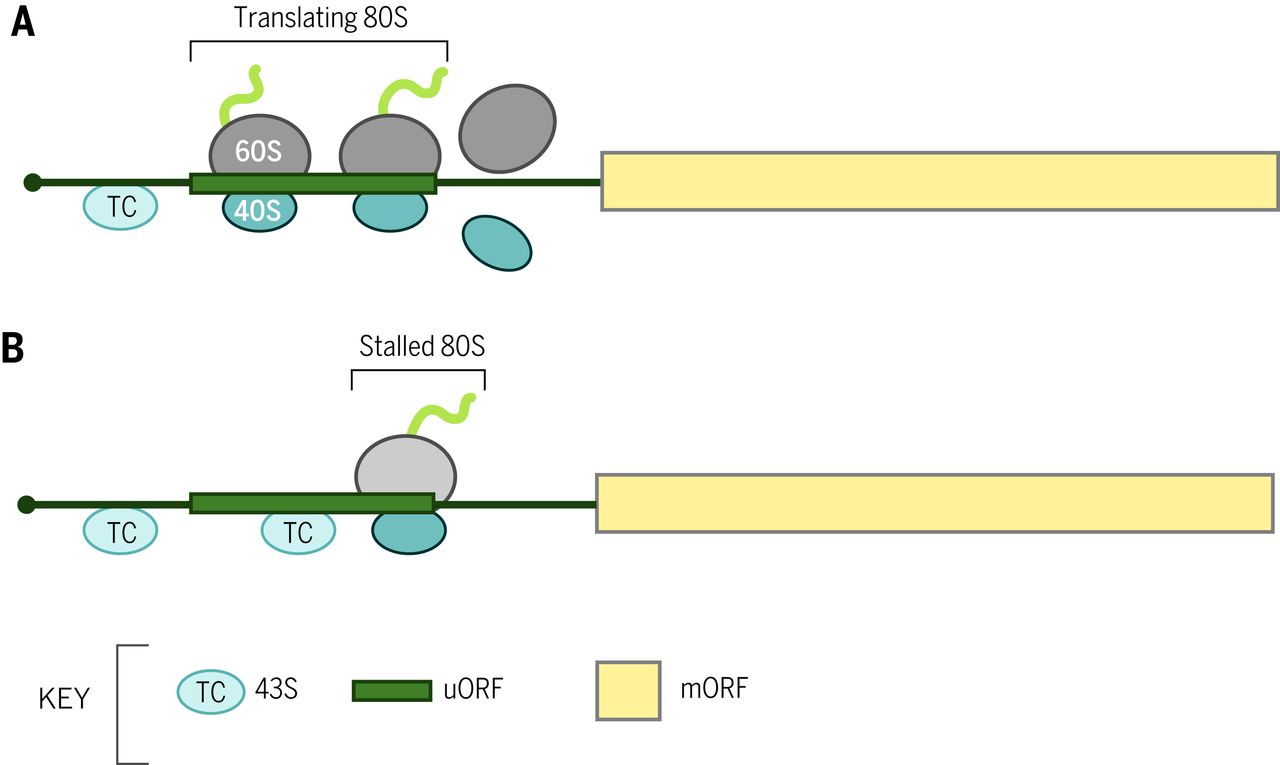
图 2 短 uORFs 的平移控制机制。 (A)从 mRNA 5' 端扫描的 43S PIC 翻译 uORF(作为 80S核糖体),并且游离亚基在终止后与 mRNA 分离,阻止主要 ORF(mORF)的翻译。( B ) 80 S核糖体在 uORF 编码的衰减肽的延长或终止过程中停滞,并为扫描 43S PIC 设置了屏障,这些PIC 会泄漏扫描 uORF 起始密码子,从而阻止 mORF 的翻译。失速是由小分子调节的。
“近同源”(Near-cognate)三联体与 AUG 相差一个碱基,可以通过扫描 PIC 选择但频率较低,这是由于与 tRNA i的反密码子不匹配以及 48 S PIC随之而来的不稳定。NUG(N 是任何核苷酸)三元组通常功能最好,而 A(A/G)G 三元组最差,并且近同源词的使用比 AUG 更依赖于最佳上下文 ( 1 )。尽管 CUG 密码子通常由 Met-tRNA i解码,亮氨酰-tRNA Leu可以通过扫描 PIC 以需要非规范起始因子 eIF2A 而不是 eIF2 的方式参与。这发生在用于加载主要组织相容性复合体分子的抗原前体的合成中 ( 3)。
通过扫描 PIC ( 1 ) ,多个 eIF、tRNA i 的结构元件以及 40 S亚基的rRNA 和蛋白质组分参与区分 AUG 和非 AUG 三联体作为起始密码子,以及好的与差的 Kozak 上下文。eIF1 和 eIF5 具有相反的作用,eIF1 促进扫描和阻止对非 AUG 和恶劣环境中的 AUG 的识别,而 eIF5 拮抗 eIF1 功能。这些活动被用于大多数真核生物中 eIF1/eIF5 表达的自动调节和交叉调节 ( 4 ),因为 eIF1 AUG 处于弱环境中并且很难被识别,除非 eIF1 水平降至某个阈值以下 ( 5))。eIF5 起始密码子处的启动被 uORF 削弱,其 AUG 处于弱环境中,因此仅在低 eIF5(或高 eIF1)水平时才通过泄漏扫描有效绕过(图 3A)(4)。这些和其他起始因子(eIF1A、eIF2 亚基和 eIF3c)的酵母突变体可以增加或减少对次优起始密码子的歧视 ( 1 , 6 )。有可能通过这些因子的翻译后修饰或小分子来调节此类起始事件。
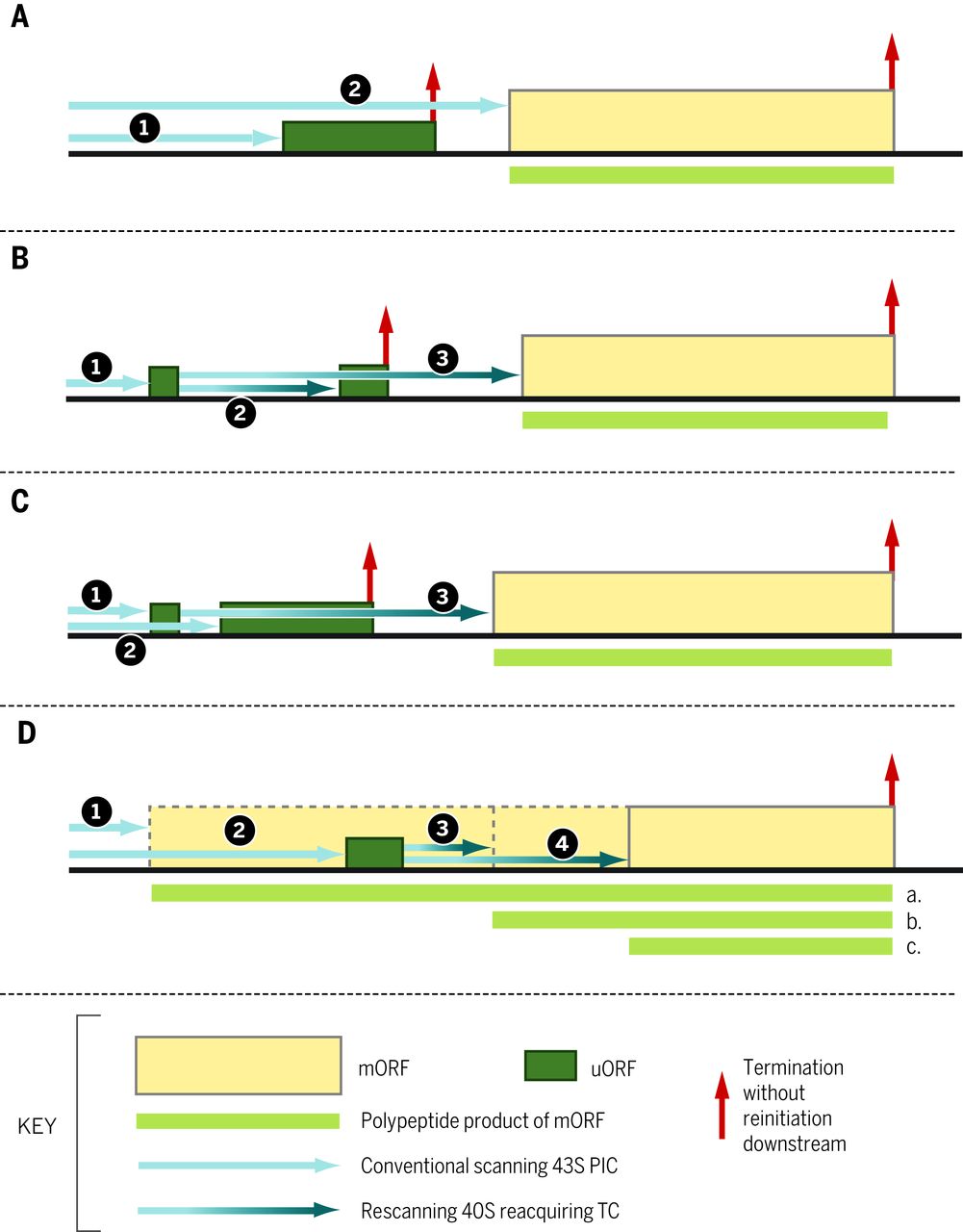
图 3 不同的基因结构通过短 uORFs 赋予翻译控制。 ( A ) 1. 扫描 uORF 的 PIC 无法在 mORF 处重新启动,如图 2 所示。一部分扫描 PIC 泄漏扫描 uORF 起始密码子,通过其次优上下文增强,并在 mORF 处启动。eIF5 水平升高可抑制渗漏扫描,降低 eIF5 基因本身的翻译 ( 4 );通过 eIF2(αP),例如,对于GADD34 ( 36 ) 和IFRD ( 35 );以及AMD1(编码 S-腺苷甲硫氨酸脱羧酶(SAMDC))和AZIN1(34)的多胺。(B) 1. 扫描核糖体启动短 uORF 的翻译,其翻译不排除重新启动。2. 恢复扫描后快速重新获取 TC 可以翻译抑制性下游 uORF,从而阻止进一步重新启动。3. 在 eIF2(αP) 引起的降低的 TC 浓度下缓慢重新获取 TC 允许在 mORF 的更下游重新启动。实例包括GCN4(37)和ATF4(38,39)。( C) 1. 扫描核糖体启动允许重新启动的短 uORF 的翻译。2. 泄漏扫描第一个 uORF 的核糖体翻译第二个抑制性 uORF,从而阻止重新启动。3. 翻译第一个 uORF 的核糖体仅在绕过第二个 uORF 后才恢复扫描并重新获取 TC,避免其抑制作用,例如植物中 SAMDC 合成的多胺调节 ( 34 )。( D) 1. 核糖体在与 mORF 同框的上游起始密码子处启动,并在延伸过程中绕过抑制性 uORF,同时产生具有特定特性的蛋白质同工型“a”。2. 由于其次优上下文,扫描子单元绕过帧内起始站点,并在 uORF 处启动下游。3. 重新扫描后快速重新获取 TC 导致在近端起始密码子处重新启动以产生蛋白质同种型“b”。4. TC 的缓慢重新获取允许在下游进一步启动,产生最短的同种型“c”,其活动与“a”和“b”相反。例子包括 C/EBP-α 和 C/EBP-β ( 49 )。
根据在酵母中的研究,显着延长 5’UTR 不会降低翻译效率,扫描 PIC 似乎是高度进行性的 ( 7 )。然而,过短的 5’UTR [≤20 个核苷酸 (nt)] 通常是有害的,并且会引起泄漏扫描 ( 1 , 8 )。实际上,酵母 5’UTR 的全基因组图谱鉴定了许多具有短 5’UTR 的 mRNA,其翻译效率 (TE) 低于平均水平 ( 9 )。由短 5’UTR 诱导的渗漏扫描允许从相同的 mRNA 产生在 N 末端不同的不同同种型 ( 1 , 10)。相比之下,短 5’UTR (TISU) 的哺乳动物 5’UTR 元件翻译起始子允许在 5’UTR 短至 5 nt 的 mRNA 上进行帽依赖性但扫描独立的起始。尽管不需要 eIF4A,但 TISU 的功能自相矛盾地取决于 eIF1 ( 11 ),这通常会阻止选择过于靠近上限 ( 8 )的 AUG 。编码线粒体蛋白的 mRNA 富含 TISU,这似乎可以在低能量水平下维持翻译 ( 11 )。 铁汉 09:57:48
5′UTR结构的翻译控制
5’UTR 中的二级结构也会影响次优起始密码子的起始效率。紧邻起始密码子下游的强茎环 (SL) 结构将使扫描 40 S亚基停滞,增加其“停留时间”,从而降低在较差环境中通过近同源或 AUG 三联体进行泄漏扫描的可能性 ( 12 ) .
尽管 SL 刺激效应需要精确的 SL-AUG 间距,但足够稳定的 mRNA 结构会抑制下游所有依赖于扫描的起始 ( 1 )。DEAD-box 三磷酸腺苷 (ATP) 依赖性 RNA 解旋酶可以克服 SL 结构障碍,并且它们可能专门用于 mRNA 结构的某些类型或位置。eIF4A 被募集到 mRNA 5' 末端并作为 eIF4F 的一个组成部分被激活,这一事实将 eIF4A 定位到 eIF4A 以促进帽附近的 PIC 附着,从而在 mRNA 5' 末端开始扫描 ( 1 )。eIF4E 过表达优先刺激含有过多二级结构的 mRNA 的翻译,这意味着 eIF4F 限制了具有结构化前导序列的 mRNA 的翻译(13)。哺乳动物 DHX29 和 DDX3 的酵母同源物 (Ded1) 似乎对于解析阻碍扫描的帽远端的稳定结构至关重要 ( 14 )。事实上,对 Ded1 和 eIF4A 酵母突变体中 TE 的全基因组分析表明,Ded1 高度依赖基因往往具有非典型的长和结构化 5’UTR,而 eIF4A 对所有 mRNA 的翻译贡献更大(15)。这在哺乳动物中有所不同,其中 eIF4A 依赖性是由能够形成稳定二级结构 ( 16 ) 或 G-四链体结构 ( 17 )的长 5' UTR 序列赋予的。此外,含有 5’UTR 二级结构的哺乳动物 mRNA 高度依赖 eIF4A 进行体外翻译(18)。Cap-近端结构也可以阻碍 eIF4F 与帽的结合 ( 19 ),并且 DDX3 涉及解析 Cap-近端 SL 以增强 eIF4F 募集 ( 20 )。
类似于帽端 SL 元件的抑制作用,哺乳动物中翻译控制的范例涉及由铁调节蛋白 (IRP) 和称为铁反应元件的帽端 SL 组成的 mRNA-蛋白质复合物的形成。在缺铁细胞中阻止 43 S与编码铁蛋白或其他铁代谢蛋白的 mRNA 的连接 ( 21 )。
uORFs 的翻译控制
5’UTRs 的全基因组测序显示 uORFs 是普遍存在的,发生在约 50% 的哺乳动物 mRNA 中,核糖体足迹分析有证据表明相当大一部分 uORFs 被翻译 ( 22 – 24 ),尽管只有一小部分产生足够丰富且稳定的肽以供检测 ( 25 )。在某些分析实验中检测到的 uORFs 的核糖体占有率可能高估了它们在细胞中的 TE(26 , 27)。对于在大量蛋白质合成减少的条件下由近同源物启动的 uORF 尤其如此,与用作主要 ORF 的起始位点相比,它们的代表性显着提高。然而,AUG 引发的 uORFs 的发生频率低于偶然预测的频率这一事实;当存在时,它们的起始密码子往往处于较差的起始环境中;它们的发生和翻译与下游 ORF 全基因组低于平均水平的 TE 相关;和它们显示的进化序列保守性的证据是好的指标AUG启动uORFs广泛的功能要减速翻译起始,而同样的证据不足为大多数非AUG启动uORFs(9,24,28, 29 )。通过 uORF 进行的调控可能与酵母减数分裂中的转录控制相结合,其中某些基因的转录起始位点向上游转移以包括一个或多个 AUG 启动的 uORF,这伴随着下游 ORF 的 TE 减少 ( 29 )。在 uORF 终止密码子处终止可以引发与 ORF 中过早终止密码子处无义介导的衰变途径相同的 mRNA 不稳定,从而放大 uORF 的抑制作用 ( 9 , 30 )。
尽管它们广泛发生,但直接证据表明特定 uORFs 抑制下游 ORFs 的翻译,仅存在于相对较少的基因中,有两种主要的控制机制在起作用。对于一类调节性 uORF,编码的肽会阻止延长的 80 S核糖体在 uORF 终止密码子处或附近参与其合成,从而为扫描漏扫描 uORF AUG 密码子的 PIC 创建“障碍”(图 2B))。这种障碍可以通过配体进行调节以实现翻译控制——例如,酵母CPA1 的精氨酸和粗糙脉孢菌 arg-2衰减肽 ( 31 , 32 ) 或ADM1 的亚精胺( 33), 34 )。
编码的肽序列与第二类调节性 uORF 无关,其功能仅用于从下游 ORF 起始密码子扫描 PIC(图 2A)。全基因组数据表明,这种 uORF 施加的障碍通常可以通过泄漏扫描来克服,这表明其 AUG 密码子更好地符合 Kozak 共识的 uORF 更具抑制性 ( 23 , 28 )。此外,上游起始密码子在较差的上下文中往往接近同源或 AUG 应该有利于泄漏扫描 ( 23 )。在应激条件下,抑制性 uORF 的泄漏扫描通过未知机制增加,这会引起 eIF2 α-亚基 eIF2(αP) 丝氨酸 51 的磷酸化(图 3A)(35)。这适用于 GADD34,它是一种蛋白磷酸酶-1 的靶向亚基,可使 eIF2α 去磷酸化,从而实现 eIF2(αP) 积累的自动调节 ( 36 )。eIF2α 的磷酸化将 eIF2-GDP 转化为鸟嘌呤核苷酸交换因子 eIF2B 的竞争性抑制剂,从而减少 TC 组装(图 1)(37)。这可能允许一小部分从帽扫描的 PIC 到达 uORF 而不携带 TC,绕过 uAUG(由于没有 Met-tRNA i),并在扫描 5’UTR 的其余部分时结合 TC,并启动在主 ORF。或者,磷酸化也可能改变 eIF2 在起始密码子识别中的功能,即使 TC 与 PIC 结合也允许泄漏扫描。
多个 uORF 的存在可以极大地放大 eIF2α 磷酸化对渗漏扫描的影响,如酵母GCN4 ( 37 ) 和随后的哺乳动物ATF4和ATF5 ( 38 , 39 )所证明的那样,它们编码有助于响应激活 eIF2α 的压力的转录因子激酶,例如激酶 Gcn2 的氨基酸剥夺(图 1)和蛋白激酶 R 样内质网激酶(PERK)的内质网应激。第一个 (uORF1) 被大多数扫描 PIC 翻译并优化以允许一小部分 40 S核糖体保持连接到 5’UTR 并重新启动下游(37)。对于GCN4 uORF1,uORF 上游的序列/结构在功能上与 eIF3 的 a 亚基和 uORF 终止密码子的富含 AU 的序列 3' 相互作用以允许扫描恢复(40)。由于非应激细胞中有丰富的 TC,“重新扫描”PIC 可以快速有效地重新结合 TC,在下游 uORF(s) 处重新启动,优化以从 mRNA 中驱逐后终止 40 S亚基并防止下游主要 ORF 的翻译。由 eIF2α 磷酸化引起的 TC 水平降低允许一部分重新扫描的 PIC 仅在泄漏扫描抑制性 uORF 后重新结合 TC,并在 ORF 处启动下游(图 3B))。由于非应激细胞中抑制性 uORF 的最小泄漏扫描,由于它们的最佳环境,只有适度减少它们的识别才会导致应激细胞中主要 ORF 翻译的大量增加 ( 37 )。这种机制能够快速、战略性地诱导关键转录因子,而降低的 TC 水平会抑制大量蛋白质合成,从而实现双管齐下的应激反应。 铁汉 09:57:49 uORF1 的短长度对于重新启动至关重要,并且可能有助于 eIF3 在其翻译过程中的保留 ( 37 )。在更长的 uORFs 后重新启动需要额外的顺式作用序列,例如多顺反子杯状病毒 mRNA 的终止上游核糖体结合位点 (TURBS) 元件,该元件与40 S亚基 ( 41 , 42 ) 的18 S rRNA 序列碱基配对,类似于 Shine-细菌 mRNA 和真核病毒 IRES(如 HCV)中的 Dalgarno 序列。一些蜂窝IRESS可能也起作用以这种方式(43,44)。eIF3 亚基在促进重新启动中的作用似乎很普遍(45 , 46)。辅助因子,包括ligatin / eIF2D或相关蛋白质MCT-1和DENR,可促进再引发,可能通过用于回收的Met-tRNA的一个替代途径我通过重新扫描的PIC(42,47)。
uORFs 在调节响应 eIF2(αP) 的重新启动中的作用与学习和记忆、神经退行性疾病和癌症有关。例如,由于 eIF2(αP) 减少,消除 Gcn2 可改善小鼠的记忆力,导致ATF4翻译减少( 48 )。CCAAT/增强子结合蛋白 (C/EBP) mRNA 中 uORF 施加的泄漏扫描与重新启动的替代结果决定了它们 N 末端不同同工型的平衡,一个激活和另一个抑制转录,对小鼠肝脏分化和再生很重要(图3D )( 49 )。uORF 在促进果蝇 msl-2翻译抑制方面的不同寻常的作用mRNA 与性致死 (SXL) 蛋白的 5’UTR 结合调节剂量补偿 ( 50 )。越来越多的与人类疾病相关的突变会增加或减少 uAUG/uORFs 对主要 ORF 翻译的影响 ( 28 , 51 )。
其他 5’UTR 调控元件
5' 末端寡嘧啶 (5’TOP) 基序在哺乳动物雷帕霉素靶标 (mTOR) 依赖性刺激翻译机制蛋白表达以促进细胞生长中发挥作用。mTOR 复合物 1 (mTORC1) 激活与 TOP 序列结合的 La 相关蛋白 1 (LARP1) ( 52 )。许多缺乏 5’TOP 的低丰度 mRNA 表现出 mTOR 依赖性,编码线粒体和生长/存活促进蛋白 ( 53 )。此外,5’UTR 序列的 m 6 -腺嘌呤甲基化似乎具有刺激作用(54)。
uORF 似乎在全基因组范围内影响翻译,这表明扫描在真核翻译组中广泛运行。然而,扫描可以通过使 PIC 能够在内部进入 5’UTR 的特殊元素来规避。在 5’UTR 中具有一段非结构化核苷酸的 mRNA 可以绕过对 m 7 G cap 和 eIF4F 的要求,如痘病毒 mRNA 5’UTR 中的 poly(A) 序列所示 ( 55 ) 和 Ω 中的 CAA 核苷酸三联体重复烟草花叶病毒 mRNA 的领导者。尽管 48 S组装本身是可有可无的,但 eIF4A 加速了 Ω 报告器的过程 ( 56 )。48 S 的eIF4F 独立性对于具有合成非结构化 5’UTR 的 mRNA,也观察到 PIC 组装,与 poly(A) 5’UTR 一样,仍然需要 eIF1、eIF1A、TC 和(在哺乳动物中)eIF3 ( 8 , 57 )。非结构化核苷酸可能直接结合在 40 S亚基的 mRNA 结合间隙中,eIF4A 的 ATP 水解使随后的 5' 到 3' 定向扫描成为可能。酵母中的一组 mRNA 对碳饥饿细胞中广泛的翻译抑制具有抵抗力,并且在它们的 5’UTR 中包含一个 poly(A) 伸展,可能通过 PABP-eIF4G 结合将 eIF4F 募集到 5’UTR,通过eIF4F ( 58 )。
许多病毒 mRNA 使用高度结构化的 IRES 元件绕过扫描过程,这些元件与 40 S亚基或特定 eIF 相互作用以将 PIC 募集到 5’UTR 的内部位点(59)。当 cap/eIF4F 依赖性启动受损时,这些机制仍然存在,例如在 eIF4G 被切割的病毒感染中。尽管病毒 IRES 已在生化和结构上得到广泛表征 ( 59 ),但尚未完成针对细胞 mRNA 中潜在 IRES 的此类研究 ( 60 )。全基因组搜索产生了大量哺乳动物细胞 IRES(随机选择的 5’UTR 的 10%)(44),如果对单个 mRNA 进行验证,对于理解人类的基因调控将非常重要。
在阐明 5’UTR 调节翻译起始的机制方面取得了重要进展。这包括对 PIC 组装和募集到 5’UTR、扫描和起始密码子选择的分子和结构理解。严重缺乏的是对该途径的精确动力学分析。单分子方法有望填补这一空白,并识别对于整体动力学检测而言过于瞬态的中间状态。核糖体分析 ( 22) 可用于分析所有 5’UTR 上扫描的动力学和调节。先进的低温电子显微镜将继续在不同的起始阶段产生 PIC 的高分辨率结构。这些新信息必将有助于发现治疗病因与翻译失调相关的疾病的新药。
参考资料
- Translational control by 5′-untranslated regions of eukaryotic mRNAs 。 https://science.sciencemag.org/content/352/6292/1413.full
