【8.3.4.1】构建环形RNA稳定高效表达蛋白
Daniel G. Anderson教授和他创立的Orna Therapeutics公司,今天我们将重点介绍,2018年大G发表在Nature Communication上的文章:Engineering circular RNA for potent and stable translation in eukaryotic cells.
此前提升线性mRNA的稳定性测策略包括使用UTR( beta globin mRNA 5’UTR),帽子类似物( methylguanosine cap analogs),修饰核苷酸(nucleoside modification ),密码子优化(codon optimization),这些方法对mRNA稳定性有适度的改善,但是还需要探索其他更好的方法。通过前面的介绍,我们知道circRNA不仅在细胞内非常稳定,而且具有编码蛋白的功能,所以大G就把目光锁定到circRNA,尝试探索下一代mRNA技术——在真核细胞中构建环形RNA来表达外源蛋白。
利用circRNA在真核细胞中翻译表达蛋白,总体来说,需要解决3个关键的难题:
- 如何实现RNA序列高效环化?
- 如何拿到高纯度circRNA?
- 如何实现circRNA高效表达蛋白?
一、添加同源臂完成long RNA的环化
体外RNA环化策略主要3种:
- 化学方法
- 连接酶方法(RNA or DNA ligases)
- 核酶方法(self-splicing introns)。
大G选择了一种具有自我剪接功能的T4噬菌体胸苷酸合成酶基因I型内含子序列(a permuted group I catalytic intron)来实现体外长RNA 环化,环化过程仅需要添加Mg+和GTP。
首先构建circRNA序列,3’Intron和5’Intron序列中间插入一段1.1kb序列,包括EMCV IRES(The internal ribosomal entry site,内部核糖体进入位点,是一种常见的RNA元件,用来启动 cap-independent translation),Gaussia luciferase 编码区,两个短的外显子序列(E1和E2)。通过体外转录反应合成出Precursor RNA,然后在镁离子和GTP存在下,发生两次酯交换反应(double transesterification reactions),形成circRNA。此方法之前就用于短RNA序列的成环反应,但是,大G发现用该方法无法成环,他推测可能是3’剪切位点和5’剪切位点之间相隔太远,降低了两个剪切位点接触的概率,从而降低成环效率,因为天然I型内含子两个剪切位点之间的距离只有300nt-500nt。
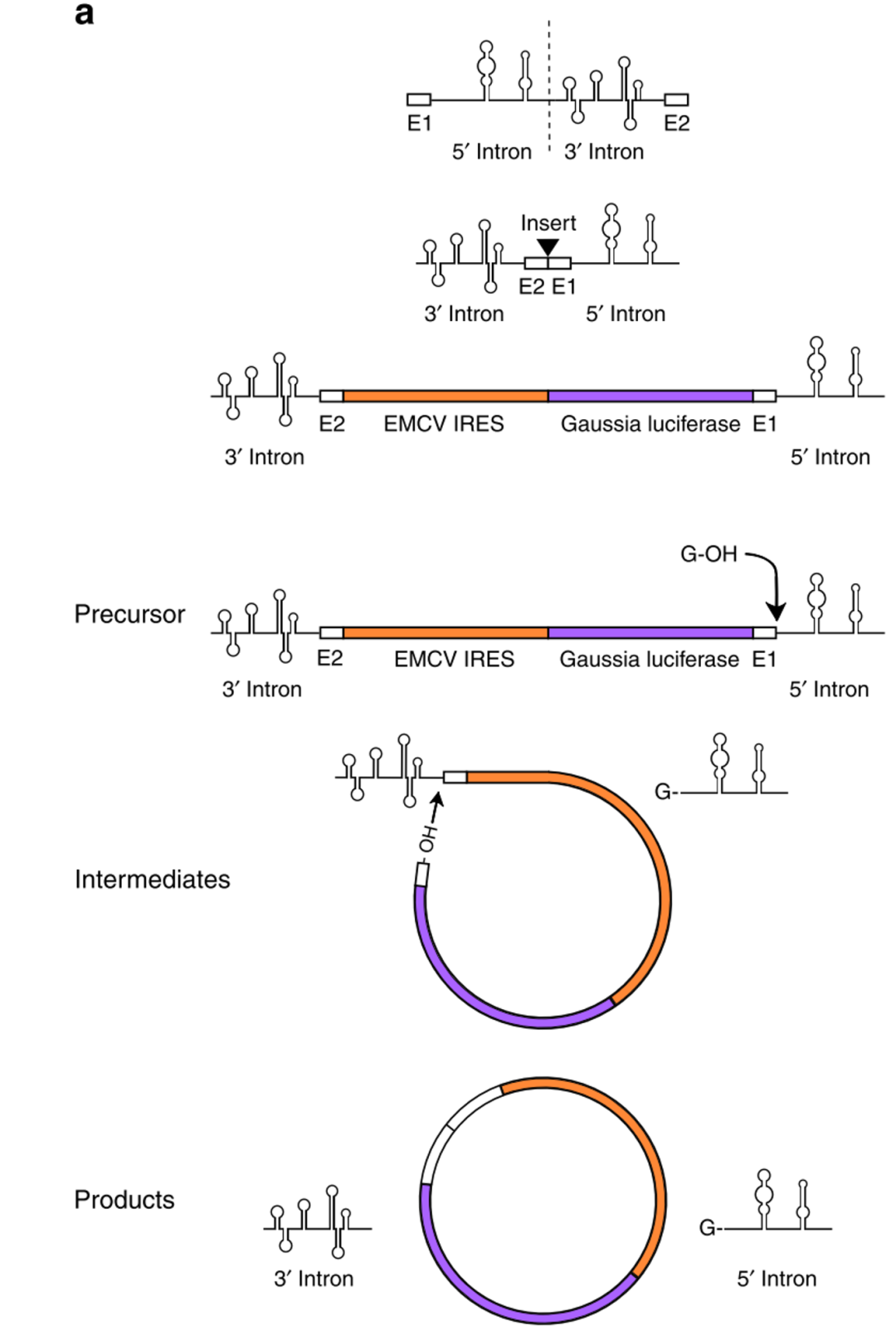 体外利用具有自我剪切功能的I型intron成环
体外利用具有自我剪切功能的I型intron成环
所以,接下来,他在Precursor RNA 5’末端和3’末端分别添加了9个碱基互补配对的同源臂(weak homology arm)和19个碱基互补配对的同源臂(strong homology arm),结果添加同源臂以后,成环效率一下子就上去了,weak homology arm成环效率从0增加到16%,strong homology arm成环效率从0增加到48%,这里通过琼脂糖凝胶电泳来评价同源臂对成环效率的影响。
 颜色表示碱基配对的可能性,红色表示配对可能性高。
颜色表示碱基配对的可能性,红色表示配对可能性高。
为了证实成环反应的主要产物是circRNA,需要用到RNase R和RNase H两种酶,RNase R是一种外切核糖核酸酶,具有5’到3’降解活性,可以高效水解所有的linear RNA;RNase H是一种内切核糖核酸酶,当形成RNA-DNA杂交分子时,能够水解RNA的磷酸二酯键:
- C:环化反应的产物,可以琼脂糖电泳可以看到circRNA,linear precursor RNA,nicked circRNA,三条带均出现。
- C+R:环化反应的产物+RNase R,降解掉所有的linear precursor RNA,只有circRNA和nicked circRNA 条带。
- C+R+H:环化反应的产物+RNase R+RNaseH,胶图中只存在nicked RNA条带,因为oligonucleotide-guided RNase H会将circRNA切开。
- U:未经环化的IVT反应产物,只有precursor RNA条带。
- U+H:未经环化的IVT反应产物,加入RNaseH以后,linear precursor RNA会被切割成两条带。
以上酶切反应,证实了环化反应确实生成了circRNA,但是存在nicked circRNA ,linear precursor RNA,splicing inter- mediates,excised introns副产物。
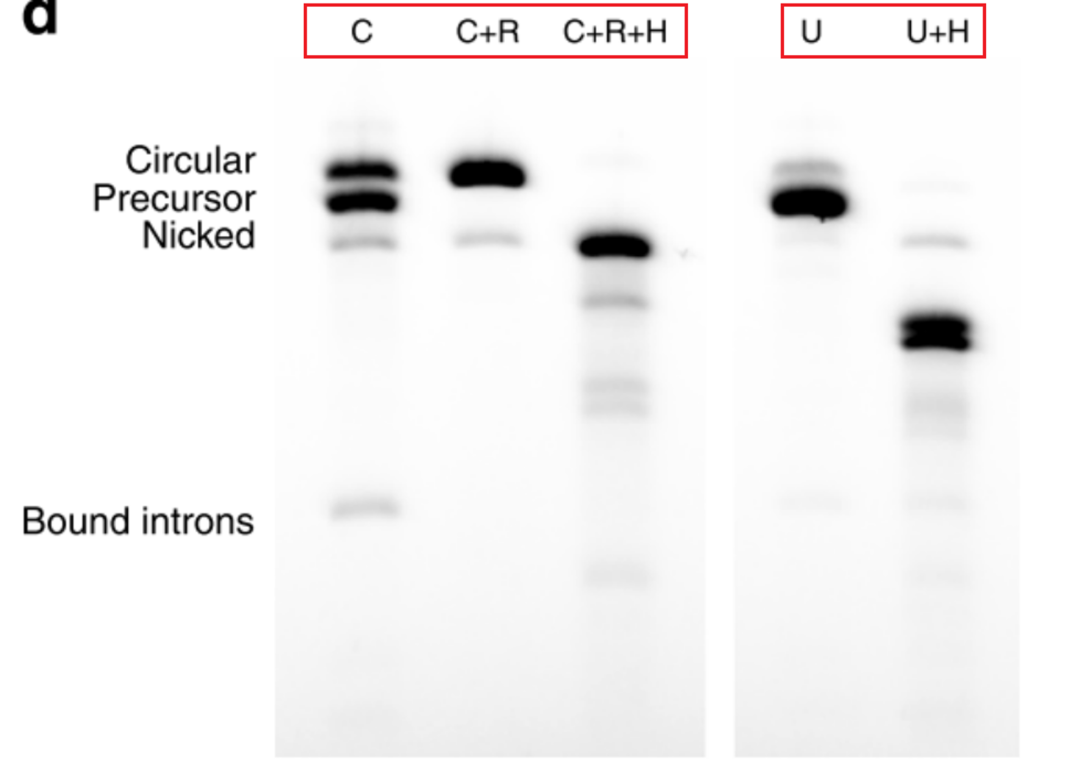
酶切反应验证环形反应的产物主要是circRNA
二、添加间隔序列(spacer)提升环化效率(circularization efficiency)
添加同源臂以后,环化效率只有48%,因此还需要找出进一步提升环化效率。由于IRES序列和3′ PIE splice site序列都高度结构化的,因此推测IRES序列可能会干扰剪切核酶的折叠能力,因此在3′ PIE splice site和IRES序列之间设计了一系列的间隔序列来阻止或者允许剪切环化,Permissive spacers 序列保留intron sequences内部的二级结构(对于核酶活性非常重要重要的序列),disruptive spacer破坏二级结构,特别是5’端intron sequences。结果发现,添加Permissive spacers可以把环化效率从46%提升到87%,而添加disruptive spacer会完全阻断剪切环化。通过添加同源臂和Permissive spacers能够环化长度在5kb 的RNA序列。
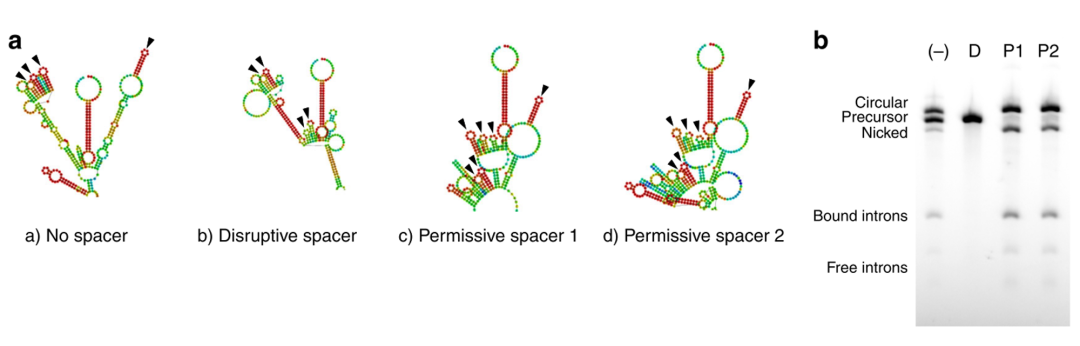
添加spacer序列提升环化效率
三、利用Anabaena PIE system 实现高效环化
使用以上相同的优化策略,大G从T4 catalytic intron 转向Anabaena catalytic intron ,并且在IRES序列和编码区3’末端添加了内部同源序列(internal homology),产生了一个独立的splicing bubble,环化效率上升到95%,并且与T4 catalytic intron相比较,nicked circRNA减少了37%。由于提升了剪切环化效率和circRNA产量,因此Anabaena catalytic intron在环化能力方面要强于T4 catalytic intron。
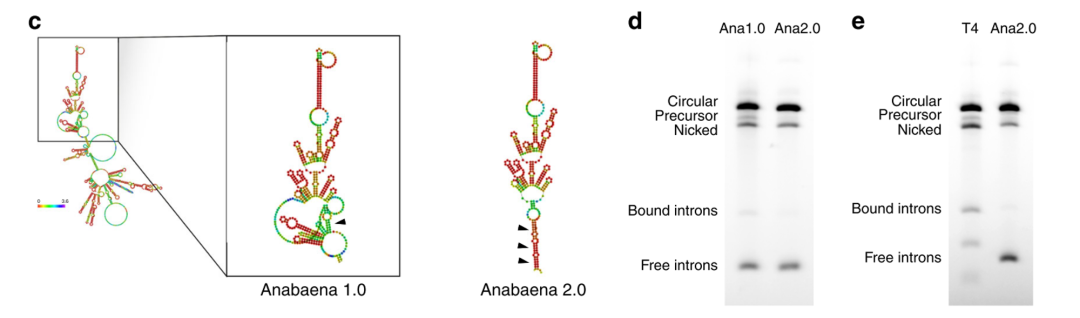
Anabaena PIE system
四、设计兼容不同CDS序列的Spacer
为了让circRNA construct可以有效环化各自不同的RNA序列,大G重新设计了Spacer,比较了不同长度的CDS序列环化效率,发现随着CDS-RNA序列增加,不仅环化效率和产量发生减少,环化产物中nicked circRNA 含量也会随着增加。Spacer设计需要优先考虑以下三点:
- 与IRES序列和邻近的Intron序列不存在同源序列,没有结构化的序列存在(不形成二级结构)。
- 可以将Intron序列和IRES序列分离开来,确保每一个元件可以独立折叠,独立发挥功能,不会彼此影响。
- 两个sapcer序列之间有一部分互补区域来促进splicing bubble的形成,splicing bubble含有具有催化功能的内含子序列。
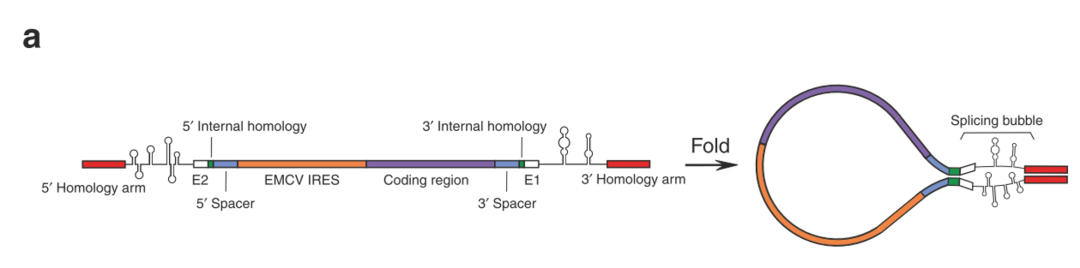 circRNA序列组成
circRNA序列组成
不同长度的CDS序列环化效率,Gaussia luciferase (total length: 1289nt);human erythropoietin (1313nt);eGFP (1451nt);Firefly luciferase (2384nt);Cas9 endonuclease (4934nt)
五、外源性circRNA在细胞内高效表达蛋白的优化策略
首先,研发人员把circRNA construct(RNase R-digested splicing reactions) 转染到真核细胞中,发现circRNA可以在细胞内表达出蛋白,但是由于RNase R 很难完全将precursor RNA消除掉,因此为了试验circRNA纯度对于蛋白表达的影响,研发人员构建了缺失splice site 的circRNA construct,也就是无法完成环化反应,全部是precursor RNA,转染细胞后,结果显示precursor RNA无法表达蛋白。
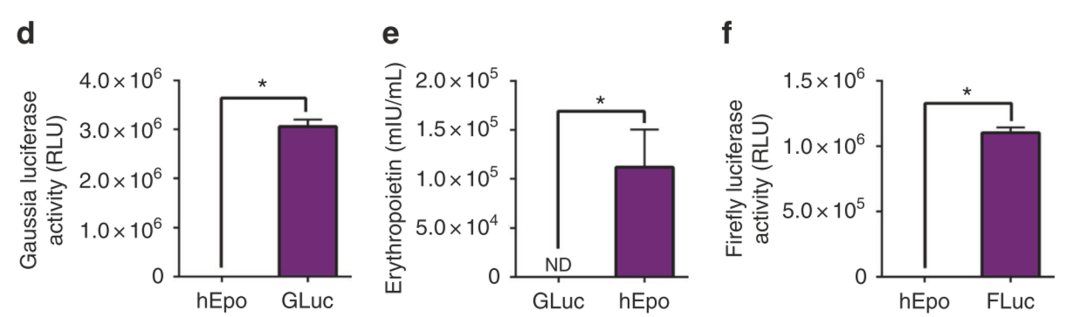
circRNA可以在细胞内表达出蛋白
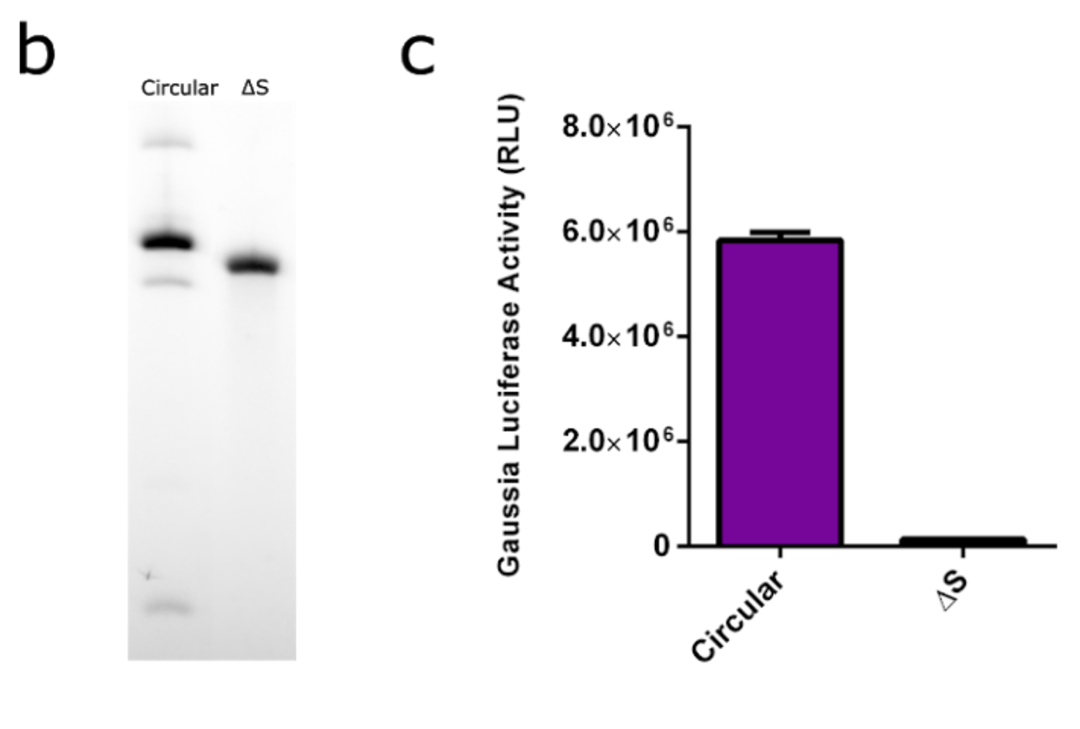 precursor RNA无法表达蛋白
precursor RNA无法表达蛋白
由IRES介导的Cap-independent translation蛋白反应表达效率依赖于细胞环境,不同的细胞,表达效率不相同,一般认为,IRES介导的Cap-independent translation蛋白表达效率不如Cap-dependent translation高。另外,polyA尾巴可以稳定和改善线性RNA表达效率。因此,研发人员试验了不同的IRES序列和添加PolyA尾巴对circRNA construct蛋白表达效率的影响,结果发现CVB3 IRES序列介导的蛋白表达效率在不同类型的细胞中都是最高的。在circRNA construct3' 末端添加ployAC或者ployA,也能够提升IRES序列介导的蛋白表达效率。
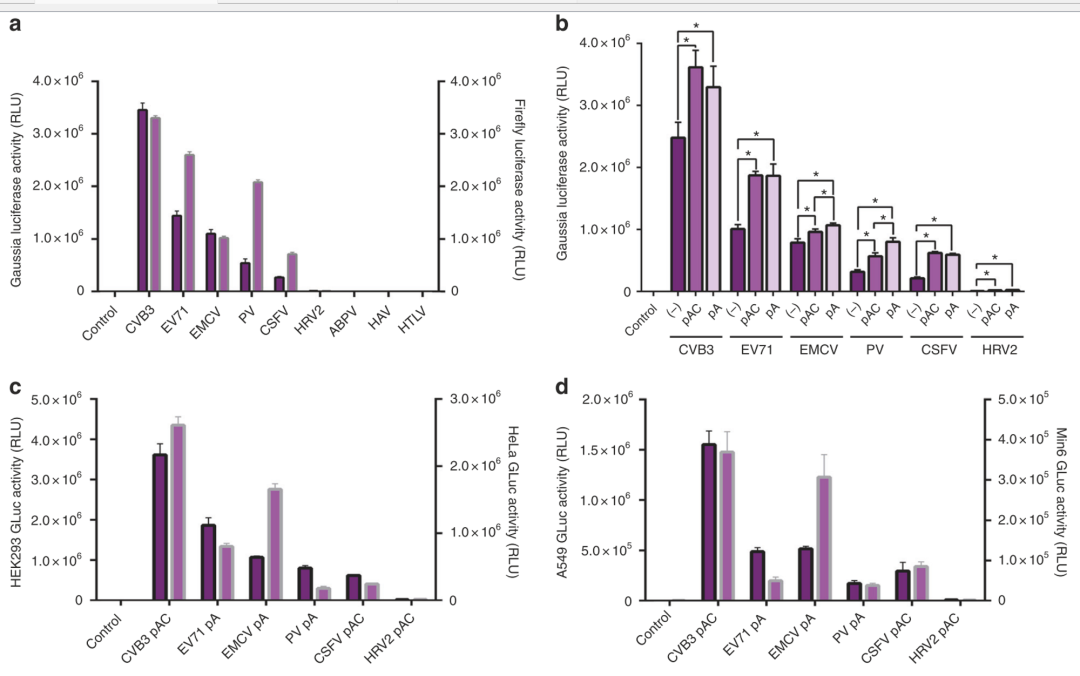
不同的IRES序列和添加PolyA/polyAC尾巴对circRNA construct蛋白表达效率的影响
六、使用HPLC纯化circRNA
circRNA纯度是另外一种提升蛋白表达效率的策略,并且避免引起机体的先天性免疫。少量的circRNA纯化可以用琼脂糖电泳凝胶,大量的circRNA纯化使用HPLC,两者方法在纯度上可以实现90% circRNA,10% nicked RNA。然后,再用RNase R消除 linear RNA。可以看到,使用HPLC纯化circRNA,对蛋白表达效率的提升优于用琼脂糖凝胶纯化或者只用RNase R处理。
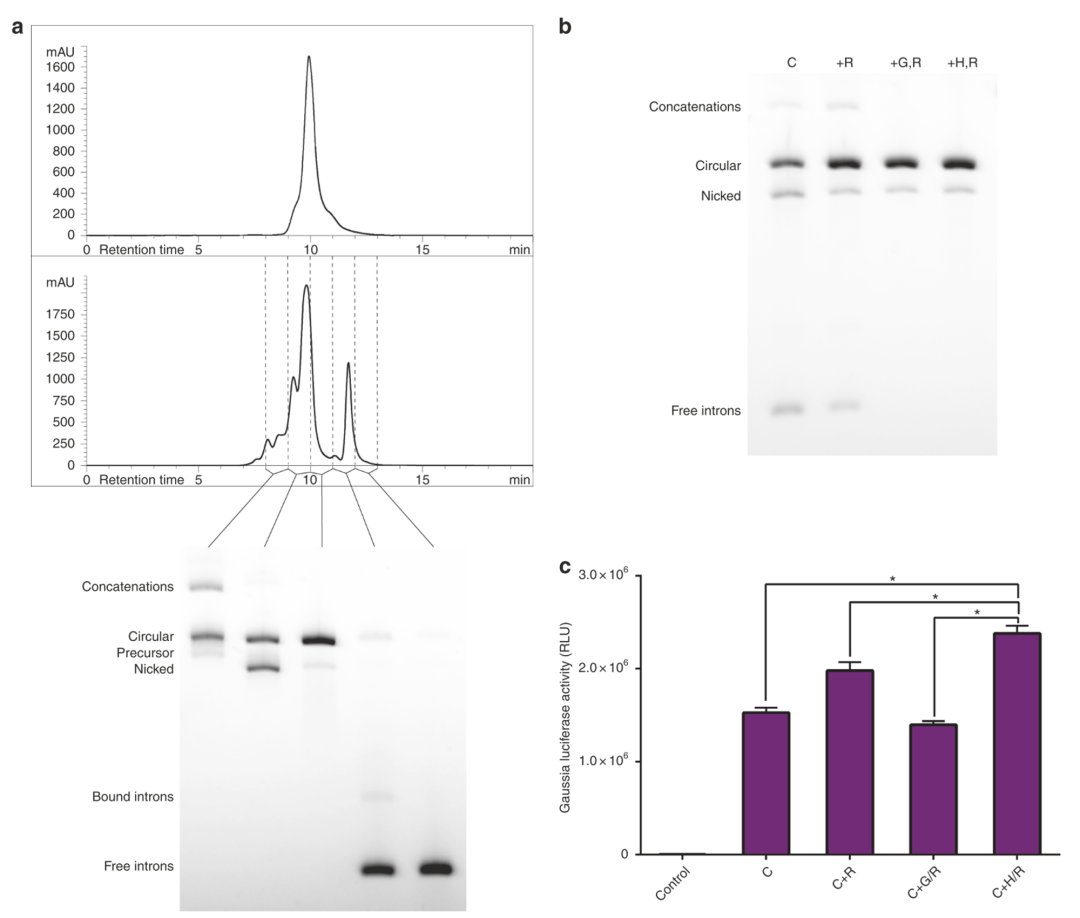
HPLC纯化circRNA
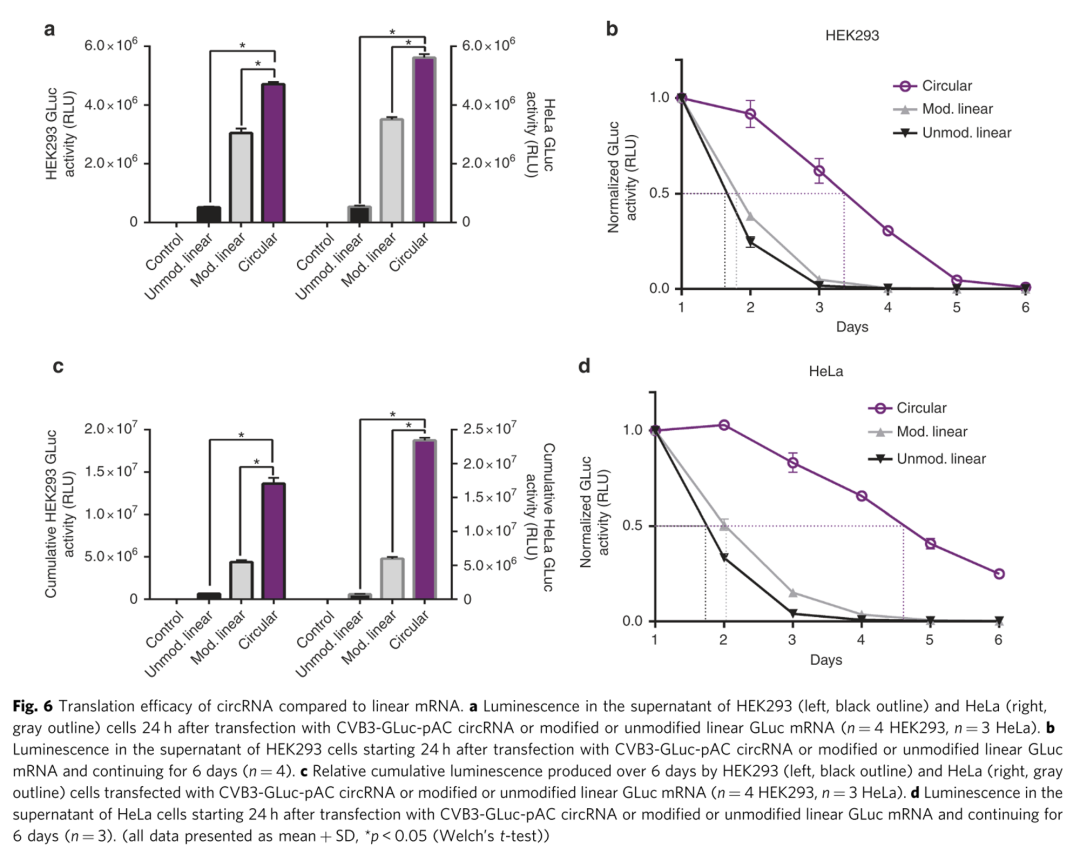
七、circRNA蛋白表达效率与linear RNA比较
研究人员发现circ RNA表达蛋白表达效率和稳定性完胜未经修饰的linear RNA(具有帽子结构,核苷酸未经修饰)和化学修饰的linear RNA(尿嘧啶和胞嘧啶经过化学修饰)。
八、总结
总的来说,这篇文章通过序列优化,包括增加同源臂,间隔序列,筛选剪切能力强的I型内含子序列,初步解决长RNA序列的成环反应,并且有一个比较好的成环效率。另外一方面,通过纯化策略和筛选IRES序列以及添加polA尾巴,增强了circRNA在细胞内的蛋白表达稳定性和效率。但是,透过这些优化策略,我们可以看到circRNA在产业化方面存在严重的问题,成环效率会随着RNA长度增加降低,成环副产物复杂,没有解决大规模纯化问题,IRES序列介导的蛋白表达严重依赖细胞环境等等,再没有找到一个普适的环化载体序列以前,circRNA的产业化之路并不明朗。
参考资料
- https://mp.weixin.qq.com/s/F2mumxHdfjXQp1qXC0orxg
- https://www.nature.com/articles/s41467-018-05096-6 。 Engineering circular RNA for potent and stable translation in eukaryotic cells
