【5.2.1.5】同义密码子选择对合理蛋白质设计的贡献
扩展了安芬森原理:同义密码子选择对合理蛋白质设计的贡献
安芬森(Anfinsen)的原则断言,指定蛋白质结构所需的所有信息均以其氨基酸序列编码。但是,在通过核糖体合成蛋白质的过程中,新生链的N端可能在C端可用之前就开始折叠。我们测试了这种共翻译折叠是否可以改变体内编码蛋白的折叠结构,而与体外重新折叠形成的结构相比却没有。我们设计了一种荧光蛋白,该蛋白由三个半结构域组成,其中N端和C端半结构域彼此竞争,与中央半结构域相互作用。竞争的结果决定了所得折叠结构的荧光性质。在化学变性后重新折叠时,该蛋白质分别产生等摩尔量的N和C端折叠结构。相反,在大肠杆菌中的翻译导致N-末端折叠结构的形成提高了2倍。在C端半结构域5’端的罕见同义密码子取代进一步增加了对N端折叠结构的选择。这些结果表明,新生蛋白质从核糖体中出来的速率可以确定蛋白质的折叠结构。
使用一组精心挑选的模型蛋白质对蛋白质折叠进行了数十年的体外研究,但目前尚不清楚试管中的折叠模拟体内折叠的程度。(1,2)在这里,我们提供的结果证明了在翻译过程中共翻译折叠体内蛋白质合成可以改变蛋白质的折叠结构,而不是在试管中形成的结构。
选择用于体外折叠研究的许多模型蛋白的关键标准是它们可折叠并可逆折叠。即,它们的折叠行为受热力学控制。(2,4)或者,一些蛋白质在动力学控制下发生折叠(图1),其中在未折叠的集合体和早期中间体中构筑的构型沿着能量分布选择特定的轨迹,从而确定蛋白质将采用两个(或多个)最终折叠结构中的哪一个。(5)在动力学控制下折叠的蛋白质有几个很好表征的例子(参见参考文献6-8),尽管这种蛋白质往往不被选择为蛋白质折叠模型,因为动力学控制使折叠机制的动力学和热力学特征复杂化。
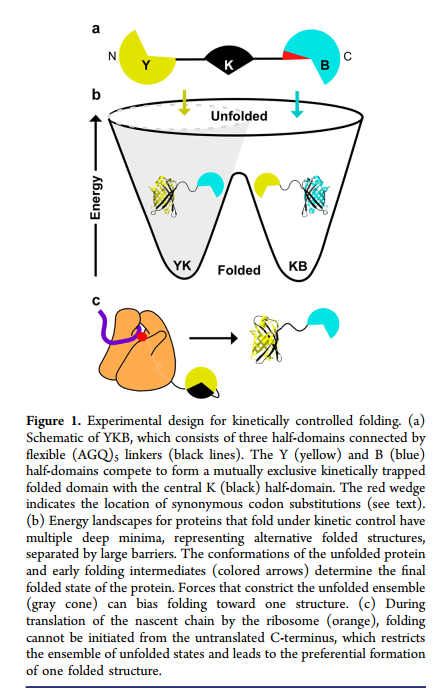
在细胞中,蛋白质可以开始进行共翻译折叠,同时正在合成新生链。(9-11)在翻译过程中,新生多肽链从核糖体出口通道中出现,随后该链的N端部分开始形成在C端部分合成和/或仍被限制在通道之前之前的天然样相互作用。(12,13)相反,通过从化学变性剂中稀释未折叠的全长多肽开始的蛋白重折叠可以开始通过沿着多肽链的任何地方形成的相互作用。(14)
我们假设最有可能具有受共翻译折叠显着影响的天然结构的蛋白质是
- 在动力学控制下折叠的蛋白质,即根据未折叠链和早期中间体的构象,可以采用两个或多个其他天然结构(4、5)
- 天然结构在动力学上稳定的蛋白质,因此不太可能在细胞的整个生命周期中展开和重新折叠。
为了检验共翻译折叠可以整体改变蛋白质折叠结构的假设,我们设计并构建了一种编码YKB(黄色-黑色-蓝色)的大肠杆菌表达系统,该蛋白质可以采用两种替代折叠结构。 YKB包含三个通过BiFC分裂荧光系统(15、16)通过柔性(AGQ)5接头(17)连接的半结构域(图1a)。我们设计YKB的目的是使其折叠代表N和C端半结构域与中央半结构域之间的竞争,这种竞争导致黄色(YK)或蓝色(KB)荧光,分别代表相互排斥的YK-B或Y-KB折叠结构的形成。替代结构的不同荧光性质使得能够使用生理学相关的翻译速率在体内监测该结构形成竞争的结果。而且,荧光蛋白折叠的结构是动力学稳定的。一旦形成,它们就不会在生物学相关的时间范围内展开和折叠。
正如预期的那样,通过从化学变性剂中进行稀释,全长YKB在体外重新折叠,产生的黄色和蓝色荧光的比例相当于YK和KB折叠结构的等摩尔形成(图2a,b)。相反,在体内表达的YKB产生更多的黄色荧光,表明YK折叠结构的优先形成,并反映了在C-末端半结构域可折叠之前N-末端和中央半结构域的优先结合。
我们假设,改变局部翻译速率,从而改变YKB新生蛋白质链的出现速率,可用于进一步调节蛋白质折叠轨迹并在其替代折叠结构之间进行选择。已知更改同义密码子使用会改变局部翻译率。(3,20,21)除甲硫氨酸和色氨酸外,所有氨基酸都可以由一个以上的mRNA密码子编码。但是这些同义词密码子的使用频率不相等,稀有密码子的翻译速度通常比普通密码子慢。(20)
为了提供翻译速率编码的开关来控制折叠结构的形成,我们使用了一种简单的算法(3)来产生同义的mRNA序列,该序列编码YKB C端半结构域中的短片段,并且所选择的序列没有明显的作用关于mRNA的稳定性(22),但仍使用了多种稀有的同义密码子(图2c,表S1,支持信息(SI);绿色的正值表示密码子比平均值更常见,而红色的负值表示密码子比平均值更罕见)平均)。我们假设密码子稀有度的增加会在此位置减慢翻译速度,从而增加N末端和中央半结构域在翻译过程中可相互作用的时间,而在核糖体出口隧道出现竞争性C末端半结构域之前。我们将密码子替换限制在一个短的mRNA片段上,以改变YKB局部翻译率,同时最大程度地减少其他不良影响,包括mRNA稳定性,总细胞YKB水平或细胞tRNA可用性的变化,这可能导致翻译过早终止或细胞生长受损率。
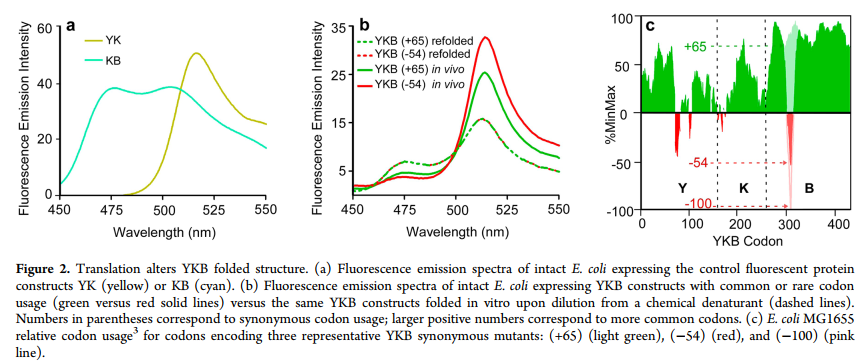
当使用同义稀有密码子对该YKB开关区域进行编码时,黄色荧光增加(图2a),表明翻译的多肽链优先形成了N端YK-B折叠结构。通过改变用于编码该区域的密码子的相对稀有性,可以控制YK与KB的形成(图3a),但不能改变YKB mRNA序列的其他5’部分(图S1a,b,表S1(SI))。这些密码子修饰的YKB变体的细胞内积累没有显着差异,我们也未检测到过早翻译终止产生的截短产物(图S1c,d(SI))。 LC-MS / MS分析证实,罕见的和常见的YKB变体翻译都不会在氨基酸掺入中产生可检测的差异(<1%)。这些变体的摩尔折叠比([YK] / [KB])与相对密码子稀有度的变化(Pearson相关系数= -0.85; P = 0.003)(t)相比与tRNA浓度更紧密相关(23)相对摆动碱基翻译速度,(21)mRNA稳定性(22)或%GC含量(图S2(SI)),尽管其中一些相关性之间的相似性可能反映了这些指标对相对翻译率的相互依赖性。
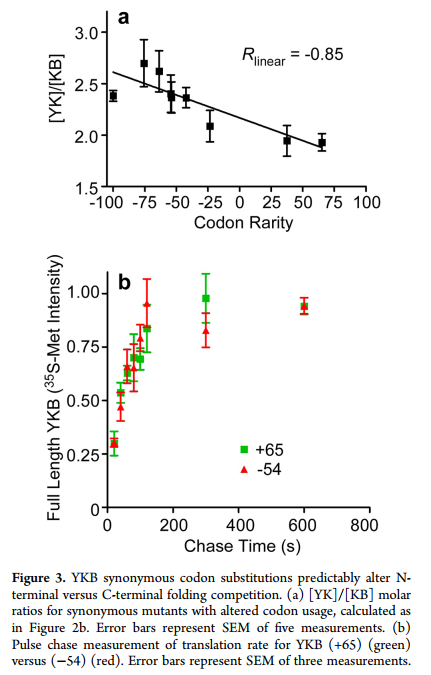
每个密码子修饰的YKB变体代表18个密码子窗口内仅几个同义密码子的替代(表S1(SI))。这些变化仅对总翻译速率产生了微妙的影响,因为我们无法使用常规脉冲追踪标记法检测到密码子修饰的YKB变体的合成速率存在显着差异(图3b)。然而,这种微妙的改变足以显着改变YK和KB替代结构的形成之间的竞争。这些结果表明,蛋白质折叠结构的显着变化可以由局部翻译速率的非常细微的差异触发,甚至由密码子使用的微小变化触发。
我们的结果表明,蛋白质天然结构可以通过翻译过程中新生链的矢量外观来塑造,而这种特征在体外重折叠实验中不存在。已知折叠与翻译过程的耦合可选择性稳定特定的折叠中间体(10、12、24、25),并且已证明改变翻译速率会影响几种蛋白质的折叠效率(9、26、27),提示翻译过程中途中折叠中间体的形成部分取决于翻译速率。我们的结果表明,除了调节折叠产量(天然的还是聚合的)以外,还可以以可预测的方式调整局部翻译速率,以改变两个替代折叠结构之间的选择。我们首次表明,对于一种能够形成其他折叠结构的蛋白质,可以通过改变mRNA序列特定部分中的同义密码子用法来预测性地指导该蛋白质折叠机制形成一种结构与另一种结构。
影响蛋白质结构的同义突变(例如本研究中描述的突变)对于在动力学控制下折叠的蛋白质可能特别重要。 更广泛地讲,细胞中的大多数蛋白质在进行化学变性时都无法重折叠。 相反,这些蛋白质会错误折叠并聚集。 这些蛋白质中的一些具有天然和变性状态,它们被极高的能量垒隔开(28),因此预计它们在细胞中的生命周期仅折叠一次。 在体内,此类蛋白质可能特别取决于通过局部翻译速率选择的共翻译折叠中间体的形成,以最有效地形成天然蛋白质结构。
参考资料
- J. Am. Chem. Soc. 2014, 136, 3, 858–861 Publication Date:January 6, 2014。Expanding Anfinsen’s Principle: Contributions of Synonymous Codon Selection to Rational Protein Design。 https://pubs.acs.org/doi/10.1021/ja411302m
